健脾补肾方对化学损伤模型小鼠造血系统的影响
2021-07-08肖静静何东初
肖静静,何东初
(1.湖北中医药大学,湖北 武汉 430070;2.中国人民解放军中部战区总医院,湖北 武汉 430070)
现代科技的进步给人类带来巨大的利益与帮助,但与此同时亦造成越来越多的化学致癌物进入人类的生活和生产领域,可能对人类健康产生损害,而造血系统又是此类损伤主要的受累部位[1]。有害化学物质诱导的氧化应激是造血细胞损伤的重要机制[2],化学损伤后造血细胞及其微环境中活性氧(reactive oxygen species, ROS)产生增加,超过体内抗氧化系统的清除能力,机体则不能准确地修复造血祖细胞和造血干细胞中DNA损伤,导致造血祖细胞和造血干细胞凋亡,造血祖细胞增殖减少,诱导造血干细胞自我更新及定向分化能力下降,损伤骨髓基质细胞导致造血干细胞龛稳态紊乱,最终导致骨髓抑制,骨髓衰竭[3]。造血细胞生长因子(hematopoietic growth factors,HGFs)对化学损伤导致的骨髓抑制具有一定的疗效,但其价格昂贵,并且其也会影响造血干细胞功能,加重造血干细胞功能损伤[4]。因此,寻找有效改善造血功能且安全、经济、毒副作用小的治疗药物成为目前化学损伤领域研究的重点。健脾补肾方(既往称地甘口服液)在中国人民解放军中部战区总医院临床应用十余年,在防治辐射及化学损伤方面取得了满意的疗效。前期临床试验表明该方能预防及治疗肿瘤放化疗患者外周血象的下降,改善造血功能,并且能提高患者的免疫功能[5-6]。前期动物实验表明该方能增强化学损伤小鼠骨髓细胞周期素基因(cyclinD1)和造血细胞及基质黏附分子(CD45、VCAM-1)的表达,减少脾脏及骨髓相关凋亡基因(bcl-2、bax)表达,促进造血细胞的增殖,抑制其凋亡等[7-12]。本研究观察健脾补肾方对化学损伤小鼠造血细胞氧化损伤及造血细胞凋亡的影响,揭示其对化学损伤保护作用的机制,为临床推广应用提供实验依据。
1 实验材料与方法
1.1实验动物 选取8~12周健康纯系小鼠60只,体重18~22 g,雌雄兼用,由湖北省医学科学院实验动物中心提供,动物合格证号:42000600004104。
1.2药物 健脾补肾方由熟地黄、炙甘草、当归、黄芪、泽泻、陈皮组成,由中国人民解放军中部战区总医院中药制剂室制备,经水煎、过滤、浓缩后,制成100% 浓度(含生药1 g/mL)和200% 浓度(含生药2 g/mL)的药液,分装备用。鲨肝醇,广州康和药业有限公司,批号:20100725。
1.3主要试剂及仪器 DMEM、胎牛血清、胰酶(Trypsin-EDTA),美国Invitrogen公司;细胞培养皿、细胞培养瓶,Corning公司;红细胞分离液,武汉巴菲尔公司;淋巴细胞分离液,武汉巴菲尔公司;GM-SF、低熔点琼脂糖、胎牛血清、谷氨酰胺;活性氧检测试剂盒,碧云天公司;微量移液器,德国Eppendorf公司;CO2恒温培养箱,日本SANYO公司;荧光酶标仪,美国BioTek公司。
1.4实验方法 60只小鼠适应性喂养1周,随机选择12只作为正常组,其余小鼠采用环磷酰胺以100 mg/kg的剂量腹腔注射,每天1次,连续3 d。造模成功后将小鼠随机分为模型组、健脾补肾方小剂量组、健脾补肾方大剂量组、鲨酐醇组各12只。模型组和正常组小鼠用生理盐水灌胃,健脾补肾方小剂量组和健脾补肾方大剂量组分别用100%浓度健脾补肾方和200%浓度健脾补肾方灌胃,鲨酐醇组给予鲨肝醇混悬液0.1 g/kg灌胃,均0.2 mL/10 g,2次/d。于灌胃第9天处死各组小鼠,收集外周血、骨髓进行相关检测。
1.5检测指标及方法
1.5.1外周血常规检测 全自动血液分析仪测定外周血中白细胞计数、红细胞计数、血小板计数和血红蛋白水平。
1.5.2骨髓细胞ROS水平检测 按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。分离骨髓单核细胞,将细胞悬浮于稀释好的DCFH-DA中,调整细胞浓度为106个/mL,37 ℃细胞培养箱孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清培养液洗涤细胞3次,以充分除去未进入细胞内的DCFH-DA。取正常标记有DCFH-DA的细胞加入活性氧阳性对照刺激细胞,设浓度梯度为50 mg/mL、25 mg/mL、12.5 mg/mL、6.25 mg/mL、3.125 mg/mL、0 mg/mL。37 ℃细胞培养箱孵育20 min。用荧光酶标仪测定荧光强度,荧光强度直接反映了细胞内的氧自由基水平。
1.5.3粒细胞巨噬细胞集落形成单位(CFU-GM)检测 采用体外单层琼脂半固体培养法检测:制备各组小鼠骨髓单核细胞悬液,培养体系包括50 ng/mL GM-CSF,20%胎牛血清,琼脂终浓度为0.3%,4 mmol/L谷氨酰胺,配制2×105/mL细胞悬液。于37 ℃、5%CO2饱和湿度环境下培养。培养10~14 d观察集落形成情况,以大于40个细胞的细胞团为一个集落。
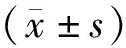
2 结 果
2.1各组小鼠外周血常规比较 与正常组比较,模型组小鼠外周血白细胞计数、红细胞计数、血小板计数和血红蛋白水平均明显降低(P均<0.05);与模型组比较,健脾补肾方小、大剂量组外周血白细胞计数、红细胞计数、血小板计数、血红蛋白水平和鲨肝醇组外周血白细胞计数、红细胞计数、血红蛋白水平均明显升高(P均<0.05),鲨酐醇组血小板回升不显著(P>0.05);健脾补肾方小剂量组各指标改善情况均明显优于健脾补肾方大剂量组和鲨肝醇组(P均<0.05),接近正常水平。见表1。

表1 各组小鼠外周血常规比较
2.2各组小鼠骨髓细胞ROS水平和CFU-GM比较 与正常组比较,模型组小鼠骨髓细胞内ROS水平明显升高(P<0.05),骨髓细胞 CFU-GM 明显减少(P<0.05)。与模型组比较,健脾补肾方小、大剂量组和鲨酐醇组骨髓细胞内ROS水平明显降低(P均<0.05),骨髓细胞 CFU-GM 明显增加(P均<0.05),其中健脾补肾方小剂量组各指标改善情况均明显优于健脾补肾方大剂量组和鲨肝醇组(P均<0.05),接近正常水平。见表2及图1~5。
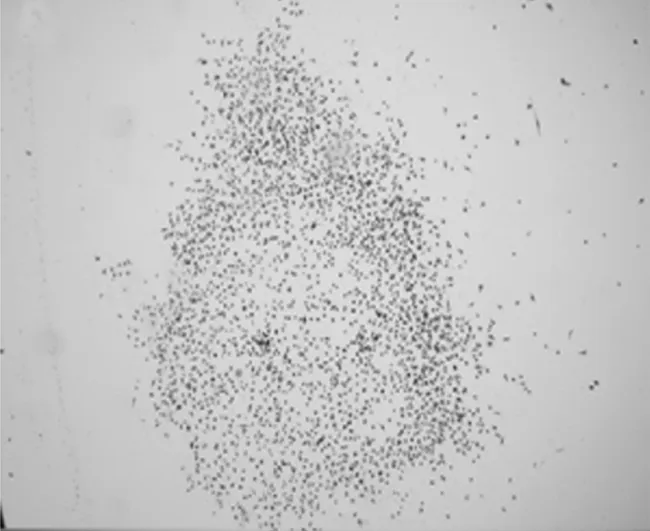
图1 正常组小鼠粒细胞巨噬细胞集落形成情况

表2 各组小鼠骨髓细胞ROS水平和CFU-GM比较
3 讨 论
化学损伤属中医“虚劳”“血虚证”范畴,病变涉及五脏。中医认为“脾为气血生化之源”,“肾主骨,生髓藏精”,“血为精所化”。故肾虚则髓不足,精不足则血衰,说明脾、肾、骨髓和血液之间存在密切的关系,通过健脾补肾可达生血的目的。健脾补肾方重用熟地、甘草为君药,其中熟地可滋阴补血,填精益髓;甘草可补益脾气,益气复脉。黄芪补脾肺之气,以益生血之源;当归补血亦可活血,促进祛瘀生新,共为臣药。陈皮理气健脾,行气导滞,可防止补益药之滋腻,为佐药;泽泻宣泄肾浊,引药归经,为使药。诸药合用可健脾益气、滋阴补肾、养血益髓。现代药理学研究表明,地黄多糖可促进骨髓造血干细胞的增殖与分化,升高外周血象[13-14]。甘草能够增强骨髓细胞增殖分化能力,刺激骨髓造血[15]。当归可显著促进造血干细胞的增殖,并延缓其衰老,促进多种造血祖细胞的增殖、分化;当归多糖还可通过延缓骨髓基质细胞衰老,促进黏附分子、血管生长因子、造血生长因子的分泌从而改善造血微环境来促进造血功能的恢复[16]。黄芪能促进辐射损伤小鼠造血干细胞的增殖和分化,能使损伤的脾脏向正常逆转,并可清除辐射导致的氧化损伤,能够改善因放化疗引发的骨髓抑制状态[17-18]。泽泻能够促进放化疗后组织损伤分解代谢产物的排泄[19]。陈皮可改善脾胃运化功能,促进造血营养物质的吸收,改善免疫功能,有抗肿瘤、抗突变作用[20]。可见健脾补肾方具有促进造血功能恢复的作用。

图2 模型组小鼠粒细胞巨噬细胞集落形成情况

图3 健脾补肾方小剂量组小鼠粒细胞巨噬细胞集落形成情况

图4 健脾补肾方大剂量组小鼠粒细胞巨噬细胞集落形成情况

图5 鲨酐醇组小鼠粒细胞巨噬细胞集落形成情况
外周血白细胞计数、红细胞计数、血小板计数和血红蛋白水平主要反映造血干/祖细胞向成熟细胞分化的能力,CFU-GM 可反映造血干/祖细胞体外增殖能力,ROS升高是照射引起骨髓造血干/祖细胞损伤的重要因素。本研究采用环磷酰胺腹腔注射方法建立化学损伤模型,显示化学损伤后小鼠外周血白细胞计数、红细胞计数、血小板计数和血红蛋白水平明显降低,骨髓细胞内ROS水平明显升高,骨髓细胞CFU-GM明显减少,提示造模成功。与模型组比较,健脾补肾方小、大剂量组外周血白细胞计数、红细胞计数、血小板计数和血红蛋白水平明显恢复,骨髓细胞内ROS水平明显降低,骨髓细胞CFU-GM明显增加。说明健脾补肾方对化学损伤所致的造血系统分化异常有保护作用,可提高造血干/祖细胞的增殖分化能力,其保护作用可能是通过清除ROS,减轻造血系统的氧化损伤而实现的。本实验中,健脾补肾方小剂量组各指标改善情况均优于大剂量组,可能与健脾补肾方中大剂量熟地黄、甘草滋腻之性影响胃肠道吸收有关,这说明健脾补肾方在治疗化学物质所致的造血功能损伤时存在一定的量效关系,而非剂量越大越好的依赖关系,其具体机制有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
