精制保和颗粒治疗溃疡性结肠炎的机制研究
2021-07-08陈晓萍沈阿灵陈友琴
程 瑛 ,陈晓萍 ,沈阿灵 ,李 捷 ,陈友琴 ,彭 军 *
(1. 福建中医药大学中西医结合研究院,福建 福州 350122;2. 福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3. 美国凯斯西储大学医学院,美国 克利夫兰 44106)
溃疡性结肠炎(ulcerative colitis,UC)是一种炎症性肠病(inflammatory bowel disease,IBD),其特点是结肠黏膜的反复损伤和黏膜下层的慢性非特异性炎症反应。 UC 发病率高,且呈逐年上升的趋势,影响着全世界数百万人的健康[1-2]。 UC 发病机制复杂,现有研究表明:肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等炎性因子对UC 的发生、发展具有重要的调控作用[3-8]。 精制保和颗粒(refined baohe granules,RBG)由中医经典处方保和丸精简化裁而来,全方由神曲、红藤、炒麦芽3 味药配伍组成。神曲健脾和胃、消食化积,红藤清热解毒、散结消肿,炒麦芽行气消食、健脾开胃,三者联用共奏健脾和胃、化瘀解毒的功效。 然而RBG 对UC 的治疗作用和机制尚未见报道,因此,本研究通过葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导构建 UC 小鼠模型, 探讨 RBG 对UC 小鼠的治疗作用及其可能的机制,以期为其临床应用的二次开发提供进一步的实验依据。
1 材料与方法
1.1 主要仪器及试剂 DM4000B 倒置显微镜、病理切片机(德国Leika 公司);石蜡包埋机、生物组织自动脱水机(湖北孝感亚光医用电子技术有限公司);伊红染色液、苏木素染色液(北京索莱宝科技有限公司);一抗 IL-6 抗体、TNF-α 抗体(美国 GeneTex公司);免疫组化试剂盒、diaminobenzidine(DAB)显色试剂盒(福州迈新生物技术开发有限公司);DSS(美国 MP Biochemical 公司);RBG(江阴天江药业有限公司,批号:1707310)。
1.2 实验药物配制
1.2.1 RBG 溶液配制 0.3 g RBG 用双蒸水溶解配置成 150 mg/mL RBG 溶液,现配现用。
1.2.2 2% DSS 溶液配制 8 g DSS 粉末用双蒸水溶解配制成 2% DSS 溶液,避光处理,现配现用。
1.3 实验动物 5 周龄 SPF 级雄性 C57BL/6 小鼠24 只,体质量(20±2)g,购自上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2014-0017。 实验期间,小鼠饲养于福建中医药大学实验动物中心 SPF级实验动物室,使用许可证号:SYXK(闽)2009-0001。
1.4 小鼠分组及给药 将24 只体质量、周龄相近的雄性C57BL/6 小鼠在福建中医药大学实验动物中心适应性喂养1 周后,按随机数字表法分成对照组、RBG 组、DSS 组和 DSS+RBG 组,每组 6 只。RBG组自由饮用双蒸水,同时给予0.2 mL RBG(药物浓度为 1.5 g/kg)灌胃,每日 1 次,连续灌胃 11 d;DSS组自由饮用2% DSS 连续7 d 后换回自由饮用双蒸水至11 d,同时给予等体积的双蒸水灌胃11 d,每日1 次;DSS+RBG 组自由饮用 2% DSS 连续 7 d 后换回自由饮用双蒸水至11 d,同时给予0.2 mL RBG灌胃,每日1 次,连续灌胃11 d;对照组自由饮用双蒸水同时灌胃等体积的双蒸水11 d,每日1 次。
1.5 疾病活动指数(DAI)评分检测 每日测量小鼠体质量,同时每2 d 检测小鼠大便性状、便血情况,参照文献[9],计算疾病活动指数(DAI)评分。
DAI 评分=体质量情况评分+大便性状情况评分+便血情况评分
1.6 取材 给药结束后,4 组小鼠经1.5%异氟烷气体麻醉取血;采用脱颈处死,冰上截取小鼠结肠,通过数码相机对结肠组织进行拍照,直尺测量结肠长度,电子天平称取结肠体质量;随后将结肠置于4%多聚甲醛中固定。
1.7 苏木素-伊红(HE)染色观察结肠病理形态
4%多聚甲醛中固定24 h 后的结肠组织经梯度乙醇进行脱水处理,之后二甲苯Ⅰ、Ⅱ进行透明,并依次放于石蜡Ⅰ、Ⅱ、Ⅲ进行浸蜡处理后包埋;将结肠蜡块切成 5 μm 薄片,烤片 2 h 后,放入二甲苯Ⅰ、Ⅱ进行脱蜡和梯度乙醇水化处理;双蒸水冲洗后,进行苏木素-伊红溶液染色,晾干后树脂胶封片处理。 用 Leica DM 4000B 显微镜采集(400×)图像,观察结肠病理形态。
1.8 免疫组化(IHC)染色检测 IL-6 和 TNF-α 水平表达 石蜡切片按“1.7”项下水化处理后,抗原修复2~3 h,按照免疫组化试剂盒说明书,封闭1 h后,在4 ℃条件下过夜孵育一抗 IL-6 和 TNF-α(1∶200 稀释);第2 日石蜡切片给予相应的二抗孵育30 min,接着用稀释液链霉亲和素-POD 工作液孵育1 h;PBS 清洗后进行DAB 染色和苏木素复染,水洗干后封片。 每组标本用Leica DM 4000B 显微镜随机采集5 个高倍镜视野(400×)图像,采用Image-pro plus 7.0 软件进行分析统计。 按Fromowitz综合计分法,计算不同代表图的阳性率平均值。阳性率平均值<5%者为0 分;≥5%,<25%为1 分;≥25%,<50%者为2 分;≥50%,<75%者为3 分;≥75%者为4 分。细胞染色强度的评定以染色深度判定:阴性为0 分,浅黄色但明显强于阴性对照者为1 分,黄色为 2 分,棕黄色为 3 分。 上述两项乘积为免疫组化评分[10]。
1.9 统计学方法 采用SPSS 23.0 软件进行数据统计分析。 计量资料服从正态分布者以()表示,采用单因素方差分析中的LSD-t 法(方差齐)或Games-Howell 法(方差不齐)进行检验。
2 结 果
2.1 4 组小鼠体质量减轻率比较 结果见图 1。 与对照组比较,RBG 组小鼠体质量无显变化,而DSS组小鼠体质量明显减轻;与DSS 组比较,DSS+RBG组小鼠体质量无明显变化。
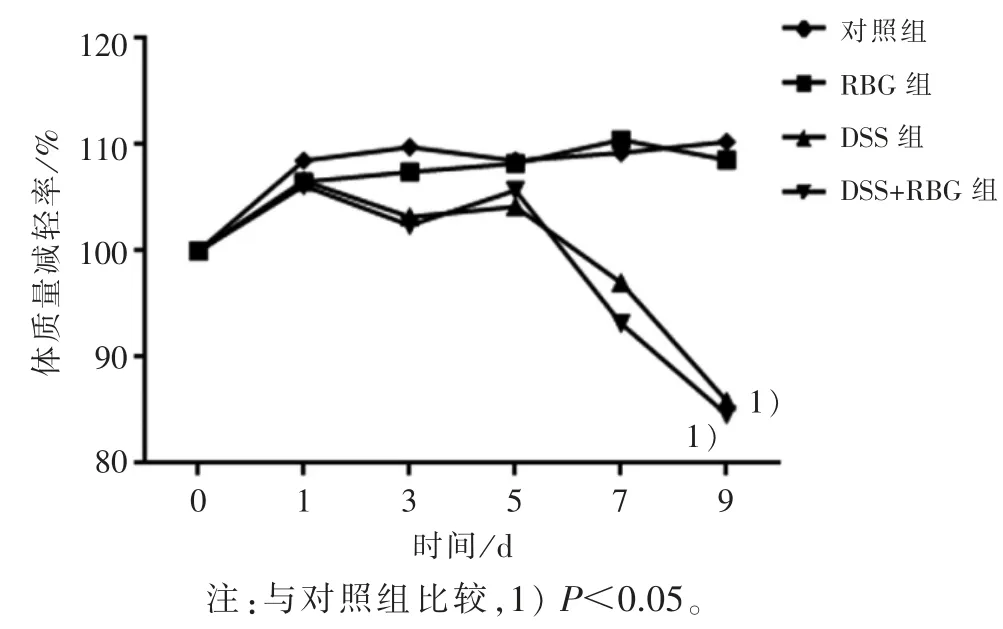
图1 4 组小鼠的体质量减轻率比较
2.2 4 组小鼠 DAI 评分比较 结果见图 2。与对照组比较,RBG 组 DAI 评分无变化,而 DSS 组 DAI 评分明显升高;与 DSS 组比较,DSS+RBG 组 DAI 评分显著降低。
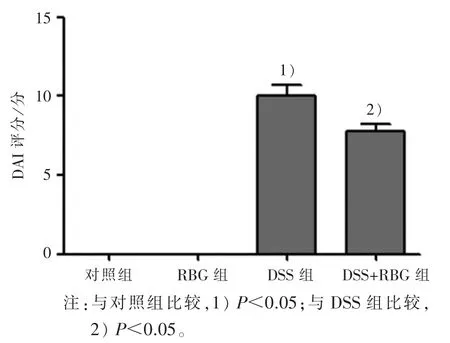
图2 4 组小鼠的DAI 评分比较
2.3 4 组小鼠结肠长度和体质量比较 结果见图3~图5。 与对照组比较,RBG 组小鼠的粪便形状,以及结肠长度和体质量无变化,而DSS 组小鼠粪便不成型,且结肠长度明显缩短,体质量明显减轻;与DSS 组比较,DSS+RBG 组小鼠粪便不成型,结肠长度缩短和体质量减轻情况缓解。

图3 4 组小鼠结肠长度照片图
2.4 4 组小鼠结肠组织形态学比较 结果见图6。与对照组比较,RBG 组小鼠的结肠组织形态学无显著改变,而DSS 组小鼠的结肠黏膜紊乱,隐窝扭曲并有炎性细胞浸润;与DSS 组比较,DSS+RBG 组DSS鼠结肠组织黏膜紊乱改善。
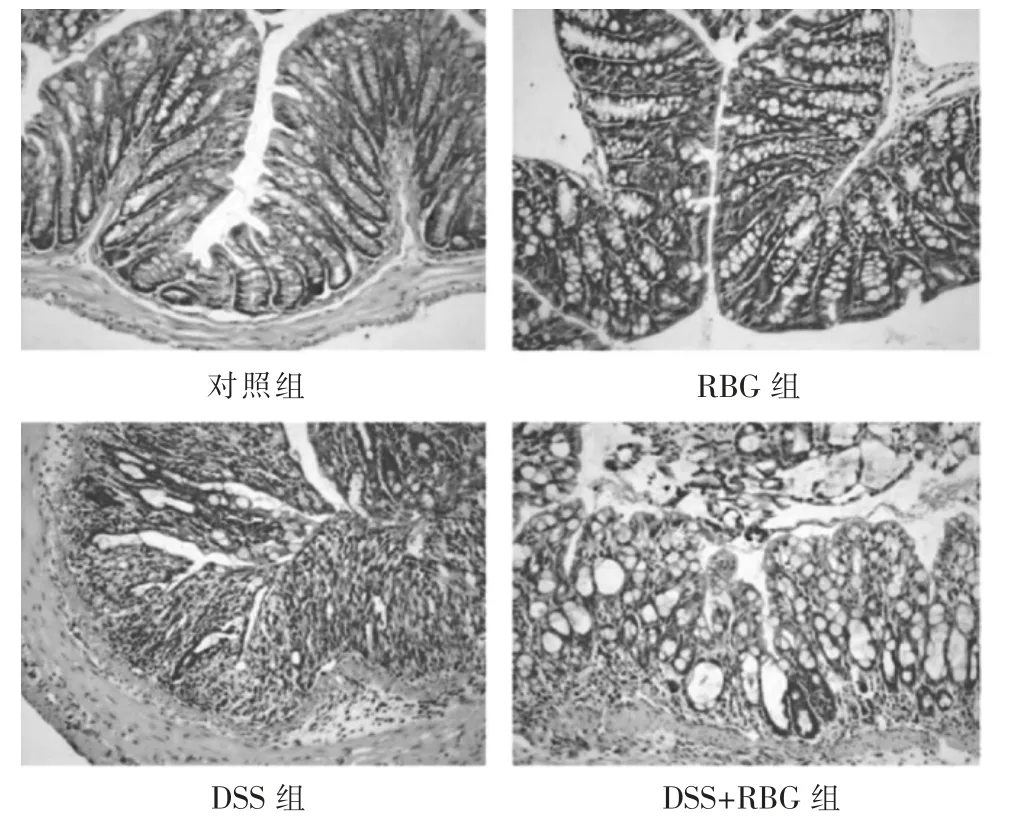
图6 4 组小鼠结肠组织病理形态学光镜图(×200)
2.5 4 组小鼠结肠组织中IL-6 水平比较 结果见图7。 与对照组比较,RBG 组小鼠结肠组织IL-6 水平无显著变化,而DSS 组小鼠结肠组织中IL-6 水平明显上升;与DSS 组比较,DSS+RBG 组小鼠结肠组织IL-6 水平下降。

图7 4 组小鼠结肠组织中IL-6 免疫组化代表图及免疫组化评分比较
2.6 4 组小鼠结肠组织中TNF-α 水平比较 结果见图8。 与对照组比较,RBG 组小鼠结肠组织TNF-α 水平无变化,而DSS 组小鼠结肠组织中TNF-α水平明显上升;与DSS 组比较,DSS+RBG 组小鼠结肠组织TNF-α 水平下降。
3 讨 论
现有的研究已经表明DSS 诱导的小鼠UC 模型可表现出与人类 UC 相似的症状[11]。 DAI 评分、大便性状、结肠长度、体质量以及结肠的组织形态学改变等可直观反映疾病的进展情况,是临床上评价UC 炎症进程的重要指标[12],因此本研究首先探讨了RBG对DSS 诱导的小鼠UC 临床症状的影响。 结果显示:RBG 可显著改善DSS 诱导的UC 小鼠的相关临床症状,包括DAI 评分增加、结肠缩短和结肠体质量减轻;与此同时,RBG 干预可改善结肠隐窝上皮变形、杯状细胞丢失、炎性细胞浸润和炎性反应,进而可缓解结肠黏膜和黏膜下层的组织病理学损伤。 由此可见,RBG 可通过缓解UC 的临床症状来发挥其治疗作用。

图8 4 组小鼠结肠组织中TNF-α 免疫组化代表图及免疫组化评分比较
UC 发病原因复杂多样,至今尚未明确阐明。 但现有的研究表明与多种促炎细胞因子相关[13-14],其中TNF-α、IL-6 等炎性因子对UC 的发生发展具有重要的调控作用[6]。 在 UC 进程中,中性粒细胞、巨噬细胞和T 淋巴细胞等免疫细胞的活化增加,会导致促炎细胞因子(IL-6、TNF-α 等)的产生增加,从而进一步损害结肠黏膜,是UC 发生发展的重要因素[15-18]。 所以,我们进一步探讨了 RBG 对结肠组织中促炎症细胞因子表达的影响,研究结果显示:RBG干预可显著抑制DSS 诱导引起的促炎因子IL-6 和TNF-α 水平。 综上所述,RBG 通过抑制炎症因子IL-6 和TNF-α 在UC 结肠组织中的表达,这可能是其发挥治疗UC 的作用机制之一。
