地西他滨联合CAG方案治疗骨髓增生异常综合征的效果
2021-07-07颜丽华
颜丽华
(郑州颐和医院 血液内科,河南 郑州 450000)
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是临床常见的恶性血液疾病,可对患者造血功能造成极大危害,严重威胁患者健康。MDS多发于中老年人群,且由于中老年人的身体素质较差,一部分老年患者对化疗无法耐受,总体疾病预后效果不佳[1-2]。地西他滨为临床治疗肿瘤的常用药物,进入机体后,可有效抑制恶性细胞DNA的甲基化,从而阻断恶性细胞的增殖与分化,达到治疗疾病的目的,是美国FDA批准的治疗MDS的标准化方法,但单药疗效并不乐观[3]。阿克拉霉素联合阿糖胞苷联合粒细胞集落刺激因子(Acla+Ara-C+G-CSF,CAG)治疗方案也被逐渐应用于MDS的治疗中,通过3种药物联合应用,可有效遏制恶性细胞生长,改善患者各项临床体征,但目前对该方案联合地西他滨相关报道较少。本研究选取2015年12月至2019年12月郑州颐和医院血液内科收治的60例MDS患者作为研究对象,探讨地西他滨联合CAG方案对MDS患者治疗效果的影响。
1 资料与方法
1.1 一般资料选取2015年12月至2019年12月郑州颐和医院血液内科收治的60例MDS患者作为研究对象,依据随机数表法分为观察组与对照组,各30例。对照组男17例,女13例;年龄42~65岁,平均(53.86±1.37)岁;体质量指数16~27 kg·m-2,平均(21.35±0.29)kg·m-2;病程6~15个月,平均(10.22±1.08)个月。观察组男16例,女14例;年龄41~65岁,平均(53.84±1.36)岁;体质量指数16~28 kg·m-2,平均(21.33±0.28)kg·m-2;病程6~16个月,平均(10.23±1.09)个月。两组性别、年龄、体质量指数、病程比较,差异无统计学意义(P>0.05),具有可比性。本研究经郑州颐和医院医学伦理委员会审批通过。
1.2 选取标准(1)纳入标准:①符合《骨髓增生异常综合征中国诊断与治疗指南》[4]中MDS诊断标准,并经临床体征、骨髓细胞分析等检查确诊为MDS-难治性贫血伴原始细胞增多;②血细胞减少持续时间≥6个月,或双系形态异常或出现特异性核型时,血细胞减少持续时间≥2个月;③患者和(或)家属签署知情同意书且配合研究。(2)排除标准:①毒副反应强烈,中途放弃治疗;②合并其他恶性肿瘤;③凝血功能异常。
1.3 治疗方法
1.3.1对照组 接受单药地西他滨(Janssen-Cilag International NV,批准文号H20181217,规格:50 mg)静脉注射治疗,以20 mg·m-2的速率滴注,滴注时间每次>1 h,每日1次,连续治疗4周。
1.3.2观察组 接受地西他滨联合CAG方案,即地西他滨以15 mg·m-2的速率滴注,滴注时间每次>1 h,每日1次,连续滴注5 d,第1~5天;皮下注射阿克拉霉素(扬州奥赛康药业有限公司,国药准字H20060196),每次10 mg,每日1次,连续用药4 d,第3~6天;皮下注射阿糖胞苷(瀚晖制药有限公司,国药准字H20054695),以10~15 mg·m-2的速率注射,每隔12 h注射1次,连续滴注7 d,第4~10天;皮下注射粒细胞集落刺激因子(齐鲁制药有限公司,国药准字S19990050)每次300 μg,每日1次,在白细胞计数(white blood cell count,WBC)>5×109L-1时停止用药。
1.4 评价指标(1)血常规。分别采取两组患者治疗前、治疗4周的外周静脉血,使用Mc-600型全自动血常规分析仪检测血红蛋白(hemoglobin,Hb)、血小板计数(platelet count/blood platelet count,PLT)及中性粒细胞计数(polymorphonuclear neutrophils,PMN)。(2)生存质量。采用生存质量测定量表简表(the quality of life-BREF,QOL-BREF)[5]评估两组患者治疗前、治疗4周的生存质量,该量表共28个条目,采用1~5级评分法,总得分为5~140分,分值越高,提示生存质量越优。(3)毒副反应。记录两组治疗期间静脉炎、胃肠反应等毒副反应发生率。
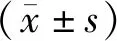
2 结果
2.1 血常规治疗前,两组血常规比较,差异无统计学意义(P>0.05);治疗4周后,两组Hb水平、PLT及PMN均升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组血常规比较
2.2 生存质量治疗前,两组QOL-BREF评分比较,差异无统计学意义(P>0.05);治疗4周后,两组QOL-BREF评分均升高,且观察组均高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组QOL-BREF评分比较分)
2.3 毒副反应发生率观察组静脉炎5例,静脉炎发生率为16.67%(5/30);对照组静脉炎4例,静脉炎发生率为13.33%(4/30);两组静脉炎发生率比较,差异无统计学意义(χ2=0.000,P=0.718)。观察组胃肠反应6例,胃肠反应发生率为20.00%(6/30);对照组肠胃反应5例,胃肠反应发生率为16.67%(5/30);两组胃肠反应发生率比较,差异无统计学意义(χ2=0.111,P=0.739)。
3 讨论
MDS发病原因多是细胞免疫功能、造血调节因子、细胞凋亡和分化、造血细胞基因表达、骨髓微环境和甲基化等出现异常,但其具体发病机制尚未证实。临床从病理检查、发病机制、免疫学变化、外周血液学等方面进行研究,尚未发现特异性治疗方法[6]。相关资料显示,DNA高甲基化在MDS的产生与发展中起着非常重要的作用,而地西他滨为临床治疗MDS的常用药物,通过对DNA甲基转移酶产生抑制作用,从而使细胞增殖受到抑制,最终逆转DNA甲基化进程[7]。CAG方案在治疗MDS具有疗效显著、不良反应小等优点[8]。
本研究结果显示,治疗4周后,观察组Hb水平、PLT及PMN较对照组高,表明应用地西他滨联合CAG方案治疗MDS患者,可改善血常规指标,控制疾病发展进程,分析CAG的主要作用机制是嵌入DNA,抑制细胞增殖与RNA合成,甚至可与DNA结合引起细胞凋亡。同时,有研究认为,地西他滨与CAG方案联合应用具有协同作用,因此,药物联合应用更为有效[9-10]。
有文献认为,DNA甲基化也是MDS产生与发展的原因之一,它可促使该病向急性髓细胞性白血病转化,导致预后不良[11]。疾病和化疗都是影响生活质量的负面因素,对生活质量的评价对MDS患者更具有积极意义[12]。本研究结果显示,治疗4周后,与对照组QOL-BREF评分比较,观察组较高,表明两种方式联合应用可发挥协同作用,进一步遏制恶性细胞的生长,从而改善患者生存质量。本研究中还显示两组治疗期间毒副反应发生率比较差异无统计学意义,表明两种方式联合应用不会增加毒副反应,安全性较高。
综上所述,地西他滨联合CAG方案治疗MDS患者的效果显著,可改善血常规指标,提升患者生存质量,且并未增加毒副反应,具有较高的安全性,值得临床推广应用。
