脑卒中后抑郁患者大便标本检测中的微生物种群变化分布分析
2021-07-07李延红周启宇李盼盼孙士宾靳智凯席子明
李延红,周启宇,李盼盼,孙士宾,靳智凯,席子明
(1.河南大学第一附属医院 全科医学科,河南 开封 475001;2.川北医学院 临床医学,四川 南充 637199)
我国现阶段已成为了全球范围内脑卒中发病风险最高的国家。卒中后抑郁是脑卒中后发生率较高的一种神经精神并发症[1]。卒中后抑郁不但会让患者的功能康复时间明显延长,对其生活质量造成严重影响,而且还会让致残率和临床病死率明显增加,对社会、家庭造成负面引导和沉重负担等[2]。肠道正常菌群在自然状况下与机体内外环境维持着相对平衡状态,对于保证机体健康非常重要。然而在某些情况下,如果破坏了这种平衡状态,会导致菌群失调,引起疾病发生或者导致病情加重,进而加重菌群失调,形成恶性循环,甚至可能引起其他疾病[3]。临床研究结果显示,肠道菌群能对机体的睡眠、疼痛、认知以及情绪等进行有效调节,同时与孤独症、焦虑抑郁、帕金森、阿尔茨海默症等多种疾病的发生、发展密切相关,同时也是导致多种神经系统疾病的主要调节者[4]。肠道菌群能准确反映身体内环境变化,能为探索疾病进展、不同疾病的治疗反应和个体差异提供指导帮助。本研究主要分析了脑卒中后抑郁患者大便标本检测中的微生物种群变化分布情况,希望能为脑卒中后抑郁的防治提供指导。
1 资料与方法
1.1 一般资料选取河南大学第一附属医院2018年11月至2020年11月收治的76例脑卒中后抑郁症患者,将其设为观察组。纳入标准:(1)满足脑卒中和抑郁症的相关诊断标准[5];(2)首次发生脑卒中;(3)患者或者其家属签署知情同意书。排除标准:(1)不能配合研究;(2)伴其他严重疾病;(3)精神疾病。76例患者中男41例,女35例;年龄38~67岁,平均(52.28±2.35)岁;脑缺血40例,脑出血26例,混合型10例。选取同期在医院接受健康体检的76例健康体检者,将其设为对照组,其中男39例,女37例,年龄36~65岁,平均(51.84±2.61)岁。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 研究方法
1.2.1采集标本 于清晨采集研究对象第1次粪便中段标本,大约为10 g,精确称取粪便样本100 mg,放置于2 mL无菌离心管内,共3份,其中1份备用,另外2份用于基因组DNA提取效率比较试验与测序。全部粪便标本应在采集后1 min内完成处理,保存在-80 ℃的冰箱内以备用。
1.2.2抽提粪便细菌基因组DNA 及时抽提样品中全部细菌基因组,保存在-20 ℃的冰箱内以备用。具体步骤为:(1)在装有粪便的EP管内加入Buffer ASL 1.4 mL,1 min的涡旋震荡;100 ℃温育4 min、87.5 ℃温育3 min、65 ℃温育3 min,15 s涡旋震荡;(2)1 min离心处理,离心速率为14 000 r·min-1;选择上清液1.2 mL,将沉淀去除;(3)加入InhibitEX 1片,涡旋震荡,彻底溶解,于室温下静置1 min;(4)3 min离心处理,离心速率为14 000 r·min-1;(5)上清液转移到新的2 mL EP管内,3 min离心处理,离心速率为14 000 r·min-1;(6)在新的2 mL EB管内加入蛋白酶K 15 μL;(7)将步骤5离心处理后得到的上清液转移到装有蛋白酶K的2 mL EP管内;(8)加入Buffer AL 200 μL,15 s涡旋震荡,70 ℃温育10 min;(9)加入100%酒精200 μL,通过涡旋震荡将其混匀;(10)在2 mL EP管内将QIAmp Spin Column安置好,并将以上液体转移到QIAmp Spin Column内;(11)1 min离心处理,离心速率为14 000 r·min-1,在新的2 mL EP管内将QIAmp Spin Column安置好,将具有过滤液的2 mL EP管丢弃;(12)加入Buffer AW1 500 μL,进行1 min离心处理,离心速率为14 000 r·min-1。将QIAmp Spin Column转移到新的2 mL EP管内;(13)加入Buffer AW2 500 μL,进行3 min离心处理,离心速率为14 000 r·min-1。将QIAmp Spin Column再次转移到新的1.5 mL EP管内,加入Buffer AE 70 μL,室温下静置1 min,1 min离心处理,离心速率为14 000 r·min-1,将QIAmp Spin Column丢弃,对1.5 mL EP管内的洗脱液进行收集,也就是粪便基因组DNA。
1.2.3PCR扩增 靶标设定为16S rRNA基因V3可变区,按照Muyzerdeng方法对16S rRNA基因V3可变区进行扩增。选择两步法进行PCR扩增:选择Touchdown PCR,在95 ℃温度下进行3 min的预变性,在95 ℃的温度下进行1 min的变性,在65 ℃的温度下进行1 min的退火,每2个循环下降1 ℃,于72 ℃温度下进行1 min延伸,共进行20个循环;在95 ℃温度下进行1 min的变性,在55 ℃的温度下进行1 min的退火,在72 ℃的温度下进行1 min的延伸,共进行5个循环,最后于16 ℃温度下维持10 min。
1.2.4454焦磷酸测序 选择Barcoded454测序方法对肠道菌群结构组成情况进行分析。在上下游引物的5’端加入8个碱基的唯一Barcode,开展454高通量定向平行多样本检测,在454焦磷酸测序后,用以识别不同样本。
1.2.5分析生物信息学 在454测序后,获取原始序列数据,筛选出符合要求、高质量的有效序列,对含总序列中的单个样本来源的序列数进行区分,对样本间差异进行区分。
1.2.6统计分析、聚类、比对细菌分类学 选择高质量16S序列数据库,通过WNDBLAST方法对16S rDNA基因片段种类进行鉴定,对全部细菌的分类学进行统计,并开展主成分分析。
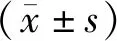
2 结果
2.1 微生物群落结构及其相对丰度在门水平方面的比较在门水平方面,两组样品的微生物群落结构及其相对丰度比较,差异有统计学意义(P<0.05)。见表1。

表1 两组微生物群落结构及其相对丰度在门水平方面的比较
2.2 微生物群落结构及其相对丰度在科水平方面的比较除拟杆菌科外,两组样品的微生物群落结构及其相对丰度在科水平方面比较,差异有统计学意义(P<0.05)。见表2、3。

表2 微生物群落结构及其相对丰度在科水平方面的比较

表3 微生物群落结构及其相对丰度在科水平方面的比较
2.3 微生物群落结构及其相对丰度在属水平方面的比较在属水平方面,两组样品的微生物群落结构及其相对丰度比较,差异有统计学意义(P<0.05)。见表4、5。

表4 微生物群落结构及其相对丰度在属水平方面的比较

表5 微生物群落结构及其相对丰度在属水平方面的比较
3 讨论
脑卒中后抑郁是临床中发生率较高的一种神经心理障碍,特征主要表现为卒中后兴趣减退,持续情感低落等[6]。现阶段有关脑卒中后抑郁的具体发病机制还并不清楚,大部分临床研究结果显示,脑卒中后抑郁是社会、心理、生物等多种因素共同作用的结果[7]。肠道菌群是肠脑轴的核心,是联系胃肠道和大脑相互调节的主要桥梁,肠道菌群会在一定程度上影响大脑功能[8]。最近几年,人们开始更加关注神经精神疾病伴发的肠道菌群变化,现阶段有临床研究结果显示,肠道微生态与脑卒中之间的关系非常密切,肠道菌群不但参与了脑卒中后抑郁的发展,而且还会对脑卒中后抑郁的治疗造成干预[9]。肠道菌群主要是通过以下途径对动脉粥样硬化的发生产生影响,进而引起脑卒中[10-11]:(1)细菌感染导致免疫系统被激活,巨噬细胞表达的Toll样受体增加促炎细胞因子和趋化因子,导致粥样斑块进展速度加快,而且会形成易损斑块;(2)肠道菌群代谢胆固醇和脂肪对动脉粥样硬化斑块的形成造成影响;(3)肠道菌群代谢产物氧化三甲胺导致血小板活性被激活,进而促进形成粥样斑块。临床研究结果显示,脑卒中患者肠道菌群含有的机会致病菌更多,如脱硫弧菌属、巨型球菌属、肠杆菌属等,而柔嫩梭菌属、普氏菌属、拟杆菌属等有益菌的含量显著降低。
肠-脑之间表现为双向交流,任意一边发生功能失调均可能导致病理生理学后果,胃肠道不适可能合并情绪反应,情绪反应会导致相关部位神经活动被激活,并通过脑肠轴将调控信息传输到胃肠道,导致胃肠道功能和动力发生改变,肠黏膜免疫被激活,对肠道黏膜屏障功能造成影响[12]。抑郁症患者常常伴胃肠道不适,出现腹泻、便秘、呕吐、恶心等胃肠道症状,表明在抑郁症发生、发展的过程中,肠道菌群紊乱具有一定作用。有临床研究结果显示,在门水平方面,抑郁症患者肠道菌群中的放线菌门、变形菌门、拟杆菌门的占比显著上升,厚壁菌门细菌占比明显下降,肠道乳杆菌属减少[13-14]。在抑郁发生、发展的过程中,有肠球菌等肠道需氧菌异常增加的参与,采用益生菌干预治疗明显改善了肠道菌群失调,显著减轻了抑郁症状[15]。本研究中,在门水平以及属水平方面,两组样品的微生物群落结构及其相对丰度比较,差异有统计学意义;除拟杆菌科外,两组样品的微生物群落结构及其相对丰度在科水平方面比较,差异有统计学意义。本研究结果与上述研究报道结果类似,研究结果表明,脑卒中后抑郁患者的肠道微生态环境存在明显不同的细菌群落多样性和均衡性。
总之,脑卒中后抑郁患者大便标本的微生物种群分布存在较大的变化。但是本次研究所选样本量较少,样本来源有限,仅为初步研究,在今后的工作中应对患者症状与粪便标本微生物种群变化的相关性进行深入探讨,以便为脑卒中后抑郁的防治提供新的防治途径。
