374例根治术后肠型胃癌患者预后的影响因素分析*
2021-07-06田春方井海燕王潍博王彩霞崔言刚陈健鹏沙丹
田春方 井海燕 王潍博 王彩霞 崔言刚 陈健鹏 沙丹
根据2018年统计数据显示,胃癌位居中国最常见的恶性肿瘤第3位,最常见肿瘤相关死亡原因的第2位[1]。Lauren分型根据组织学特征将胃腺癌分为肠型、弥漫型、混合型和不确定型。肠型胃癌好发于胃窦,与肠上皮化生有关,腺体样结构为其典型特征;弥漫型胃癌好发于胃部,由弥散的肿瘤细胞构成,腺样结构少见;混合型胃癌同时含有肠型和弥漫型的特征。研究表明[2],肠型胃癌5年生存率优于弥漫型和混合型,但仍有超过40%的肠型胃癌患者于术后5年内出现肿瘤复发转移或死亡。目前,探讨肠型胃癌预后影响因素的系统性分析较少。本研究回顾性分析接受根治性切除术后肠型胃癌患者的临床病例及随访资料,探讨影响患者预后的因素。
1 材料与方法
1.1 病例资料
回顾性分析2010年7月至2015年7月山东第一医科大学附属省立医院收治的行胃癌切除术患者的临床病例资料。纳入标准:1)行胃癌根治术并清扫淋巴结≥16枚;2)术后病理证实为原发性肠型胃腺癌;3)切缘阴性,达到R0切除。排除标准:1)姑息性手术;2)肉眼或镜下切缘阳性;3)术前曾接受新辅助放化疗;4)临床病理资料信息不全;5)围手术期死亡及非胃癌相关死亡。
1.2 方法
1.2.1 临床病理资料收集 从电子病历系统中收集患者手术时的病例资料,包括:性别、年龄、胃癌家族史(一级或二级亲属存在原发性胃癌)、身高、体质量、手术日期、幽门螺杆菌(Helicobacter Pylori, HP)感染情况、肿瘤部位及大小、大体及组织学分型(图1A,B)及分级、脉管癌栓(图1C)、神经侵犯(图1D)、人表皮生长因子受体-2(human epidermal growth factor receptor-2, HER-2)表达水平、浸润深度、淋巴结侵犯、术前血红蛋白、空腹血糖、中性粒细胞、血小板和淋巴细胞水平等。根据美国癌症协作组/国际抗癌联盟(AJCC/UICC)第8版胃癌TNM分期标准进行肿瘤分期。
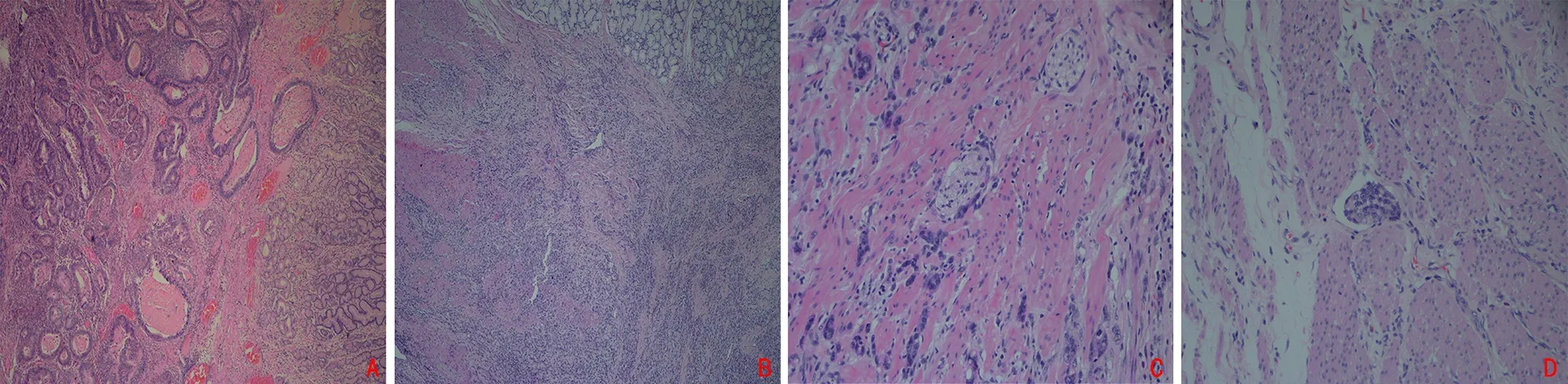
图1 典型胃癌组织病理
1.2.2 随访 通过门诊和电子病历系统及电话随访。术后2年内每3个月1次,其后每6个月1次至术后5年,之后每年1次,截止时间为2020年7月。
1.3 统计学分析
采用SPSS 23.0软件进行统计学分析。无病生存期(disease free survival, DFS)为手术日至确认肿瘤复发或末次随访中无复发的时间,总生存期(overall survival, OS)为手术日至胃癌相关死亡或末次随访时的生存时间。ROC曲线确定中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)的截断值为2.04、血小板-淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)的截断值为92.45,据此将NLR和PLR分为高低两组。应用Kaplan-Meier法计算各组DFS率和OS率,采用Log-rank检验比较各因素对DFS和OS的影响,Cox风险比例回归模型进行多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 根治术后肠型胃癌患者的临床病理特征
2010年7月至2015年7月在山东第一医科大学附属省立医院行胃癌手术的患者1 978例,其中肠型550例、弥漫型880例、混合型478例、不确定型70例。符合入组标准的患者415例,失访41例(9.9%),中位随访时间为65(3~123)个月。本研究共纳入具有完整临床病理和随访资料的患者374例,截至2020年7月复发转移101例(27.0%),死亡86例(23.0%),中位生存时间未到达。早期胃癌147例(39.3%);局部晚期胃癌227例(60.7%),其中Borrmann Ⅰ型18例(7.9%)、Ⅱ型47例(20.7%)、Ⅲ型139例(61.2%)、Ⅳ型23例(10.1%)。
根据病变部位统计,近端胃癌71例(18.98%)、中段胃癌56例(14.97%)、远端胃癌234例(62.57%)、全胃癌13例(3.48%)。根据手术方式统计,近端胃切除61例(16.3%)、远端胃切除255例(68.2%)、全胃切除58例(15.5%)。检出淋巴结数目共10 030枚[均数为(26.8±7.5)枚],转移淋巴结数目774枚[均数(2.07±3.70)枚]。纳入的374例患者,147例早期(T1NXM0)胃癌患者中有27例(18.4%)曾接受术后辅助化疗,227例局部晚期(T2~4NXM0)胃癌患者中有136例(59.9%)曾接受术后辅助化疗,共有163例(43.6%)患者接受术后辅助化疗。
入组患者的临床病理特征见表1,男女比为3.45∶1;中位发病年龄61(30~88)岁,≥60岁195例(52.14%);HP感染240例(64.17%);组织学中分化317例(84.76%);T3~4期164例(43.85%);伴淋巴结转移者150例(40.11%);Ⅰ期174例(46.52%)、Ⅱ期88例(23.53%)、Ⅲ期112例(29.95%);伴脉管癌栓者67例(17.91%)、伴神经侵犯者60例(16.04%);肿瘤直径>3 cm者184例(49.20%)。

表1 374例根治术后肠型胃癌患者的临床病理特征
2.2 根治术后肠型胃癌患者预后的单因素分析
单因素生存分析显示,入组患者的5年DFS率和OS率分别为73.4%和79.7%(图2)。TNM分期Ⅰ、Ⅱ和Ⅲ期患者的5年DFS率分别为92.7%、73.0%和44.2%,5年OS率分别为95.0%、79.7%和52.5%。女性患者DFS不佳。年龄>60岁、组织学中分化、肿瘤直径>3 cm、T3~4期、淋巴结浸润、TNM分期晚、非远端胃癌、脉管癌栓、神经侵犯、HER-2过表达、高PLR与DFS和OS不佳显著相关(均P<0.05,表2)。
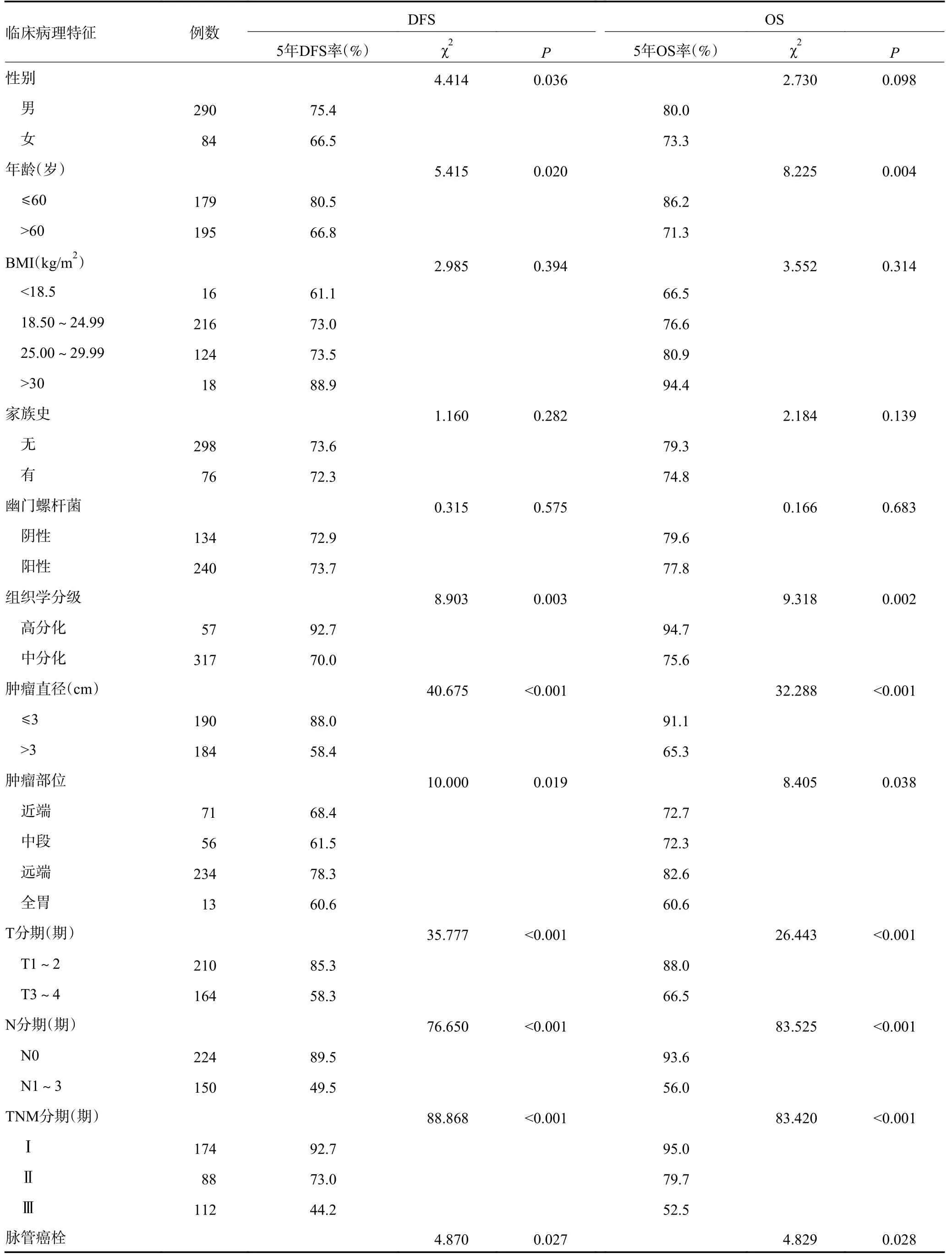
表2 374例根治术后肠型胃癌患者的单因素分析
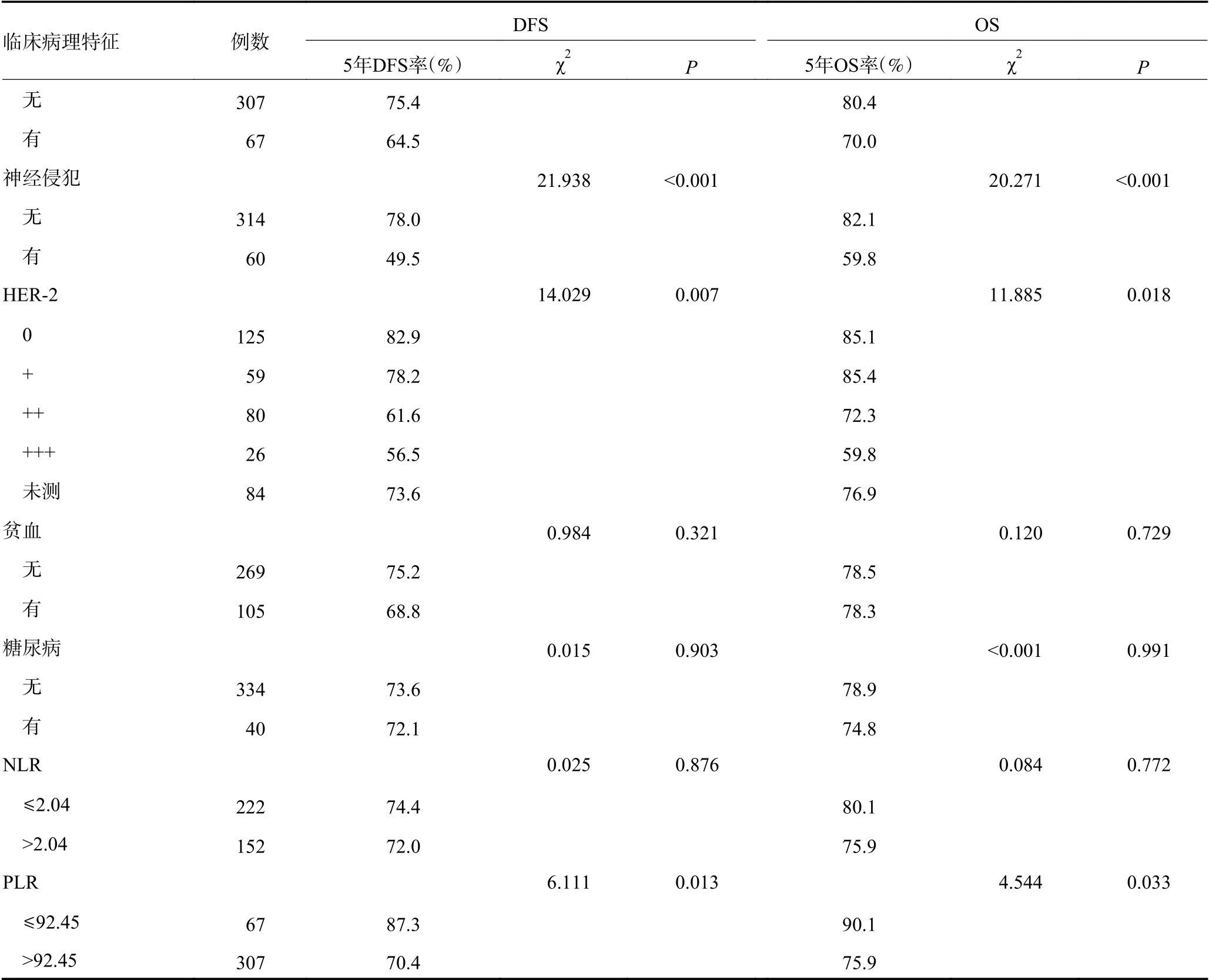
表2 374例根治术后肠型胃癌患者的单因素分析 (续表2)

图2 根治术后肠型胃癌患者的生存曲线
2.3 根治术后肠型胃癌患者预后的多因素分析
单因素分析中,P<0.1的影响因素纳入多因素分析。多因素分析显示年龄、神经侵犯和TNM分期是DFS和OS的独立危险因素(均P<0.05,表3)。而性别、组织学分级、肿瘤部位、肿瘤大小、脉管癌栓、HER-2水平和PLR等并非根治术后肠型胃癌患者预后的独立预测因素。

表3 根治术后肠型胃癌患者Cox比例风险回归模型多因素分析
3 讨论
有研究显示[2-3],肠型胃癌根治术后5年DFS率为46%~55.8%,5年OS率为47.3%~77.8%。本研究5年DFS率和5年OS率分别为73.4%和79.7%,高于既往文献。分析原因可能为本研究纳入的是2010年至2015年肠型胃癌患者,均在本院接受标准的D2根治术,术后病理分期为Ⅰ~Ⅲ期,Ⅳ期患者未纳入分析,Ⅰ期患者占比较高(46.52%)。同时本研究是单中心回顾性研究,无法避免数据的选择性偏倚。有研究表明[4],即使行D2胃癌切除术联合术后辅助化疗,Ⅲ期胃癌仍预后较差。这与Ⅲ期患者T、N分期较晚独立相关。浸润深度(T分期)和转移淋巴结数目(N分期)是胃癌最重要的2项预后因素。本研究中Ⅱ期患者5年OS率为79.7%,Ⅲ期患者5年OS率为52.5%。进一步分析显示Ⅱ期患者中T3~4期占65.9%、N3期占4.5%,Ⅲ期中T3~4期占94.6%、N3期占35.7%。Ⅲ期中T3~4和N3患者比例显著高于Ⅱ期,5年OS率显著低于Ⅱ期,差异均具有统计学意义(均P<0.001),与上述研究一致。
本研究显示 , 肠型胃癌在年龄>60岁人群中更为常见,与中国胃癌整体发病趋势一致[5],可能与人均寿命延长、人口老龄化增加有关。年龄是与根治术后肠型胃癌患者OS和DFS呈负相关的独立预测因素,与既往研究相一致[6]。本研究中男女比例为3.45∶1,与既往报道相似(3~5∶1)[2,7],略高于中国胃癌总体男女比例(2~3∶1)[5]。女性胃癌发病率低,可能与雌激素的保护作用有关;男性发病率高,可能与吸烟、饮酒等不良饮食及生活习惯有关[8]。
已知胃癌,尤其是肠型胃癌的发生与HP慢性感染密切相关。本研究显示64.17% 患者HP阳性,与肠型胃癌患者的OS和DFS无关,与既往研究相一致[9]。根据日本胃癌协会胃癌分类法(2010版),通过连接胃小弯和胃大弯的对应的三等分点,将胃癌分为近端、中段和远端胃癌,累及2个及以上部位即为全胃癌。本研究显示,肠型胃癌更多见于远端胃,远端胃癌的OS和DFS较近端和中段胃癌更好,与既往研究相一致[2,7,10]。近端胃癌与远端胃癌预后不同的机制和原因尚不明确,可能与肿瘤生物学行为和解剖部位有关[10]。本研究中T3~4期肿瘤在近端胃癌占比60.6%,约为远端胃癌(33.3%)的2倍,也部分解释了近端胃癌预后不佳的原因。
本研究脉管癌栓是单因素生存分析的危险因素,神经侵犯则是独立危险因素,与既往研究相一致[2,11-12],提示伴有脉管癌栓和神经侵犯的胃癌患者复发转移风险高,需引起临床医生的高度重视。与单纯化疗相比,术后辅助放化疗可明显提高根治性切除术后伴有淋巴结转移、脉管癌栓和神经侵犯胃癌患者的5年OS率[13]和5年DFS率[14]。对上述患者,应采取包括手术治疗在内的综合治疗手段以提高患者生存。
高BMI指数提示患者具有较高的营养储备,可更好的对抗肿瘤和手术引起的机体损伤[15]。本研究生存分析提示BMI低于18.5 kg/m2的患者DFS和OS不佳,而高于30 kg/m2的患者DFS和OS较好,但各组之间差异均无统计学意义,提示术前BMI与患者的预后无关,与上述研究一致。贫血可致组织缺氧,诱导化疗耐药[16]。术前血红蛋白水平与胃癌患者预后的关系存在争议。本研究提示术前贫血与肠型胃癌根治术后的DFS和OS无显著相关性,与Wu等[17]的研究一致。而Liu等[16]的研究表明,术前贫血是根治术后Ⅲ期胃癌患者预后差的独立危险因素,而与Ⅰ~Ⅱ期的预后无关。胃癌贫血与预后之间的关系有待于进一步阐明。
外周血中性粒细胞、淋巴细胞和血小板在肿瘤诱导的全身炎症反应中发挥重要作用,NLR和PLR可综合反映患者的肿瘤相关炎症和免疫反应状态,预测患者预后[18]。本研究生存分析显示,高PLR与患者5年OS和DFS不佳有关,是单因素生存分析的危险因素,而非独立危险因素;NLR与患者DFS和OS无关,均与既往研究相一致[19]。
肠型胃癌预后的异质性可能与潜在的分子机制差异相关。2014年癌症基因图谱研究协会按分子分型将胃癌分为Epstein–Barr病毒(EBV)阳性型、微卫星不稳定(microsatellite instability, MSI)型、基因组稳定型和染色体不稳定型(chromosomal instability, CIN)胃癌[20]。肠型胃癌常伴有CIN、MSI-H和HER-2基因过表达[20],MSI-H的肠型胃癌患者5年OS率优于弥漫型[21];UBE2C基因过表达可导致CIN,促进肿瘤细胞增殖,与肠型胃癌患者OS不佳相关[22];HER-2过表达与肠型胃癌不良预后显著相关。不同的分子亚型可指导靶向治疗,PD-1抑制剂帕博利珠单抗已被批准用于MSI-H的难治性或转移性实体瘤,曲妥珠单抗用于HER-2阳性的晚期胃癌。探讨肠型胃癌发生的分子机制可更好地预测患者预后,有助于研发相应的分子靶向药物。
本研究仍存在一定的局限性:1)本研究为单中心回顾性研究,不可避免选择偏倚和混杂偏倚;2)本研究纳入病例的时间跨度较长,MSI检测并未列入常规,故本研究未纳入MSI相关信息;3)中国胃癌规范化诊疗指南(2013年版)不推荐Ⅰ期胃癌患者术后行辅助放化疗[23],本研究中Ⅰ期患者占46.52%,部分Ⅱ~Ⅲ期患者未行规律化放疗或方案不清,故未纳入患者术后辅助放化疗信息,可能影响生存分析结果;4)本研究未纳入Ⅳ期患者,因此不能用于评估Ⅳ期肠型胃癌患者的预后。
综上所述,年龄、肿瘤部位及大小、脉管癌栓、神经侵犯、HER-2过表达、T分期、N分期、TNM分期以及高PLR是肠型胃癌根治术后患者复发转移及预后不良的危险因素。年龄、神经侵犯和TNM分期是DFS和OS的独立预测因素。伴有上述危险因素的患者,需引起临床医生的高度重视,应给予积极的综合治疗,缩短复查及随访时间,进而改善肠型胃癌患者的预后。
