博纳吐单抗治疗急性淋巴细胞白血病的研究进展
2021-07-06邬芝雅谷帅凡学婷综述冯继锋审校
邬芝雅 谷帅 凡学婷 综述 冯继锋 审校
急性淋巴细胞白血病(acute lymphoblastic leuk emia,ALL)是发生在骨髓造血系统的恶性肿瘤,最常发生于儿童,成人发病率相对较低。近年来,新诊断的ALL完全缓解率达85%~90%,长期生存率在30%~50%之间[1-2]。而复发难治性ALL预后仍然不佳,5年生存率约为10%,总生存期(overall survival,OS)为2~6个月,其中单药治疗的完全缓解率仅在5%~12%[3-4]。不同人群中ALL的预后差距大,儿童预后良好,而复发难治性ALL预后不良,新的药物急待探寻。多项临床试验结果显示blinatumomab(也称为AMG103,MT103,MEDI-538)在复发难治性急性B淋巴细胞白血病(B cell acute lymphoblastic leukemia,B-ALL)中有较好的疗效,且耐受性良好,目前已被美国食品药品监督管理局(FDA)批准用于复发难治性和微小残留病(minimal residual disease,MRD)阳性的B-ALL治疗[5]。本文主要围绕博纳吐单抗的临床试验、不良反应等方面的最新研究进展进行综述。
博纳吐单抗是同时结合了CD19和CD3的双特异性抗体,相对分子质量为55 kD。近年来关于blinatumomab治疗复发难治性B-ALL的临床研究及疗效总结,见表1。blinatumomab治疗初治B-ALL的临床研究及疗效总结,见表2。
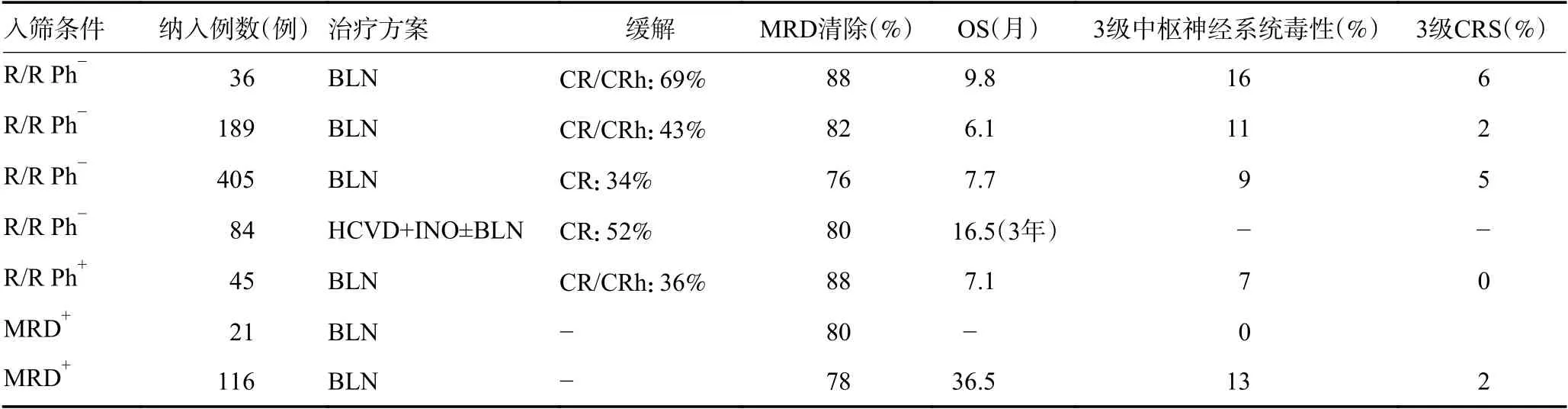
表1 blinatumomab治疗复发难治性ALL的临床研究
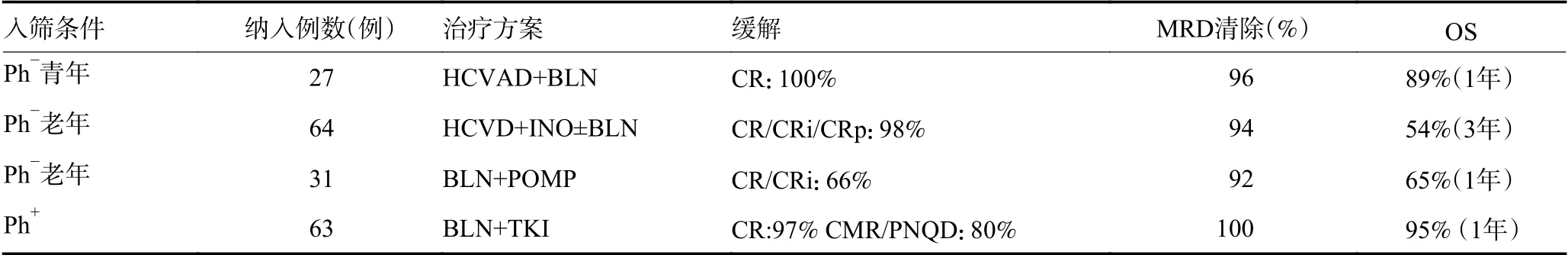
表2 blinatumomab用于初治ALL的临床研究
1 Blinatumomab治疗复发难治性ALL
1.1 Ph阴性复发难治性ALL
1.1.1 单药 TOPP等[6]公布的一项早期Ⅱ期blin atumomab治疗成人费城染色体(Philadelphia chr omosome,Ph)阴性复发难治性ALL的研究结果显示,36例患者治疗2个周期后,25例(69%)患者获得完全缓解(complete response,CR)或部分血液学缓解(CR with partial hematologic recovery,CRh),其中22例(88%)患者MRD阴性。无复发生存期(relapse-free survival,RFS)为6.7个月,OS为9.8个月,6例患者产生3级及以上中枢神经系统毒性,2例患者产生4级细胞因子释放综合征(cytokine release syndrome,CRS)。该试验初步验证了blinatumomab在ALL中的安全性及有效性。另一项大型多中心Ⅱ期试验(MT103-211)[7]共招募189例Ph阴性复发难治性ALL患者。治疗2个周期后,有43%患者达到CR/CRh(33% CR,10% CRh)。中位随访8.9个月时,中位RFS(median RFS,mRFS)为5.9个月,中位OS(median OS,mOS)为6.1个月。在获得CR/CRh的81例患者中,其中32例进行自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT)。中枢神经系统毒性不良反应的发生率为12%,CRS的发生率为2%。与传统挽救性化疗5.4%的长期生存率相比,blinatumo可以达到12.4%。此项试验于2014年推动美国FDA加速批准blinatumomab用于Ph阴性的复发难治性B-ALL的治疗。
由于blinatumomab展现出较传统化疗的优越性,Kantarjian等[8]开展了一项多机构、开放性Ⅲ期临床试验证实blinatumomab比常规化疗更有效。该试验将患者以2∶1比例随机分成试验组和化疗组,267例患者采用blinatumomab方案治疗,109例患者接受常规二线化疗。blinatumomab组的中mOS更长(7.7个月vs. 4.0个月,P=0.01),生存率更高(34% vs. 16%,P<0.001),3级及以上中枢神经系统毒性发生率分别为9.4%和8.3%,3级CRS发生率分别为4.9%和0。该结果显现出blinatumomab较化疗疗效更佳,不良反应更低,2017年美国FDA由此正式批准blinat umomab单药用于复发难治性B-ALL的治疗。
1.1.2 联合用药 前期多项研究证明blinatumomab单药治疗ALL的安全性与有效性。近年来,如酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)、CD20单克隆抗体、CD22单克隆抗体、嵌合抗原受体T细胞免疫疗法等新治疗方式的出现,为ALL多药、多治疗形式联合开辟了新的道路,有学者尝试blinatumomab联合细胞毒药物或其他靶向药物治疗复发难治性ALL可取得更大效益。奥英妥珠单抗是一种抗体药物偶联物(antibody-drug conjugate,ADC),相比于传统化疗,奥英妥珠单抗联合化疗可以有效提高ALL的缓解率。但长期应用奥英妥珠单抗有致静脉闭塞性病的风险。Sasaki等[9]报道的一项mini-hyper-CVD(小剂量CVAD方案,不包括阿霉素)+奥英妥珠单抗联合或不联合blinatumomab治疗复发难治性Ph阴性ALL的研究中,联合blinatumomab可通过减少或分次间隔使用奥英妥珠单抗来降低静脉闭塞性病的发生率(15% vs. 5%)同时提高患者生存率,2年CR为52%, OS 为39%。从该试验长期随访数据来看,3年完全缓解/完全缓解伴不完全血液学恢复(complete response with incomplete hematologicrecovery,CRi)为92%,总生存率(overall survival,OS)为42%[10],不管短期还是长期均取得较好的生存数据。
1.2 Ph阳性复发难治性ALL
1.2.1 单药 Ph阳性提示预后不良,与Ph阴性的患者相比,Ph阳性患者的无事件生存期(event-free survival,EFS)和OS显著降低[11]。Rambaldi等[12]一项Ⅱ期多中心研究评估了blinatumomab治疗Ph阳性的复发难治性 ALL的有效性,纳入45例既往接受过TKI治疗失败患者,36%患者达到CR或CRh,其中88%患者MRD阴性,mRFS为6.7个月,mOS为7.1个月,该试验的结果推动了美国FDA在2017年7月批准blinatumomab用于复发难治性Ph阳性ALL的治疗。
1.2.2 联合用药 TKI的作用机制与BCR-ABL1突变有关,而blinatumomab作为CD3和CD19的双特异性抗体,其作用机制与TKI不同。TKI在复发难治性Ph阳性ALL中具有较好的疗效,将TKI联合blinatumomab或可改变复发难治性Ph阳性ALL的治疗方式。Ph阳性的ALL治疗目标不仅是达到完全缓解,而是达到分子生物学缓解。基于此Assi等[13]一项blinatumomab主要联合普纳替尼治疗复发难治性Ph阳性ALL的试验证明了其有效性及安全性,该方案分子生物学缓解率可达75%。King等[11]一项研究进一步证实blinatumomab联合TKI是Ph阳性ALL患者达到或维持分子生物学缓解的一种安全有效的巩固治疗方案。未来比较blinatumomab联合TKI方案与blinatumomab联合常规化疗方案在治疗Ph阳性的ALL中的优劣,仍需要进一步临床试验的验证。
2 Blinatumomab治疗初治ALL
2.1 诱导治疗
鉴于blinatumomab在治疗复发难治性ALL方面显示出的优势,有研究尝试将blinatumomab用于治疗初治ALL。为进一步改善初治ALL年轻患者的预后,将HyperCVAD序贯联合blinatumomab,即Hyper-CVAD方案治疗4个周期后blinatumomab诱导治疗4个周期,并采用POMP方案维持12个周期(3个周期POMP后1个周期blinatumomab循环交替进行)。该试验允许具有早期高复发风险的患者化疗2个周期后提前使用blinatumomab。纳入的27例患者中,完全缓解率和MRD清除率分别为100%和96%,1年后RFS和OS分别为76%和89%[14]。据SWOGS1318试验[15]公布的结果来看,初治老年ALL患者采用blinatumomab联合POMP方案,1个周期后CR/CRi可达到66%,92%患者可以消除MRD。据意大利GIMEMA小组[16]报道达沙替尼(诱导)分别联合0、2、4个周期blinatumomab(维持)治疗新诊断的成人Ph阳性的B-ALL(NCT02744768),缓解率分别为29%、60%和80%,纳入63例患者中CR高达98%,1年内无病生存率(disease-free survival rate,DFS)为88%,OS为95%。
2.2 MRD清除
2.2.1 单药 MRD阳性是预测疾病复发的重要标志。经过诱导巩固治疗达到CR的成人ALL患者中,有30%~50%患者仍有MRD阳性。MRD无法通过传统细胞学检测出病灶,仅能依靠更敏感的检测技术如流式细胞学、PCR检查等。早期的几项临床试验表明blinatumomab有致中枢神经系统毒性以及CRS等不良反应的可能,而上述不良反应或与高肿瘤负荷相关。将blinatumomab用于MRD阳性患者或可减少不良反应的发生。现已有几项临床试验评估blinatumomab在MRD阳性ALL中的疗效。Topp等[17]公布的数据中,无论Ph阳性或阴性,使用1个周期blinatumomab后,80%患者可取得MRD缓解,1年RFS为78%。3级及以上中枢神经系统毒性发生率为19%,CRS发生率为0,这与之前blinatumomab在低肿瘤负荷疾病中不良反应发生率低的假设相一致。Gökbuget等[18]报道一项blinatumomsb治疗MRD阳性ALL的临床试验,入筛条件为达到CR且MRD阳性(≥0.1%),blinatumomab静脉输注15 μg/d,连续治疗4周,暂停2周。blinatumomab治疗1个周期后,78%患者达到MRD阴性。与MRD阳性相比,治疗1个周期后MRD阴性患者具有更长的RFS(23.6个月vs. 5.7个月,P=0.002)和OS(38.9个月vs. 12.5个月,P=0.002)。此项试验加速美国FDA批准blin atumomab用于MRD阳性的B-ALL治疗。然而上述临床研究均属于小样本量研究,更具规模性及权威性的临床试验亟需开展。
2.2.2 联合用药 目前,关于blinatumomab是否有必要联合TKI治疗MRD阳性ALL尚无明确定论。King等[11]将blinatumomab联合TKI作为巩固治疗方案,以期减少传统化疗联合TKI的不良反应。纳入11例Ph阳性的B-ALL患者接受TKI联合blinatumomab巩固治疗方案,治疗1个周期后,9例MRD阳性的患者中有8个(89%)转为阴性,2例MRD阴性的患者仍然保持分子生物学缓解,且未观察到3级以上不良事件,这项研究表明blinatumo mab联合TKI是达到或者维持分子生物学缓解的一种安全有效的巩固治疗。
3 主要不良反应
Przepiorka等[19]报道在疗程中或治疗结束30天以内,最常发生(发生率>10%)的用药相关不良事件(treatment emergent adverse event,TEAE)有发热(62%)、头痛(32%)、水肿(32%)、发热性中性粒细胞减少(25%)、恶心(25%)、低钾血症(23%)、皮疹(21%)、便秘(20%)、震颤(20%)和腹泻(20%)等。有报道blinatumomab可导致短暂但稳定地促炎性细胞因子产生,或可触发吞噬淋巴细胞组织细胞增生症/细胞因子释放综合征(hemophagocytic lymphohistiocyt osis/macrophage activation syndrome,HLH/MAS)[20]。So等[21]报道的小型研究中,感染的发生率有70%,最常见的分别为下呼吸道、胃肠道、菌血症。另有关于blinatumomab引起H1N1流感病毒相关的非典型肺炎的报道[18]。总的来说,不良反应是可控而短暂的,尽管可以发生可逆的中枢神经系统事件和CRS,blinatumomab仍具有良好的安全性。
4 结语与展望
随着免疫治疗日益成为肿瘤治疗的热点。TKI、利妥昔单抗、奥英妥珠单抗、博纳吐单抗何CART等新治疗相继出现,近年来ALL的治疗取得了突破性进展,然而挑战依然存在。blinatumomab在治疗无论Ph阳性还是阴性的复发难治性ALL、MRD阳性ALL中均取得较好的疗效,且耐受性良好。获得完全缓解且MRD阳性的患者应用blinatumomab后,80%可达到MRD水平缓解。
blinatumomab用于初治ALL仍然存在诸多问题亟需解决,目前关于探寻blinatumomab+TKI+奥英妥珠单抗的最佳联合剂量及用药方式的临床研究正在开展中。据Badar等[22]报道的除临床试验以外,从真实世界中应用blinstumomab的研究结果来看,其疗效性、安全性与临床研究中的结果大致相当,未来亟需更多的临床使用数据评价blinatumomab的疗效。blinatumomab同样也面临着耐药的问题,具体的机制仍未明确,有研究指出或与靶抗原缺失有关[23],也有研究表明可能与CD19基因可变剪接,形成无免疫活性的CD19有关[24],blinatumomab联合免疫检查点抑制剂或许能减少耐药的发生。目前,相关的临床试验也正在进行中,如NCT02879695、NCT03160079、NCT-03512405和NCT03605589等。
