不同浓度镉胁迫下6种草本植物的耐性及富集特征的比较
2021-07-05张杨杨李希铭宋桂龙
张杨杨, 李希铭, 高 鹏, 宋桂龙*
(1.北京林业大学草坪研究所, 北京 100083; 2.北京林业大学林木育种国家工程实验室, 北京 100083)
近年来,随着以镉(Cadmium,Cd)为代表的重金属污染事件的频发,国内外对污染土壤的治理日益重视起来[1]。我国土壤中重金属总超标率达16.1%,其中,Cd由于毒性大、迁移性强和污染面积广等特点,点位超标率高达7.0%,成为最突出的土壤重金属污染物[2-3]。而且土壤中的Cd会通过食物链进入动物和人体,严重危害人类健康[4]。因此,治理土壤Cd污染已经迫在眉睫。
植物萃取是利用植物从土壤中吸收并积累金属离子,收获植物后进行灰化处理以回收金属离子,从而降低土壤中重金属含量的方法,这种植物也叫重金属超累积植物或者重金属超富集植物[5]。植物修复是一种公认的有效修复Cd污染土壤的的绿色途径之一[6],能够利用超富集植物提取、挥发、稳定和降解土壤中的Cd离子,从而减轻土壤Cd污染[7-8]。但植物修复技术仍然面临一些问题,比如大多数超富集植物生长缓慢,生物量小[9],Cd超富集植物类群的数量还很少等[10]。草本植物具有生长快、价格低廉、耐粗放管理、种子易收集等优点,在植物修复工程方面具有极大的应用潜力[11]。在重金属Cd污染土壤地的生态环境修复过程中,种植美观且耐性好的草本植物对受损生态系统的恢复和重建具有重要的现实意义。因此,筛选生物量大、耐性好、富集能力强的植物资源仍是利用草本植物修复重金属污染土壤的热点问题。本研究以紫花苜蓿(Medicagosativa)、百脉根(Lotuscorniculatus)、多变小冠花(Coronillavaria)、披碱草(Elymusdahuricum)、细茎冰草(Agropyrontrachycaulum)和野牛草(Buchloedactyloides)6种常见草本植物为试验材料,研究多梯度Cd胁迫对植物生物量、Cd积累量、耐性系数及根系生长的影响,探讨其富集特征及根系形态变化,并评估其Cd耐性阈值。
1 材料与方法
1.1 供试材料
供试材料为紫花苜蓿、百脉根、多变小冠花、披碱草、细茎冰草和野牛草,购自北京绿冠草业股份有限公司。
1.2 供试土壤
供试土壤采自北京林业大学草坪研究所昌平试验站耕地表层(0~20 cm)土壤,基本理化性质以及重金属Cd背景值如下:pH值7.47,有机质16.7 g·kg-1,全氮0.806 g·kg-1,有效磷30.7 mg·kg-1,速效钾105.3 mg·kg-1,土壤Cd2+含量1.609 mg·kg-1。土壤风干后过4 mm筛孔,用于盆栽试验。
1.3 试验设计
试验采取完全随机区组设计,设置5个Cd处理浓度,即0 mg·kg-1,10 mg·kg-1,25 mg·kg-1,50 mg·kg-1,100 mg·kg-1,以0 mg·kg-1Cd处理浓度设为CK,每个处理设4个重复,共4个区组,每个区组30个处理。
试验采用室外盆栽模拟试验法,称取过筛风干土2.5 kg,混以0.5 kg草炭作为底肥,混合均匀后装填于无孔锥形塑料花盆(高28 cm,口径20 cm,底径10 cm)中,处理组用CdCl2·2.5H2O配成相应处理浓度溶液一次性施入,对照组浇自来水(无Cd元素检出)至田间持水量的60%,静置2周。
培养土静置同时进行供试材料育苗,出苗10 d后选取长势一致的幼苗洗去根际培养基质移栽至培养花盆,每盆5株,温室适应生长2周后定株每盆3株。然后移至室外遮雨培养,培养期间定期定量浇水,保持水分为田间持水量的60%左右。室外培养60 d后收获处理。
1.4 指标测定及方法
1.4.1生物量测定 参考王洪斌等[12]的方法,收获时将植株分为地上部和根部2部分,先用自来水冲洗,然后用蒸馏水漂洗干净,晾干,编号装入牛皮纸袋,放在105℃的烘箱内杀青0.5 h后,75℃烘干72 h,称重获得生物量。
1.4.2植株Cd含量测定 烘干的植株样品充分粉碎后,过0.25 mm孔筛,称取0.5 g,采取HNO3-HClO4(4+1)混合酸湿法消化,使用石墨消解仪(型号Hanon220s)消化完全后定容于25 ml容量瓶,采用原子吸收分光光度计(Varian Spectrum AA220)火焰吸收法测定Cd含量[13]。
植物金属元素含量、积累量、耐性系数、富集系数、转运系数按以下公式计算[14]。
Cd含量(mg·kg-1)=(A1-A2)×V/M,其中A1为测定样液中Cd含量,单位mg·L-1;A2为空白液中Cd含量,单位mg·L-1;V为样品定容体积,单位ml;M为样品质量,单位g。
地上部/根部Cd积累量(μg·pot-1)=植株地上部/根部Cd含量×植株地上部/根部生物量
地上部/根部耐性系数(%)=Cd处理植株地上部/根部生物量÷对照植株地上部/根部生物量×100%
地上部/根部富集系数(%)=植株地上部/根部Cd含量÷土壤中Cd含量×100%
转运系数(%)=植株地上部Cd含量÷植株根部Cd含量×100%
1.4.3根系形态测定 收获时将植株连带栽培土壤整体取出浸入自来水中,流水缓慢冲洗根部土壤以获得完整根系,将根系分解平铺于根系盘内,采用Epson Scan V700根系扫描仪扫描根系图像,使用WinRHIZO PRO 2013根系分析系统软件(Regent Instruments Inc,Canada) 分析得出根系长度、平均直径、表面积、体积、根尖数等根系生长参数[15]。
1.5 数据处理与分析
用Microsoft Excel 2010进行数据统计,运用SPSS 20.0对样本数据进行进行单因素方差分析(one-wayANOVA)。采用Duncan’s多重比较,检验不同处理间差异显著性。OriginPro 2018进行作图。
2 结果与分析
2.1 不同浓度Cd胁迫对植物生物量的影响
不同浓度Cd胁迫下,6种草本植物的生物量如图1所示。与CK相比,随着Cd胁迫浓度升高,紫花苜蓿、百脉根、多变小冠花和细茎冰草地上部生物量均呈先上升再下降趋势,紫花苜蓿、百脉根和多变小冠花根部生物量均呈先上升再下降趋势,且达到显著差异(P<0.05);100 mg·kg-1Cd胁迫下,6种植物地上部生物量均达到最小值,其中紫花苜蓿和多变小冠花死亡。10 mg·kg-1的低Cd胁迫对紫花苜蓿、百脉根和多变小冠花的生长具有促进作用,随着Cd胁迫浓度升高,Cd对植物生长的毒害加重。与CK相比,不同浓度Cd胁迫下披碱草地上部和根部生物量均显著下降(P<0.05),表明披碱草对Cd极其敏感,可以作为Cd污染土壤的指示植物。随着Cd胁迫浓度升高野牛草根部生物量呈上升趋势,且达到显著差异(P<0.05)。与CK相比,紫花苜蓿和多变小冠花在50 mg·kg-1Cd胁迫下地上部生物量减少了85.88%,36.01%,在100 mg·kg-1Cd胁迫下植株死亡,分析紫花苜蓿和多变小冠花对Cd的耐性阈值在50 mg·kg-1到100 mg·kg-1之间;百脉根、披碱草、细茎冰草和野牛草都表现出较好的耐Cd能力,在100 mg·kg-1Cd胁迫下地上部生物量分别减少60.92%,50.20%,41.08%和37.91%,分析百脉根、披碱草、细茎冰草和野牛草对Cd的耐性阈值在100 mg·kg-1以上。
2.2 不同浓度Cd胁迫对植物耐性系数的影响
不同浓度Cd胁迫下,6种草本植物的耐性系数如图2所示。随着Cd胁迫浓度的升高,紫花苜蓿、百脉根、多变小冠花和披碱草的地上部和根部耐性系数均呈下降趋势,且达到显著差异(P<0.05),100 mg·kg-1Cd胁迫下紫花苜蓿和多变小冠花死亡。说明随着Cd胁迫加重,植物对Cd的耐受性逐渐降低,100 mg·kg-1Cd胁迫超出了紫花苜蓿和多变小冠花的耐性阈值而导致植株死亡。10 mg·kg-1Cd胁迫下,紫花苜蓿、百脉根、多变小冠花和细茎冰草的地上部耐性系数均大于1,分别为1.01,1.70,1.08和1.28,紫花苜蓿、百脉根、多变小冠花、细茎冰草和野牛草的根部耐性系数均大于1,分别为1.16,2.01,1.12,1.22和1.51;25 mg·kg-1Cd胁迫下,只有细茎冰草的地上部耐性系数大于1,为1.44,百脉根和细茎冰草的根部耐性系数均大于1,分别为1.17和1.96;50 mg·kg-1Cd胁迫下,6种草本植物地上部耐性系数均小于1,细茎冰草和野牛草的根部耐性系数均大于1,分别为2.09和1.44;100 mg·kg-1Cd胁迫下,6种草本植物地上部耐性系数均小于1,细茎冰草根部耐性系数为2.32。表明不同植物物种对Cd的耐受性不同,在10 mg·kg-1低浓度Cd胁迫下,紫花苜蓿、百脉根和多变小冠花可以作为耐Cd型植物;在25 mg·kg-1,50 mg·kg-1和100 mg·kg-1Cd胁迫下,细茎冰草可以作为耐Cd型植物。

图1 不同浓度镉胁迫下6种植物的生物量Fig.1 Biomass of the six species under different Cd cocentration levels注:不同字母表示差异显著(P<0.05),下同Note:Different letters indicate significant difference at the 0.05 level,the same as below

图2 不同浓度镉胁迫下6种植物的耐性系数Fig.2 Tolerance coefficient of the six species under different Cd concentration levels
2.3 不同浓度Cd胁迫对植物Cd含量的影响
不同浓度Cd胁迫下,6种草本植物的Cd含量如图3所示。随着Cd胁迫浓度的提高,6种草本植物的地上部和根部Cd含量均呈上升趋势,且达到显著差异(P<0.05)。在100 mg·kg-1Cd胁迫下,除紫花苜蓿和多变小冠花死亡外,百脉根、披碱草、细茎冰草和野牛草的地上部和根部Cd含量均达到最大值,说明植物体内Cd含量与Cd胁迫浓度呈正相关性;除紫花苜蓿外,其他5种植物的根部Cd含量均大于其地上部Cd含量。10 mg·kg-1Cd胁迫下,百脉根地上部和根部Cd含量均为6种植物中最大值,分别为10.50 mg·kg-1,40.51 mg·kg-1。25 mg·kg-1Cd胁迫下,百脉根地上部和根部Cd含量均为6种植物中最大值,分别为30.75 mg·kg-1,87.24 mg·kg-1。50 mg·kg-1Cd胁迫下,多变小冠花地上部Cd含量为6种植物中最大值,为65.09 mg·kg-1,百脉根根部Cd含量为6种植物中最大值,为151.26 mg·kg-1。100 mg·kg-1Cd胁迫下,野牛草地上部Cd含量为6种植物中最大值,为156.17 mg·kg-1,百脉根根部Cd含量为6种植物中最大值,为195.55 mg·kg-1。

图3 不同浓度镉胁迫下6种植物的Cd含量Fig.3 Cd concentrations of the six species under different Cd cconcentration levels
2.4 不同浓度Cd胁迫对植物Cd积累量的影响
不同浓度Cd胁迫下,6种草本植物的积累量如图4所示。随着Cd胁迫浓度的升高,百脉根、多变小冠花、披碱草、细茎冰草和野牛草地上部和根部Cd积累量均呈上升趋势,且达到显著差异(P<0.05)。百脉根、披碱草地上部Cd积累量均大于根部Cd积累量,表明其地上部为Cd主要积累部位;细茎冰草地上部Cd积累量均小于根部Cd积累量,表明其根部为Cd主要积累部位。
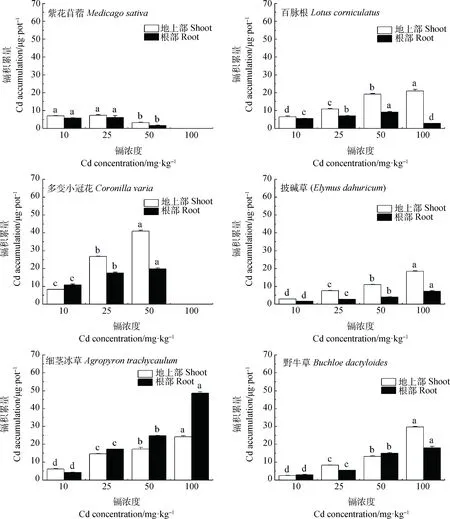
图4 不同浓度镉胁迫下6种植物的Cd积累量Fig.4 Cd accumulation of the six species under different Cd concentration levels
2.5 不同浓度Cd处理对植物富集系数的影响
不同浓度Cd胁迫下,6种草本植物的富集系数如图5所示。不同浓度Cd胁迫下,百脉根、多变小冠花、披碱草、细茎冰草和野牛草的根部富集系数均大于1,其中10 mg·kg-1,25 mg·kg-1,50 mg·kg-1和100 mg·kg-1Cd胁迫下百脉根的根部富集系数均为6种草本植物中的最高值,分别为4.05,3.49,3.03和1.96。随着Cd胁迫浓度的升高,百脉根、多变小冠花、披碱草、野牛草地上部富集系数均呈上升趋势,且达到显著差异(P<0.05);百脉根、多变小冠花、披碱草、细茎冰草的根部富集系数则显著下降(P<0.05),但百脉根、多变小冠花、披碱草、细茎冰草和野牛草的地上部富集系数仍然小于其根部富集系数。表明随着Cd胁迫浓度的升高,植物体内的Cd逐渐由根部向地上部富集,但根部仍然是Cd的主要富集部位。

图5 不同浓度镉胁迫下6种植物的富集系数Fig.5 Bioconcentration factor of the six species under different Cd concentration levels
2.6 不同浓度Cd胁迫对植物转运系数的影响
不同浓度Cd胁迫下,6种草本植物的转运系数如图6所示。随着Cd胁迫浓度的增加,6种草本植物的转运系数均呈上升趋势,其中紫花苜蓿和多变小冠花在100 mg·kg-1Cd胁迫下死亡。紫花苜蓿在0 mg·kg-1,10 mg·kg-1,25 mg·kg-1,50 mg·kg-1Cd胁迫下转运系数均大于1,在50 mg·kg-1Cd胁迫下达到最大值2.15。其他5种植物转运系数均小于1。
2.7 不同浓度Cd胁迫对植物根系形态特征的影响
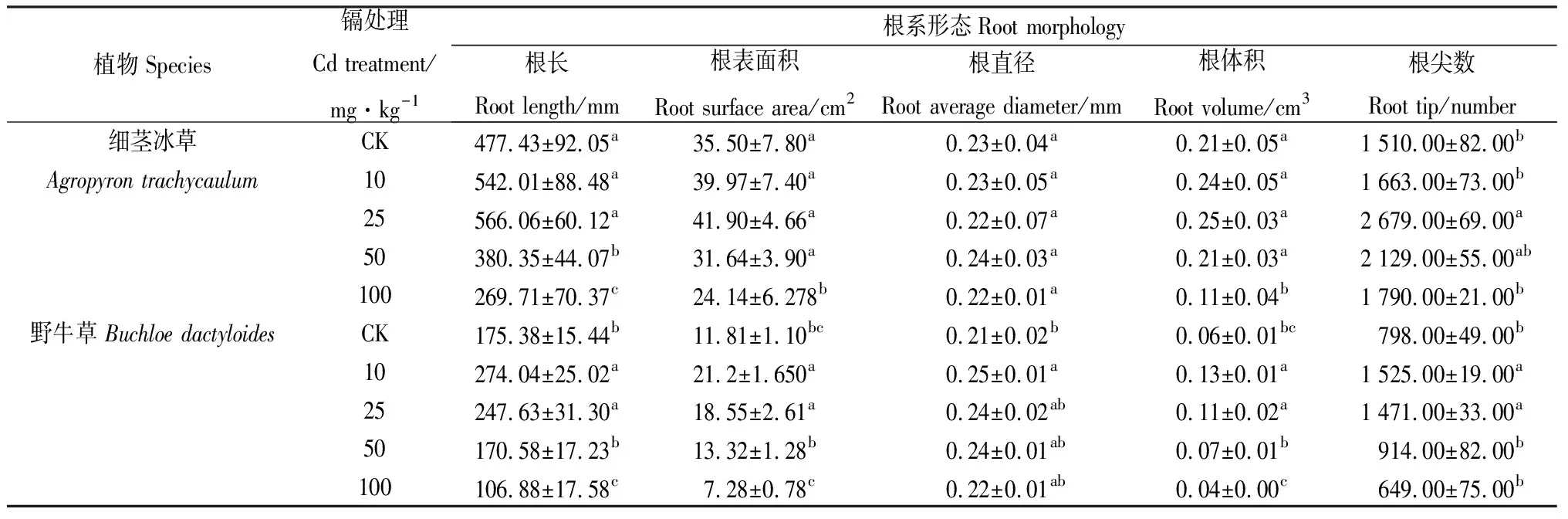
由表1可知,随着Cd胁迫浓度的升高,6种草本植物的根长、根表面积、根直径、根尖数等总体均呈下降趋势,且表现出不同程度的“低促高抑”现象,表明随着Cd胁迫增加,植物根系毒害作用增强,其根系生长也受到不同程度的抑制作用。
与CK相比,6种植物的根长在10 mg·kg-1Cd胁迫下均无显著变化,紫花苜蓿、百脉根、多变小冠花的根长随Cd胁迫浓度的增加均逐渐降低,且达到显著差异(P<0.05)。披碱草和细茎冰草在Cd胁迫浓度为25 mg·kg-1时根长达到最大值,分别为405.16 mm和566.06 mm。野牛草在10 mg·kg-1Cd胁迫下根长显著上升(P<0.05),达最大值274.04 mm。表明Cd胁迫浓度的增加对不同植物根长的抑制作用存在较大的差异。

图6 不同浓度镉胁迫下6种植物的转运系数Fig.6 Transfer factor of the six species under different Cd concentration levels
与CK相比,百脉根、披碱草、细茎冰草和野牛草的根表面积在不同浓度Cd胁迫下总体趋势均先升高再降低,且达到显著差异(P<0.05)。表明低浓度的Cd胁迫可以促进植物根系表面积的生长,高浓度的Cd胁迫会抑制植物根系表面积的生长;紫花苜蓿和多变小冠花的根表面积随着Cd胁迫浓度的增加显著降低(P<0.05),表现出明显的抑制作用。
与CK相比,紫花苜蓿和多变小冠花的根直径随着Cd胁迫浓度的升高逐渐下降,差异显著(P<0.05);百脉根、披碱草、细茎冰草和野牛草的根直径在不同浓度Cd胁迫下均表现出不同程度的“低促高抑”现象,但未达到显著差异。
与CK相比,紫花苜蓿和多变小冠花的根体积随着Cd胁迫浓度的升高逐渐下降,差异显著(P<0.05);百脉根、细茎冰草和野牛草的根体积在不同浓度Cd胁迫下均表现出不同程度的“低促高抑”现象,但百脉根和细茎冰草仅在100 mg·kg-1Cd胁迫下显著下降(P<0.05);野牛草根体积变化达到显著差异(P<0.05)。
与CK相比,6种植物的根尖数在不同浓度Cd胁迫下均呈先上升再下降的变化趋势,表现出不同程度的“低促高抑”现象。紫花苜蓿和多变小冠花根尖数达到最大值为Cd胁迫浓度为10 mg·kg-1时;百脉根在50 mg·kg-1Cd胁迫下根尖数显著上升(P<0.05),达最大值为387.00;披碱草和细茎冰草根尖数在25 mg·kg-1Cd胁迫下根尖数达最大值为1 355.00和2 679.00;野牛草在在10 mg·kg-1Cd胁迫下根尖数显著上升(P<0.05),达最大值为1 525.00。表明不同浓度的Cd胁迫对植物根尖的数量具有显著的刺激作用,且对不同物种的作用效果不同。

表1 不同处理下6种植物的根系形态Table 1 Root morphology of the six species under different Cd levels
续表1
3 讨论与结论
已有研究证实,不同浓度重金属Cd胁迫对不同植物的萌发及生长影响具有物种差异,但低浓度下促进和高浓度下抑制的效应现象普遍存在[16-17]。本研究结果表明6种植物品种总体均呈不同程度的“低促高抑”现象,低浓度Cd胁迫能够促进紫花苜蓿、百脉根和多变小冠花的生长,且对不同植物的促进效果不同,随着Cd胁迫浓度升高,Cd对植物生长的毒害加重,则抑制了植物生物量的积累。这与已有研究结果一致,不同浓度Cd胁迫下紫花苜蓿、尾穗苋(Amaranthuscaudatus)、水稻(Oryzasativa)和冬小麦(Winterwheat)中均发现了“低促高抑”现象[18-21]。本研究中6种草本植物达到生物量最大值时的Cd胁迫浓度不同,表明不同的物种对Cd的耐受能力不同。已有研究表明植物物种、品种和种群不同对Cd的耐受性和生理响应都具有很大差异[22]。贾月慧等[23]研究指出,50 mg·L-1,100 mg·L-1的高浓度Cd胁迫对生菜(Lactucasativa)生物量干质量和鲜质量总量仍有显著的促进作用。这可能是因为,不同植物对Cd的吸收及耐受性与物种、品种有关,不同物种对Cd胁迫的耐性不同,因而其有效浓度存在较大差异,但总体趋势是高浓度Cd对植物生长发育表现出抑制作用[24-25]。
半数效应浓度(Effective concentration 50,EC50)是一个毒理学概念,指引起50%受试个体最大反应的含量,可用于量化评价重金属对植物生物量的胁迫效应,EC90表示和对照相比生物量减少90%时对应Cd浓度,通常作为重金属对植物毒害致死临界值[26]。本试验结果显示紫花苜蓿和多变小冠花对Cd的耐性阈值在50 mg·kg-1到100 mg·kg-1之间;百脉根、披碱草、细茎冰草和野牛草都表现出较好的耐Cd能力,其对Cd的耐性阈值在100 mg·kg-1以上,后续研究可以考虑设置更高浓度的镉胁迫处理。不同植物物种对Cd的耐受性不同,在10 mg·kg-1低浓度Cd胁迫下,紫花苜蓿、百脉根和多变小冠花可以作为耐Cd型植物材料;在25 mg·kg-1,50 mg·kg-1和100 mg·kg-1Cd胁迫下,细茎冰草可以作为耐Cd型植物。
植物的重金属富集能力一般用富集系数或转运系数描述。富集系数(Bioconcentration factor,BF)可以反映出植物对某一种重金属元素的富集能力,值越大表示其富集能力越强[27]。转运系数(Transfer factor,TF)可以体现植物从根系向地上部运输重金属的能力[28]。本研究表明不同浓度Cd胁迫下,百脉根、多变小冠花、披碱草、细茎冰草和野牛草的根部富集系数均大于1,其根部具有较好的Cd富集能力。随着Cd胁迫浓度的升高,6种草本植物的转运系数均呈上升趋势,植物体内的Cd逐渐由根部向地上部富集,且百脉根、披碱草、细茎冰草和野牛草在100 mg·kg-1高浓度Cd胁迫下都表现出较好的耐Cd能力。植物可以通过不同部位Cd的转运提高其耐Cd性,有研究表明施加外源茉莉酸将叶片和根中的Cd转运到了叶柄中,提高了小报春(Primulaforbesii)对Cd的耐性[29]。但除紫花苜蓿外,其他5种植物转运系数均小于1,根部仍然是Cd的主要富集部位。4种浓度Cd胁迫下百脉根的根部富集系数均为6种草本植物中的最高值,表现出较好的Cd富集能力。
根系是植物从土壤中吸收水分和无机养分的重要营养器官,同时也是最先感知到土壤环境中非生物逆境胁迫的器官,因此根系形态可以直观的反应植物在胁迫环境中的适应能力。在Cd胁迫研究中,植物根系对Cd胁迫的耐受性可以反映植物对Cd的抗性[30]。结果表明6种植物根系的根长、表面积、体积等在100 mg·kg-1Cd胁迫下均显著降低,与黑麦草(Loliummultiflorum)、小麦(Triticumaestivum)、水稻(Oryzaglaberrima)等植物的研究结果相同[31-33],直观反映出根系的吸收能力,间接导致植物地上部生物量下降[34-35],这可能与Cd破坏植物根系细胞结构而导致细胞坏死,从而抑制根细胞分裂造成根伤害有关[36-38]。本研究中6种草本植物的根长、根表面积、根直径、根尖数等总体均表现出不同程度的“低促高抑”现象,与生物量结果相一致。有研究发现低浓度的Cd胁迫对植物根系有刺激作用,但是当Cd处理超过一定浓度时,植物的根系生物量减少,根系长度变短,根系表面积减小,这可能与Cd在植物体内的积累有关[39]。聂胜委等[40]研究表明,较低浓度的重金属胁迫对小麦生长有一定促进作用,而在高浓度下抑制种子发芽率和根的生长。在试验中发现的另一个现象是,在中低浓度下,根尖的数量不会显著变化。根尖的数量可以反映出根的侧根形成,推测中低浓度Cd胁迫可以促进侧根生长,补偿因Cd胁迫而受损的根系并保持根系功能。植物地上部Cd含量取决于根系的吸收能力和转运能力,分析结果同样显示多个地上部Cd含量较高植物受到Cd总吸收和转运系数的双重影响,转运系数对其影响更大,而总吸收与地上生物量密切相关而与根形态无明显关系,这与Laporte等[41]获得的结果一致。
综上,不同浓度Cd胁迫下6种草本植物的生物量及根系形态均表现出“低促高抑”现象;不同物种对Cd的耐受能力不同,紫花苜蓿和多变小冠花对Cd的耐性阈值在50 mg·kg-1到100 mg·kg-1之间,百脉根、披碱草、细茎冰草和野牛草对Cd的耐性阈值在100 mg·kg-1以上;在100 mg·kg-1Cd胁迫下百脉根、披碱草和野牛草,可以以植物萃取的方式应用于重金属污染土壤的治理修复;细茎冰草在100 mg·kg-1Cd胁迫下,根系富集系数仍然大于1,且根系生物量、耐性系数具有随着Cd胁迫加重不断上升的趋势,是较理想的修复重金属污染土壤的高耐高抗型草本植物材料。
