苔草属植物遗传多样性研究进展
2021-07-05刘凌云范希峰岳跃森常智慧武菊英
刘凌云, 范希峰, 滕 珂, 岳跃森, 常智慧, 武菊英*
(1.北京林业大学草业与草原学院, 北京 100083; 2.北京市农林科学院北京草业与环境研究发展中心, 北京 100097)
苔草属(CarexL.)是莎草科(Cyperaceae)多年生草本植物,多为自花授粉、雌雄同株。其分布范围广,世界约有2 000种,在中国有近500种,是莎草科中的最大属之一,仅次于大戟属和胡椒属[1-5]。苔草具有自繁能力强、耐荫、耐旱、耐瘠薄等优点,具备一定的观赏价值,不但可以作为优质的草坪地被植物,还能够作为优良的牧草[6-7]。苔草属植物的遗传多样性是长期进化的产物,是其生存和进化的前提[8]。对于植物育种工作来说,研究遗传多样性具有重要指导意义[9]。目前苔草的育种工作也一直是研究的重点,本文主要介绍苔草属植物遗传多样性方面的研究进展,以期为苔草属植物的育种工作和进一步开发利用奠定基础。
1 苔草属植物自然分布及分类学现状
苔草属植物是分布最广泛和具有重要生态意义的植物之一。从分布范围看,莎草科植物遍布世界各地,是植物中少有的遍及亚洲、欧洲和美洲的世界性植物[10],其适应力强,从沙漠到热带雨林甚至北极等各种气候类型条件均可生存[11]。就种类、扩繁能力和生物量来说,苔草在许多区域都是建群的优势种。《中国植物志》收录近500种苔草资源,分布于全国各省区(图1)。苔草属可分为二柱苔草亚属、复序苔草亚属和苔草亚属3个亚属[12-13]。结合《中国植物志》的数据,我们发现二柱苔草亚属分布较为广泛,复序苔草亚属主要分布在长江以南地区。苔草亚属全国范围内均有分布,四川、云南、浙江、台湾等省的分布密度较为集中。我国苔草属资源的自然分布情况表明苔草属可较好地适应我国的不同气候类型,是一类具有重要开发潜力的资源。
近年来,国内外也不断发现苔草属新物种,包括东亚、北美、欧洲地区,以及我国的青藏高原和海南地区等[14-18]。在过去5年里,苔草近源种及种间关系的研究丰富,而缺乏对其系统进化的研究。由于其形态复杂、高变异以及易杂交等特点,苔草纯种和杂种的鉴定比较困难。遗传变异与多样性也随之提高,分类比较困难[3,10,19-20],使苔草成为世界上植物谱系最多样化的植物[21]。对部分地区苔草进行的资源调查与多样性分析证实其群落的物种多样性指数越大,则均匀度指数、物种丰富度指数越大,并且优势度指数相应越小[22-23]。尽管对苔草研究的深度和广度都在增加,但随着苔草属的不断进化与重组,对苔草属内的植物分类仍是一大难题。
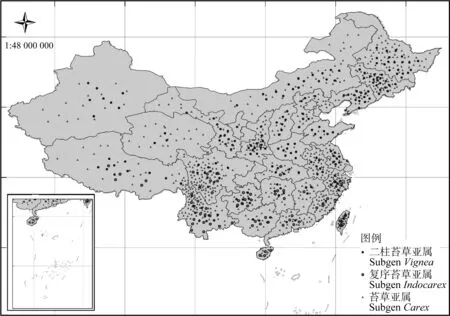
图1 中国苔草属资源分布情况Fig.1 The geographical distribution of Carex Linn. in China注:地图审图号为GS(2014)5260Note:The map verification number is GS (2014) 5260
2 苔草属植物遗传多样性研究概况
2.1 形态多样性
苔草属植物众多,形态各异(图2),评价苔草的形态多样性主要根据色泽、株高、冠幅、叶片长度、叶片宽度、叶片质地等指标[24-25]。苔草属于须根、扩叶型草种,其茎最高能够达到120 cm,粗度最高能够达到4 mm。苔草叶片较为粗糙具有韧性,花序呈圆柱状[26]。种子成熟后为长方形,花朵中雄蕊有3个。苔草属于自花授粉植物,繁殖力强,花粉传播广是苔草扩展能力强的重要原因[27-28]。
形态多样性一定程度上决定了不同的苔草属植物的分布状态。梁芳等[29]对北京地区苔草属植物的研究表明,华北苔草(C.hancockiana)、溪水苔草(C.forficula)等自身株高较高的种类易倒伏,从而形成种群小、丛状分散的分布状态;而生长均一性好,丛高、叶宽相仿的矮丛苔草和披针叶苔草则能形成较大种群的片状分布。梁芳等[30]进一步对20种北京地区引种苔草进行形态学的研究,发现形态高度相似的披针叶苔草、早春苔草和矮丛苔草,在开花结实期间有较大差别,据此可以对这几种苔草进行区分。不足的是,该研究并未通过形态指标对苔草进行遗传多样性的分析。刘凌云等[31]对12份苔草属植物材料的表型性状测量得到的数据进行聚类分析,结果证明地理来源与形态多样性无直接相关性。

图2 北京市农林科学院保存苔草的部分照片Fig.2 Some Carex materials preserved in Beijing Academy of Agriculture and Forestry Sciences注:从左至右依次是矮丛苔草、横果苔草、尖嘴苔草、狼牙棒苔草、蓝苔草、异鳞苔草、棕红苔草、白颖苔草、棕榈叶苔草、涝峪苔草、卵穗苔草、英国苔草Note:From left to right,it’s C. callitrichos,C. transversa,C. leiorhyncha,C. grayi,C. flacca,C. heterolepis,C. buchananii,C. duriuscula,C. muskingumensis,C. giraldiana,C. ovatispiculata,C. england
新品种多是由于表型变异而产生的,而表型变异是由遗传物质决定的。Schmidt等[32]研究了C.flava,C.viridula以及它们的杂交种C.subviridula在相同条件下的生存、生长、繁殖和形态特征,发现遗传变异以及基因型与环境的相互作用都是密切相关的,并且常见的苔草属种类比不常见的种类具有更强的适应性。在越南地区发现的棕叶苔草(C.kucyniakii)是3个物种的复合体,并发生了显著的形态变异,特征是无毛的周膜、鳞片和花序。而都具有短柔毛的C.geographica和C.thinii可以根据雌蕊和雄蕊鳞片形态和花药长度的差异进行区分[33]。在海南新发现的尖峰岭苔草(C.jianfengensis)具约1 cm长的鞘,花序有4个穗,果实呈卵形,是与遵义苔草(C.zunyiensis)相似但是不同的新种类[14]。
对形态水平的研究有助于植物生物学上的识别,但外观差异不明显使得人们无法从肉眼直接区分苔草的种类,虽可以通过开花结实期的果囊形态等进行分辨,但苔草结实期短,此种方法并非快捷有效,这造成了苔草分类及鉴别困难。
2.2 细胞多样性
苔草细胞学遗传多样性的研究主要集中在叶片细胞、果皮细胞以及种皮细胞的研究方面。马万里等[34]通过苔草叶片的硅细胞硅体突起方向差异特征对苔草属进行种间的分类。除了叶片细胞的观察,张树仁等[35]通过对果实的表皮细胞进行了苔草的遗传多样性研究。通过电子显微镜对15种苔草属植物的果皮微形态进行特征分析,将15种苔草属植物进行了区分,证明果皮的微形态特征在种内很稳定,种间存在不同程度的差异。这与马万里等[36]研究发现的苔草种内果实的表皮细胞的形态差异较小,亚属之间存在交叉与渗透的现象相一致。丁雪珍[27]对苔草叶片表皮微状态的研究证明苔草种间可以通过脉区间长细胞的形态、刺毛的有无、气孔的行数、保卫细胞的形态等确定苔草属的属下分组,对苔草属的分类有一定的意义。
明确苔草属植物染色体的数量是了解其核型特征和染色体进化在物种多样性中作用的基础。研究证明,苔草属植物染色体数目的非整倍性特点造成其染色体数目的多态性。Tanaka[37]对13个种的不同组合进行杂交,获得了19个杂交种,并对这32份材料进行了染色体数目统计,发现了33种单倍体染色体数目类型,包括6,8,9,12,13,15,16,17,18,19,23~43,54,56,同时也有非整倍性和多倍体类型出现。多倍体类型的C.siderosticta苔草具有76条染色体,遵循倍数规律,证明苔草属中具有一定程度的天然杂交种。WhikusF等[38]对苔草亚属Ovales包含的8种苔草(C.bebbii,C.crawfordii,C.integra,C.microptera,C.pachystachya,C.praticola,C.preslii和C.subfusca)进行了染色体计数,发现了染色体改变的2种形式分别是结构重排和非整倍性的数目变化,这对苔草属植物的进化与发育、苔草属植物分类等具有重要指导意义。Hipp等[39]研究了北美东部和西部的Ovales,计算表明北美洲东部苔草种质的二倍体染色体计数平均值为68.38,北美西部的二倍体染色体平均计数为79.23。
苔草中染色体数目与基因组大小之间存在一定相关性。Escudero等[40]从Carexgr.laevigata的20个种群中选取了26个已知染色体数的个体,并通过流式细胞术评估了基因组的大小,发现苔草属植物基因组大小和染色体数目之间存在显著的正相关关系,揭示了核型进化在苔草属植物物种多样性中的重要作用。Liu等[41]通过染色体的数目对苔草的亚属进行了分类,发现二柱苔草亚属在切片水平上显示相似的染色体计数,难以进行鉴定,而亚属下的C.repens染色体数目明显不同,极可能为杂交产物,这说明染色体数目与分类学相结合的方法为苔草属植物的分类提供新的方向。
2.3 分子遗传多样性
除了细胞学和形态学标记,现代分子生物学技术也在苔草研究中不断应用和发展。Bogucka-Kocka等[42]尝试通过测定不同酚酸类化合物的含量来对苔草进行划分,结果发现化合物的含量大多偏高,并不能作为苔草分类学依据。相比于细胞学和形态学标记,分子生物技术更快速高效和准确。在分子水平上最广泛应用于遗传多样性分析的是微卫星标记,包括以核糖体DNA(nrDNA)为基础的内部转录(Internal transcribed spacer,ITS)和外部转录(External transcribed spacer,ETS)的方法[43-46];叶绿体DNA(cpDNA)为基础的matK条形码技术;通用引物ISSR标记法[47];转录组测序EST-SSR分子标记法;单核苷酸多态性(Single nucleotide polymorphism,SNP)基因芯片技术等(表1)。这些方法是研究苔草的系统进化与遗传多样性的有力工具,极大地推动了苔草遗传多样性的研究进展。
2.3.1ETS,ITS,matK条形码技术 ETS,ITS和matK都属于通过扩增基因序列达到鉴别植物或微生物的方法,可用于区分亲缘关系非常近的种。不同的是,ITS序列是指rDNA基因中的16S rDNA和23S rDNA基因间隔序,而matK条形码技术是通过扩增叶绿体基因实现的[45,48]。Starr等[4]通过克隆测序获得的matK条形码对3个苔草属亚族进行区分,结果47%的苔草属试验材料可被区分,而且证明可以通过matK条形码技术发现新物种,但是无论是通过单位点和多位点条形码组合都无法识别超过60%的苔草物种。为提高鉴别效率,Míguez等[49]通过开发ITS,ETS,matK标记组合的方式,研究了气候对苔草分布的影响,为苔草的系统地理学提供基础。

表1 近十年对苔草属植物遗传多样性研究的方法及主要结论Table 1 Methods and main conclusions of the research on genetic diversity of Carex Linn. in the last decade
2.3.2ISSR通用分子标记引物 简单重复序列间区标记(Inter-simple sequence repeat,ISSR),不需要预先对植物的转录组进行测序,而是通过生物基因组中出现频率较高的简单重复序列设计引物。包括1~4个碱基组成的串联重复序列及非重复的锚定碱基组成,在PCR作用下通过与基因组DNA中串联重复序列的3′或5′末端结合,凝胶电泳显示多态性[50-51]。为了提高鉴别效率Ning等[47]用简单序列重复标记研究16份山东苔草属材料的遗传多样性,并且根据非加权平均法聚类(Unweighted pair-group method with arithmetic mean,UPGMA)树状图发现地域分布与苔草遗传多样性具有相关性。不足的是ISSR是植物的通用引物,可能造成结果不准确,开发苔草本属植物的特异标记更有利于苔草遗传关系的研究。
2.3.3SSR分子标记 简单重复序列(Simple sequence repeat,SSR),也叫微卫星(Microsatellites)序列,是指可以根据保守的单拷贝序列两端的序列设计一对特异引物,利用PCR技术将其扩增出来并通过电泳获得多态性的一种标记方法[52-54]。其优点是可以直接分析遗传物质,并能快速有效地评估种质资源的遗传多样性,而不受环境条件和基因表达的影响,在苔草中也广泛应用。
苔草属植物的微卫星标记研究主要集中在亲缘多态性关系的研究上,通过开发、分离及鉴定对苔草属植物进行遗传关系的分析。Liu等[55]从青藏苔草(C.moorcroftii)的96个个体中开发分离并鉴定出30个微卫星引物,其中22对引物显示多态性,每个位点有2到11个等位基因,观测杂合度在0.00~1.00之间,期望杂合度在0.00~0.78之间。Li等[56]通过二代转录组RNA测序在白颖苔草中成功开发出144对引物,并且对2种不同基因型的白颖苔草‘绿坪1号’品种进行扩增,发现69对引物表现多态性,为分子标记鉴定不同基因型的品种提供了新思路。Ohsako和Yamane[57]从C.kobomugi中开发了14个微卫星标记,研究了C.kobomugi的24个分型和6个群体中的8个不同个体的多态性。结果证明每个基因座有2 ~ 8个等位基因,期望杂合度在0.04 ~ 0.72之间。基于该研究结果,Kim等[58]从与C.kobomugi可形成复合体的C.macrocephala里分离了11个微卫星标记,证明虽然基因位点的多态性高,但群体的观测杂合性较低,同时开发出的标记在C.kobomugi中也能进行扩增证明了引物的可转移性。M’Baya等[59]利用C.kobomugi开发出的微卫星标记研究了C.hebes和青绿苔草(C.breviculmis)的遗传多样性与海拔的关系,认为2种苔草植物都具有高水平的遗传变异,但克隆度低、近交系数高、隔离程度高。Nagasawa等[60]通过二代转录组数据开发了C.angustisquama的EST-SSR标记,分析C.angustisquama及其近源种C.doenitzii和C.podogyna的多态性关系,其中期望杂合度在0.00 ~ 0.58之间,并发现种群的进化关系可导致较低的多态性,这与Arroyo等[61]对分布在葡萄牙南部和西班牙西南部的苔草C.helodes开发微卫星的研究结果一致,其通过开发的91个多态性位点和18个单态性位点发现基因的变异水平较低。Liu等[62]对同为苔草属的79份苔草材料进行SSR分子标记分析遗传多样性,证明了所选的苔草属植物均存在跨种扩增的现象,这与Gillespie等[11]结果一致。
对苔草属植物的微卫星标记研究证明,苔草属植物具有较高水平的遗传多样性,通过有利等位基因的交流可以减少近交系的衰退,有助于促进适应性差异,同时标记的通用说明微卫星标记在亲缘物种间具有可转移性,这对研究苔草属植物不同种间的遗传多样性具有重要意义。
3 苔草属植物遗传多样性研究的应用
3.1 遗传进化关系
苔草的遗传多样性研究可以对苔草进化史以及基因与地域的关系的研究提供指导。Starr等[5]和GlobalCarexGroup通过研究苔草的遗传多样性研究其分类谱系,结果证明苔草族植物被分为5大谱系(the CoreCarex,Schoenoxiphium,CoreUnispicate,Vignea和SiderostictaeClades)(图3),并且证明苔草属植物在各谱系中均有分布,且许多早期分化的部落谱系都起源于东亚[3,63]。在地理位置与基因的关系的研究上Vellend等[64]认为苔草C.rariflora基因变异与地理因素有关系,并且因为地理位置的因素使亚洲苔草基因变异率明显低于北美苔草。Benítez等[65]的研究也印证了这一观点,通过扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)方法对苔草进行系统发育与地理位置和基因流动的关系进行研究,发现地理因素阻碍了基因的流动,对研究苔草的进化史提供了有力依据。
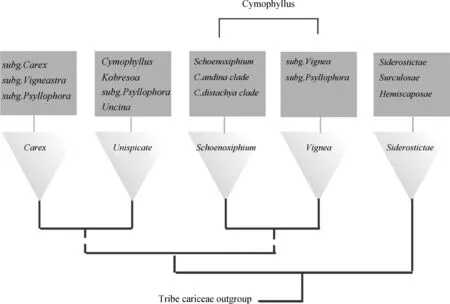
图3 基于分子发育系统的莎草科系统发育树(根据Global Carex Group,2015改绘)Fig.3 Generalized phylogenetic tree of Cyperaceae based on molecular phylogenetic studies(Redrew according to Global Carex Group,2015)注:实线代表的是在大多数研究都支持的关系,虚线则是常见但在研究中不一致的关系;正方形框中代表每个分支又单独分出的2~4个亚群Note:Full lines show relationships that are supported by all or most studies. Dotted branches show relationships that are frequently seen but more inconsistent among studies. The square box represents two to four subgroups that each branch divides into separately
3.2 生产应用
苔草在生产上应用广泛,包括园林绿地、饲料、药用、水土保持等领域[66]。苔草属部分种类具有低矮、地下根茎发达和覆盖度好的特点,具有开发成草坪的潜力,有助于缓解我国草坪草种过度依赖进口的现状[67]。不同类型的苔草在园林绿化中承担的角色各不相同,如植株低矮且耐践踏的可作为草坪应用;而冠幅及高度都较大的可作为观赏草应用[24,68];苔草不仅可以应用在园林绿化,在青藏高原地区也可作为牧草,是一种适口性好、营养丰富的牲畜饲料[69-71];同时部分苔草种类对改善盐碱地,治理土壤沙化也有着重要作用[72];在药用方面,不同季节采收的翼果苔草(Carexneurocarpa)有抗病毒作用,制备的白颖苔草片剂也广泛应用于医药领域[73-74];Kamel等[75]的研究证明苔草中的多酚提取物具有血管松弛作用和抑制哺乳动物精氨酸酶的能力,对改善血管功能具有积极作用。
4 苔草属植物遗传多样性研究存在的问题
研究苔草属植物遗传多样性有助于新品种的培育,现代园林绿化逐渐以生态环保、低维护为优先条件,在这样的环境下,苔草有巨大的开发潜力。目前我国苔草资源收集数量少、重点不够突出、范围不够广泛,商品化的苔草品种较为缺乏(表2)。虽已在国内外园林中开始应用,但面积不大。其次苔草的遗传背景不清晰、亲缘关系不明确、种质资源混乱等问题制约了苔草资源的引种、杂交亲本合理选配以及基因工程育种工作,阻碍了苔草的进一步推广应用。
通过在形态多样性、细胞多样性以及分子多样性水平上对苔草属的遗传多样性进行研究,有助于深入了解苔草属植物,对其分类、遗传育种以及新品种的培育都具有重要意义。目前基于转录组测序开发分子标记已在苔草上面广泛应用,为苔草的分子改良、品种鉴定、指纹图谱的构建等奠定基础。以DNA芯片技术为核心的核苷酸多态性SNP分子标记依赖于完善的基因组信息,随着DNA测序技术的飞跃式发展,越来越多的植物已经进行了完整的基因组测序,为基因组学研究提供了丰富的数据[76]。基因组测序对被子植物的进化历史研究具有重要意义,国外对选育草类植物新品种的研究一直处于领先地位,且正在开展草类植物农艺性状的选择,我国的草类植物种质资源丰富但未能充分开发利用,近年来陆续完成了紫花苜蓿(Medicagosativa) ‘中苜一号’[77]、鸭茅草(DactylisglomerataL.)[78]、象草(Cenchruspurpureus)[79]、小嵩草(Kobresialittledalei)[80]的全基因组测定,为其性状的改良、分子育种奠定基础。而苔草属植物基因组的信息并未见报道,由于缺少基因组和重要性状遗传信息,其遗传与育种工作面临极大挑战,对其优势性状也仅集中在某几个基因的克隆研究,因此十分必要对苔草的基因组信息进行开发与利用。
此外遗传多样性分析在苔草上的应用也有所欠缺,由于苔草种类众多,材料复杂且不易分类,单纯依靠形态指标不能对其进行准确区分,DNA指纹图谱则成为品种鉴定的一种更加便捷有效的方式。很多植物已经成功进行了指纹图谱的绘制,包括假俭草(Eremochloaophiuroides)[9]、老芒麦(Elymussibiricus)[81]、苜蓿(Medicagosativa)[82-83]、大枣(Jujube)等[84]。其中Zhao等[81]利用不同的条带型进行了双亲和雄性的鉴定,通过9对EST-SSR引物对不同老芒麦的品种进行了区分。闵学阳等[82]通过一对引物一次可以区分7个苜蓿品种。李怀志等[85]利用8对引物建立了茄子(Solanummelongena)的指纹图谱,可以把‘闽长茄’与其他茄子品种完全区分开,‘敦和茄’和‘苏大青茄’同其他茄子品种区分开来。王杰等[86]建立了20对引物的指纹图谱,最少利用2对SSR引物组合可鉴别17份国审苏丹草(SorghumSudanense)和高丹草(Sorghumbicolor×SorghumSudanense)。这都证明了分子标记能很好的用于建立指纹图谱并进行品种的鉴定与分类,同时有助于推动苔草的分子标记辅助育种以及亲缘物种鉴定的工作,包括鉴定半同源的父本亲本和选择杂交亲本以产生优良的杂种,为之后的研究提供基础,推动苔草在现代园林绿化的应用,而目前对苔草指纹图谱绘制的工作十分匮乏。
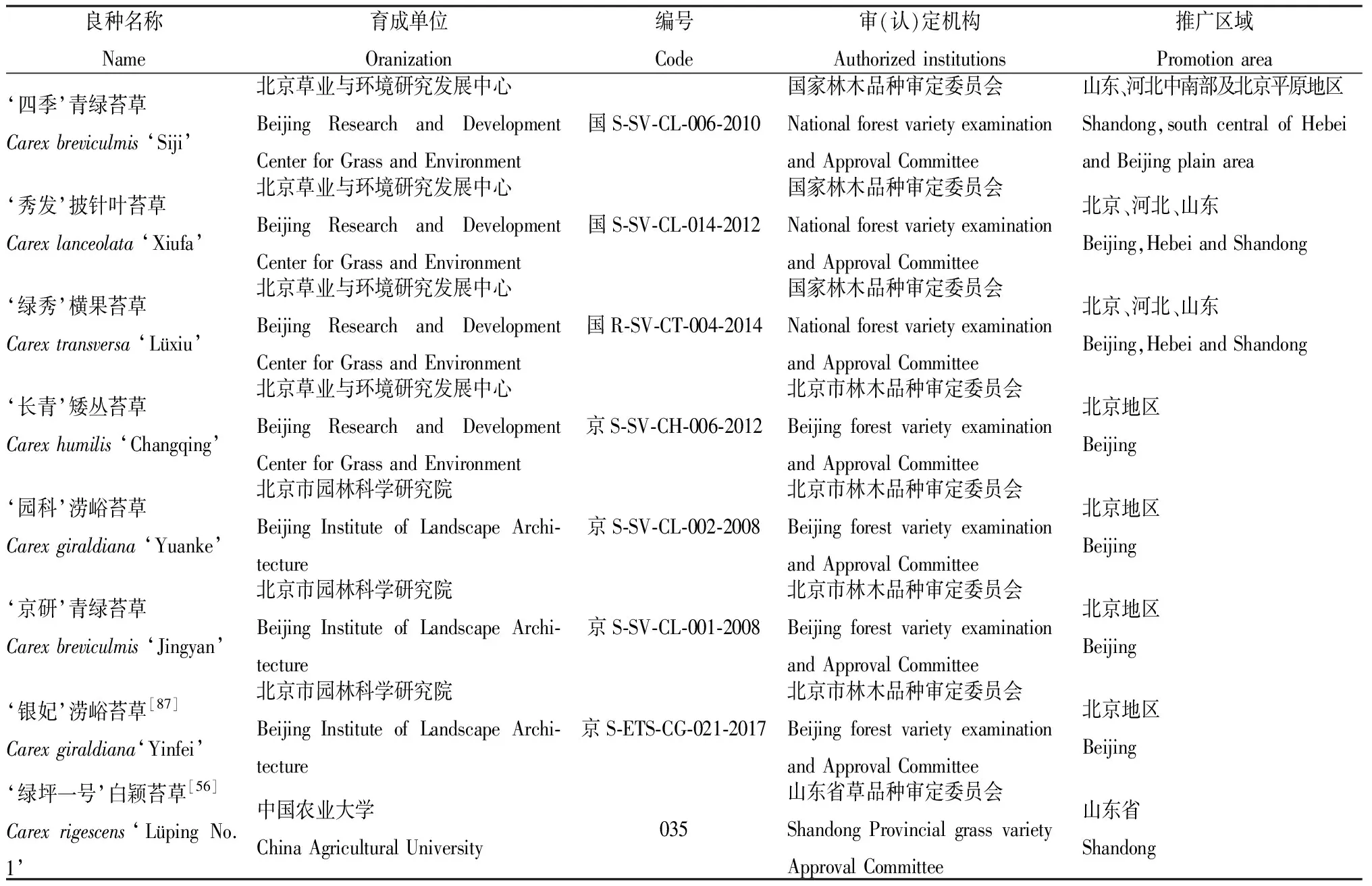
表2 我国自主培育苔草新品种统计Table 2 Statistics of the new cultivars in China
5 结论与展望
苔草属植物作为我国的一种重要的草坪草种质资源,虽然资源丰富,且在生态修复、园林绿化方面都有巨大的应用潜力,但是现阶段我们对苔草研究及利用都十分有限。因此,未来对苔草的研究方向应在苔草遗传多样性的基础上,探讨苔草的进化过程和优良性状的形成机制,以期望培育园林适用的苔草新种质。同时对苔草属植物的遗传多样性研究要更加深入广泛,建立其核心种质资源库、绘制指纹图谱以提高品种鉴定鉴别效率、进行基因组测序等都是重要方向。最终我们通过研究苔草的遗传多样性作为苔草属品种改良的基础,推动培育新品种,发展有自主知识产权的草坪绿化草种,改变“泊来草”、“进口草”的局面,使苔草在我国园林绿化中发挥更大的作用。
