黄连总生物碱与三七皂苷组合物对大鼠糖尿病心肌缺血再灌注损伤的影响
2021-07-03王晓刘博张译心王鑫周赫纪凤兰丁涛温富春徐惠波吉林省中医药科学院长春3002长春中医药大学药学院长春307
王晓,刘博,张译心,2,王鑫,周赫,2,纪凤兰,丁涛,温富春,徐惠波*(.吉林省中医药科学院,长春 3002;2.长春中医药大学药学院,长春 307)
冠状动脉粥样硬化性心脏病是糖尿病患者最主要的大血管并发症,发病率高达55%[1],也是患者死亡的首要原因。由于糖尿病前期与冠心病早期发病均无明显症状,导致诊断不及时,临床在确诊糖尿病时往往已经存在并发冠心病,或在确诊冠心病时已经存在糖耐量异常或胰岛素抵抗等糖尿病前期症状。也正因如此,对于糖尿病合并冠心病的治疗常常将二者割裂开来,按单一疾病或根据出现的合并症状对症治疗。
黄连为多年生毛茛科草本植物黄连的根茎,主要活性成分为生物碱,其中小檗碱的降糖作用一直是讨论热点,而除小檗碱外的其他生物碱也具有降糖作用[2]。三七总皂苷是三七的主要活性成分,可通过调控氧化应激[3]、改善血管内皮功能[4]等多种途径改善糖尿病及其并发症[5]。我们的前期研究提示[6],黄连总生物碱与三七总皂苷组合物(简称HS组合物)对糖尿病及糖尿病冠心病大鼠模型具有较好的药理活性,本实验以前期实验结果为基础,通过建立链脲佐菌素结合冠状动脉结扎制备的大鼠糖尿病心肌缺血再灌注损伤模型研究其对于糖尿病冠心病的影响,旨在充分利用中药多途径、多靶点的特点,从多方面针对糖尿病合并心肌损伤发挥治疗作用,为其进一步的研究与开发提供理论依据。
1 材料
1.1 实验动物
Wistar大鼠,雄性,体质量190~230 g,SPF级[辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2015-0001,合格证号:211002300041542]。实验动物均于屏障系统中饲养,温度湿度恒定,每12 h明暗交替,动物均自由进食饮水。本实验系通过吉林省中医药科学院动物伦理委员会批准后实施,伦理审批号为JLSZKYDWLL 2018-003。
1.2 试药
HS组合物[黄连为毛茛科植物黄连Coptis chinensisFranch.的干燥根茎,黄连提取物其含量以小檗碱计不得小于60%,批号:20180101。三七为五加科植物三七Panax notoginseng(Burk.)F.H.Chen的干燥根和根茎,三七提取物其含量以人参皂苷Rg1计不得小于68%,批号:20180501。将提取物376.5 g与三七提取物36 g,加辅料制得HS组合物](吉林省中医药科学院新药中心化学实验室自制);盐酸二甲双胍片(白云山汤阴东泰药业有限责任公司,批号:180706);链脲佐菌素(美国Sigma公司,批号:WXBC7268V);SDSPAGE凝胶制备试剂盒(批号:20410)、高灵敏度化学发光检测试剂盒(批号:20405)、RIPA Lysis Buffer(批号:30427)、SDS-PAGE Loading Buffer(批号:40320)、Protease inhibitor Cocktail(批号:50321)、Tris-Glycine SDS Buffer(批号:30310)、Tris-Glycine Transfer Buffer(批号:40439)、Multicolor Protein Marker(批号:30312)、TBST(批号:40439)(康为世纪生物科技有限公司);Bax(货号:SC-7480)、Bcl-2(货号:SC-7382)、Caspase-3(货号:SC-65497)、Caspase-1(货号:SC-392736)、IL-1β(货号:SC-515598)、GAPDH(货号:SC-365062)(Santa Cruz);NOX2(博奥森,货号:bs-3889R);NOX4(博奥森,货号:bs-4730R);NLRP3(Abcam,货号:Ab214185);山羊抗兔IgG H&L(HRP)(Abcam,货号:Ab205718)。
1.3 仪器
BGM506型血糖仪(中国深圳家康科技有限公司);PB-10型pH计[赛多利斯科学仪器(北京)有限公司];CS-600B型全自动生化分析仪(中国长春迪瑞实业有限公司);ELx800型酶标仪(美国Bio Tek公司);Leica EG 1130型修切冷台、RM2255型高精密全自动切片机、Leica EG1140型石蜡包埋机(德国Leica公司);PowerLab/8S型多导生物记录仪(ADInstruments公司);DYY-6C型电泳仪(北京市六一仪器厂);FB-40型血液凝固分析仪(中国山西亚森实业有限公司);NIS-ELEMNT BR型图像分析系统(日本NIKON公司);BX51 OLMPUS型光学显微镜(日本OLMPUS公司);HC-3618R型高速冷冻离心机(安徽中科中佳科学仪器有限公司);ChemiDoc-It 510 Imager型凝胶成像系统(Ultra-Violet Products Ltd)。
2 方法
2.1 造模与给药
雄性Wistar大鼠适应性喂养7 d,随机分为对照组(n=16)与造模组(n=54),将两组大鼠禁食12 h,造模组大鼠腹腔注射链脲佐菌素(STZ)55 mg·kg-1(溶于pH 4.2的柠檬酸-柠檬酸钠缓冲液中,在配制后30 min内注射完毕),对照组大鼠则注射等体积溶剂(10 mL·kg-1),造模组大鼠注射STZ 2周后禁食12 h,尾静脉采血检测大鼠血糖,将空腹血糖<11.1 mmol·L-1的未成模大鼠剔除。
根据血糖与体质量均衡原则将成模大鼠分为模型组(n=20)、二甲双胍组(200 mg·kg-1,n=14)、HS组合物组(黄连总生物碱865 mg·kg-1+三七总皂苷84 mg·kg-1,根据前期研究[6]以及预实验结果确定组合物比例,n=15)。分组后每日灌胃给药1次,连续15周。末次给药1 h后,以1.2 g·kg-1剂量腹腔注射乌来糖麻醉大鼠,将其仰位固定于手术台上,切开颈部进行气管插管,并连接呼吸机进行机械通气,以八道生理记录仪持续观察并记录大鼠心电图。于左胸第四、五肋间处切开胸壁,并沿胸骨左缘2 mm处切开第四肋骨,挤出心脏,进针于左心耳下缘2 mm处,穿过左冠状动脉前降支下心肌部分,于肺动脉圆锥左缘出针,在穿线后将心脏放回至胸腔,静置10 min,待大鼠心电图显示T波恢复后,进行冠状动脉结扎,以ECGⅡ导联显示心电图ST段明显提高作为冠脉结扎成功的标志,造成大鼠心肌缺血。于心肌缺血30 min后,再次开胸,剪开结扎线以恢复冠状动脉血流,时间为2 h,对照组除不进行冠状动脉结扎外,与模型组相同操作。实验结束后大鼠腹主动脉取血用于各项指标检测。
2.2 血糖值检测
每4周各组大鼠禁食12 h,尾静脉采血并以血糖仪测量空腹血糖。
2.3 口服糖耐量试验
于试验结束前,将大鼠禁食12 h,以2 g·kg-1剂量灌胃葡萄糖,血糖仪检测葡萄糖灌胃0、30、60、120 min时血液中葡萄糖浓度,并绘制血糖浓度曲线,计算大鼠血糖浓度曲线下面积(area under the curve,AUC)。
2.4 血清胰岛素含量检测
参照试剂盒说明书,使用ELISA试剂盒测定大鼠血清中胰岛素含量。
2.5 血清氧化应激指标检测
参照试剂盒说明书,检测血清中超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)含量。
2.6 血清心肌酶检测
参照试剂盒说明书,使用全自动生化分析仪检测血清中肌酸激酶同工酶(CK-MB)含量。
2.7 胰腺、心肌组织病理变化的观察
取大鼠胰腺、心脏固定于10%甲醛溶液中,进行常规石蜡包埋、切片,HE染色,光镜下观察胰腺组织与心肌组织的病理学变化。
2.8 蛋白表达检测
称取-80℃冷冻保存的大鼠心肌组织300 mg,剪碎后加裂解液匀浆,冰浴静置20 min,4℃条件下于12 000 r·min-1离心10 min,取上清液,BCA法测定总蛋白浓度,loading buffer处理蛋白后加样,进行SDS-PAGE电泳、转膜及封闭。经过一抗、二抗孵育显色后置于凝胶成像仪中,观察结果并拍照,应用VisionWorksLS软件分析灰度值进行半定量分析。
2.9 统计方法
以SPSS 22.0软件进行统计分析,表中所有数据均以(±s)表示,单因素方差分析(Oneway ANOVA)法进行多组间比较,当P<0.05时,表示差异具有统计学意义。
3 结果
3.1 HS组合物对大鼠空腹血糖值的影响
与对照组比较,模型组大鼠0~16周期间血糖水平明显升高(P<0.001);与模型组相比,二甲双胍组大鼠血糖值于第8周(P<0.05)、第12周(P<0.001)明显降低;HS组合物组大鼠血糖值于第4周(P<0.01)、第8周(P<0.05)、第12周(P<0.05)均显著降低。表示HS组合物对糖尿病大鼠的高血糖有一定的改善作用。结果见表1。
表1 HS组合物对大鼠血糖值的影响(±s,mmol·L-1)Tab 1 Effect of HS compound on fasting blood glucose in rats (±s,mmol·L-1)
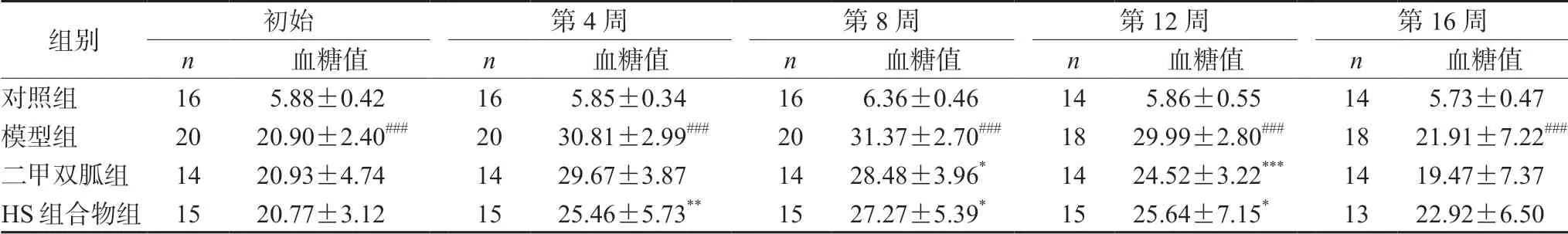
表1 HS组合物对大鼠血糖值的影响(±s,mmol·L-1)Tab 1 Effect of HS compound on fasting blood glucose in rats (±s,mmol·L-1)
注:与对照组比较,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。Note:Compared with the control group,###P<0.001;compared with the model group,*P<0.05,**P<0.01,***P<0.001.
组别初始第4周第8周第12周第16周n血糖值n血糖值n血糖值n血糖值n血糖值对照组16 5.88±0.4216 5.85±0.3416 6.36±0.4614 5.86±0.5514 5.73±0.47模型组2020.90±2.40###2030.81±2.99###2031.37±2.70###1829.99±2.80###1821.91±7.22###二甲双胍组1420.93±4.741429.67±3.871428.48±3.96*1424.52±3.22***1419.47±7.37 HS组合物组1520.77±3.121525.46±5.73**1527.27±5.39*1525.64±7.15*1322.92±6.50
3.2 HS组合物对大鼠口服糖耐量的影响
与对照组相比,模型组在灌胃葡萄糖0~120 min各时间点大鼠血糖均显著升高(P<0.001),AUC明显增加(P<0.001);与模型组相比,二甲双胍组于葡萄糖灌胃后30、60、120 min血糖降低(P<0.001),AUC明显降低(P<0.001),HS组合物组60、120 min血糖均降低(P<0.05)。提示HS组合物能一定程度地降低糖尿病大鼠口服葡萄糖后血糖AUC,作用可维持至给药后120 min,对大鼠糖耐量有良好的改善作用。结果见表2。
表2 HS组合物对大鼠口服糖耐量的影响(±s)Tab 2 Effect of HS compound on oral glucose tolerance in rats (±s)

表2 HS组合物对大鼠口服糖耐量的影响(±s)Tab 2 Effect of HS compound on oral glucose tolerance in rats (±s)
注:与对照组相比,###P<0.001;与模型组比较,*P<0.05,***P<0.001。Note:Compared with the control group,###P<0.001;compared with the model group,*P<0.05,***P<0.001.
组别n血糖值/(mmol·L-1)AUC/(mmol·h·L-1)0 min30 min60 min120 min对照组14 5.73±0.47 7.82±0.72 7.54±0.65 7.34±2.0514.67±0.94模型组1821.91±7.22###31.89±3.01###31.46±2.44###28.85±4.14###59.44±5.53###二甲双胍组1419.47±7.3722.24±7.29***18.78±6.92***14.54±5.27***37.34±11.95***HS组合物组1322.92±6.5030.56±3.4128.52±3.75*25.73±3.06*55.27±6.21
3.3 HS组合物对大鼠生化指标的影响
与对照组比较,模型组大鼠胰岛素、SOD水平明显降低(P<0.001,P<0.05),MDA与CK-MB则显著升高(P<0.05,P<0.001);与模型组相比,二甲双胍组、HS组合物组大鼠胰岛素与SOD水平则明显升高(P<0.001,P<0.05),HS组合物组大鼠血清中MDA与CK-MB含量明显低于模型组(P<0.01,P<0.05),可见HS组合物组给药可降低大鼠氧化应激水平,使胰岛素分泌增加、心肌损伤减轻。结果见表3。
表3 HS组合物对大鼠血清中胰岛素、SOD、MDA及CK-MB水平的影响(n=11,±s)Tab 3 Effect of HS compound on serum insulin,SOD,MDA and CK-MB level in rats (n=11,±s)

表3 HS组合物对大鼠血清中胰岛素、SOD、MDA及CK-MB水平的影响(n=11,±s)Tab 3 Effect of HS compound on serum insulin,SOD,MDA and CK-MB level in rats (n=11,±s)
注:与对照组相比,#P<0.05,###P<0.001;与模型组比较,*P<0.05,P<0.01,***P<0.001。Note:Compared with the control group,#P<0.05,###P<0.001;compared with the model group,*P<0.05,P<0.01,***P<0.001.
组别胰岛素/(mU·L-1)SOD/(U·mL-1)MDA/(nmol·mL-1)CK-MB/(U·L-1)对照组43.95±5.88312.64±47.125.86±1.42 470.19±139.84模型组17.66±4.19###264.81±43.78#7.33±1.32#1259.20±411.06###二甲双胍组25.77±4.57***307.65±35.25*6.54±1.68 925.53±326.27*HS组合物组30.80±2.77***313.51±52.70*6.00±0.80** 914.01±344.49*
3.4 HS组合物对大鼠胰腺、心肌组织形态学的影响
对照组大鼠胰腺中胰岛组织体积较大且结构完整,呈圆形/类圆形分布,胰岛细胞胞浆丰富且数量较多;与对照组相比,模型组大鼠胰腺中胰岛数量少且分布稀疏,胰岛细胞胞浆减少、数量也明显减少,胰岛明显萎缩;与模型组相比,二甲双胍组大鼠胰岛数目较多,胰岛体积较大,胰岛数量有增加;HS组合物组大鼠胰岛体积较大,且胰岛内细胞数量明显增加,且相比于二甲双胍组,HS组合物组胰岛数量较多(见图1)。
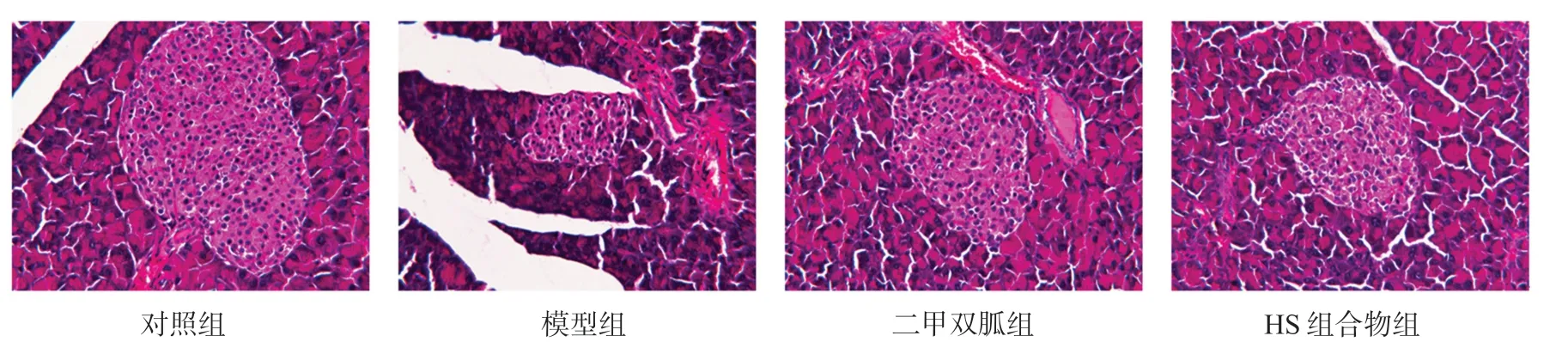
图1 HS组合物对大鼠胰腺组织形态学的影响(HE染色,400×)Fig 1 Effect of HS compound on pancreas histomorphology in rat(HE,400×)
对照组动物心脏可见轻微心内膜心肌间质疏松,心肌细胞染色均匀,心肌纤维排列紧密整齐;与对照组相比,模型组大鼠出现了心肌间质疏松水肿,心肌细胞间边界不清晰、胞浆紊乱且细胞核大小不规则,染色不均,心肌组织发生了明显的组织学改变;与模型组相比,二甲双胍组大鼠心内膜心肌组织肿胀、变性程度较轻,心肌受累面积较小,心肌细胞形态改变程度较轻;HS组合物组大鼠心肌染色不均程度较轻、心肌细胞排列较整齐,心肌损伤程度明显减轻(见图2)。HS组合物组大鼠胰岛组织与心肌组织损伤程度明显轻于模型组,表明HS组合物具有良好的胰岛及心肌组织保护作用。
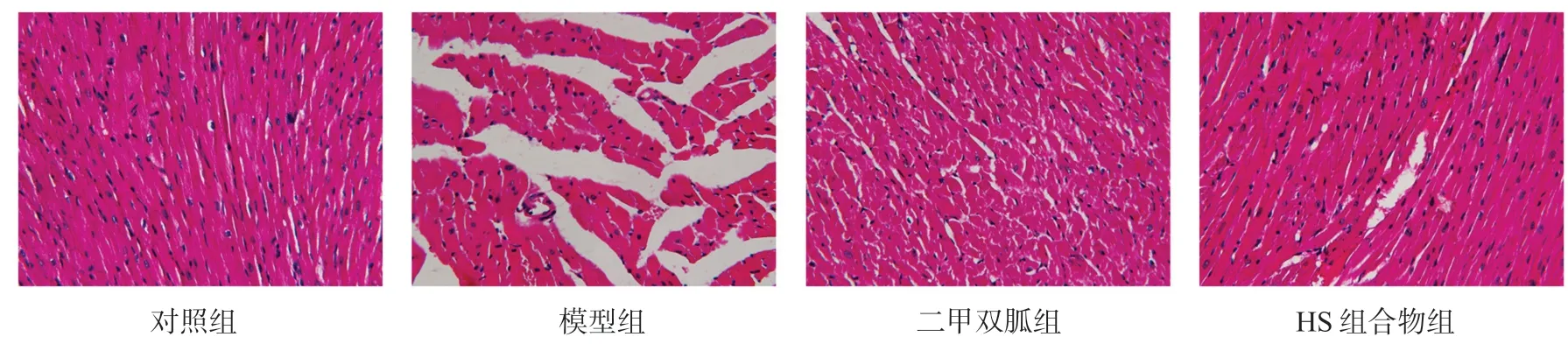
图2 HS组合物对大鼠心肌组织形态学的影响(HE染色,400×)Fig 2 Effect of HS compound on myocardial histomorphology in rats(HE,400×)
3.5 HS组合物对大鼠蛋白表达的影响
与对照组比较,模型组大鼠心肌Bcl-2相关X蛋白(Bax)、半胱氨酸蛋白酶3(Caspase-3)、NOD样受体蛋白3(NLRP3)、还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NOX2)与还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)表达显著提高,B细胞淋巴瘤-2(Bcl-2)表达则明显降低;与模型组比较,二甲双胍组与HS组合物组大鼠心肌中Bax、Caspase-3、NLRP3、NOX2与NOX4等蛋白表达明显降低,半胱氨酸蛋白酶1(Caspase-1)与白介素-1β(IL-1β)有降低趋势,Bcl-2则明显升高。由图3可见,HS组合物能够上调糖尿病大鼠心肌组织中Bcl-2的表达,降低Bax、Caspase-3、NLRP3、NOX2及NOX4的表达,差异均具有统计学意义,从而体现出其对心肌组织氧化应激及炎症反应的改善作用。
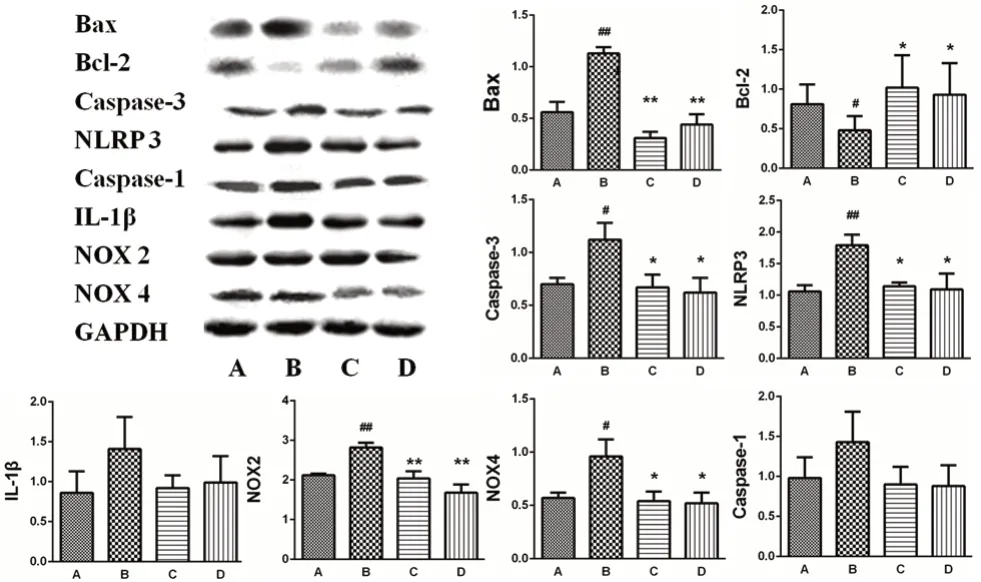
图3 HS组合物大鼠心肌组织Bax、Bcl-2、Caspase-3、NLRP3、Caspase-1、IL-1β、NOX2、NOX4蛋白表达Fig 3 Expression of Bax,Bcl-2,Caspase-3,NLRP3,Caspase-1,IL-1β,NOX2,and NOX4 protein in the myocardium of HS compound group
4 讨论
NADPH氧化酶在心肌缺血与再灌注过程中扮演着重要的角色,可被多种外源性因素激活,如机体的代谢因素、心肌的缺氧、复氧及缺血与再灌注等,是心血管中ROS的主要来源。NADPH氧化酶共有7个亚型,其中NOX2与NOX4是心血管系统中表达的主要亚型,有研究表明,NOX2与NOX4共同参与了糖尿病的大血管病变,粥样斑块中可检测到NOX2与NOX4的高表达,在发生心肌梗死后,NOX2与NOX4在心脏中的水平显著升高[7],而本研究中模型组大鼠NOX2和NOX4的表达情况也与其报道一致。NOX2主要于心肌细胞中大量表达,且分布于正常心肌细胞的细胞质中,当发生氧化应激时,NOX2转移至细胞膜并诱导ROS的产生。NOX4则主要表达于内皮细胞中,对糖尿病冠心病的内皮损伤具有重要意义,它能通过参与血管内皮的收缩舒张、氧化应激与炎症反应影响动脉粥样硬化的进展,是内皮细胞中ROS的主要来源。ROS作为NLRP3的重要激活剂,可通过活化NLRP3诱导炎症反应的发生。NLRP3被ROS激活后,通过Caspase-1大量活化 IL-1β并激活下游信号分子,通过系列信号转导后引发严重的炎症反应。IL-1β作为重要的炎症因子常被认为是NLRP3的激活指标。有研究表明,IL-1β与冠状动脉狭窄程度和病变支数存在正相关。当糖尿病合并冠心病时,长期的高糖环境与动脉粥样斑块的形成可造成心肌缺血缺氧,甚至发生心肌梗死导致死亡。
目前,对于糖尿病合并冠心病的治疗主要是通过药物或血运重建手术来恢复血流以保护心肌缺血造成的心肌损伤与坏死,然而在恢复血流的同时,由于心肌复氧导致线粒体功能失调,进一步促进ROS的大量释放,引起NLRP3的持续激活,致使IL-1β与Caspase-1等异常增加,导致心肌发生细胞凋亡与炎症性坏死[8]。Bax与Bcl-2属于Bcl-2家族,在心肌细胞凋亡过程中起重要作用。Bax通过增加线粒体膜的通透性使细胞色素C穿过线粒体膜,激活Caspase-9,从而激活凋亡的执行者Caspase-3,被上游始动子激活后的Caspase-3作用于下游特定的信号分子,使细胞产生一系列的生物形态学改变,最终发生心肌细胞凋亡[9]。Bcl-2则通过抑制线粒体膜的通透性来抑制下游Caspase-3的激活[10],从而抑制心肌细胞凋亡[11]。
越来越多的研究表明中药在糖尿病合并心血管疾病方面具有很大的研究价值和开发潜力。配伍是中药应用最经典的方式,临床的联合用药也提示我们,单一药物很难从多方面抑制复杂疾病的发生发展。本研究试图根据传统中医药理论采用黄连总生物碱与三七总皂苷配伍来实现清热泻火、散瘀通脉的功效,用于治疗糖尿病并发心肌损伤。黄连在糖尿病的研究中一直颇受关注,其有效成分的研究以小檗碱居多[12],而对于黄连总生物碱报道较少,有研究表明,黄连总生物碱可通过调节炎症反应、胰岛素抵抗、糖脂代谢、胰岛细胞功能等多种途径改善糖尿病[13]。三七作为传统的活血化瘀药从古沿用至今,三七总皂苷作为三七的主要活性成分更是应用广泛[14],具有调节血脂、改善心脏功能[15]、改善心肌细胞衰老[16]等作用。
本实验采用两者配伍,通过STZ结合冠脉结扎建立大鼠糖尿病心肌缺血再灌注损伤模型观察HS组合物对糖尿病合并冠心病大鼠心肌缺血再灌注损伤的作用。结果表明,HS组合物能降低糖尿病合并冠心病大鼠血糖,提高胰岛素水平,改善大鼠口服糖耐量、通过下调NOX2、NOX4、NLRP3以及Bax、Caspase-3的表达,上调Bcl-2蛋白的表达抑制糖尿病心肌缺血大鼠氧化应激与炎症反应,减轻心肌细胞凋亡,从而改善糖尿病合并冠心病诱导的心肌损伤。目前,小檗碱针对糖尿病治疗在临床已有应用,但仍作为辅助治疗联合其他降糖药使用,本试验采用黄连总生物碱与三七总皂苷配伍,在保证降糖效果的同时减轻心肌缺血再灌注引起的氧化应激、炎症反应,为该品种的开发提供了理论依据。
