白藜芦醇局部应用制剂研究进展
2021-07-03王鹤樵张婷任金妹纪宏宇唐景玲哈尔滨医科大学药学院哈尔滨5008复旦大学附属中山医院青浦分院上海0700
王鹤樵,张婷,任金妹,纪宏宇,唐景玲*(.哈尔滨医科大学药学院,哈尔滨 5008;.复旦大学附属中山医院青浦分院,上海 0700)
1 白藜芦醇简介
白藜芦醇(resveratrol,Res)是一种天然多酚类活性物质,主要存在于虎杖、决明、藜芦等多种中药中,也存在于花生、葡萄、桑葚等食物中,其化学名称为3,5,4'-三羟基二苯乙烯,分子式为C14H12O3,相对分子质量为228.25。Res为白色针状晶体,难溶于水,易溶于乙醚、氯仿、甲醇、丙酮等有机溶剂。Res有顺式(cis-Res)和反式(trans-Res)两种异构体,反式异构体的生理活性强于顺式异构体。植物中的Res主要以反式结构存在。研究表明,Res具有抗癌、抗氧化、抗菌、抗炎、保护心血管、免疫调节、保肝、抗神经退行性疾病、抗病毒、抗衰老等多种功效[1-2]。因此,Res被广泛地应用于医药、食品、化妆品、保健品等领域,具有良好的发展前景。
2 白藜芦醇局部应用制剂现状
Res局部应用制剂主要以皮肤给药途径为主,此外还有鼻腔、眼部、口腔、阴道等给药途径,具体见表1。

表1 白藜芦醇局部应用制剂研究现状Tab 1 Topical preparations of resveratrol
2.1 皮肤给药制剂
Res应用于皮肤可以抵御紫外线引起的皮肤损伤、抑制皮肤色素沉着和黑色素生成、抗炎、抗氧化、抗衰老、促进伤口愈合等。但Res存在溶解度低、化学稳定性差、皮肤渗透性和滞留性有限等问题,所以研究者们采用囊泡、乳剂、纳米粒等新型载体提高Res的溶解度、改善其光稳定性、增强皮肤渗透和滞留、提高药效等。
2.1.1 囊泡 囊泡可根据组成成分不同分为脂质体类和类脂囊泡类。Negi等[3]研究制备了Res类脂囊泡凝胶用于局部抗炎,其12 h的经皮渗透量和皮肤滞留量均高于Res混悬液,且能提高Res在表皮和真皮层中的t1/2和AUC0~6h,并显著降低tmax;与市售双氯芬酸钠凝胶相比,Res囊泡凝胶可充分减轻大鼠足部炎症模型的水肿程度并延长作用时间。弹性类脂囊泡可以通过小于其大小的毛孔而结构不被破坏,通常被用于局部或透皮药物递送[4]。Abbas等[5]将Res载入由Span 60和Brij 35所组成的弹性纳米囊泡中,与Res混悬液相比,Res弹性囊泡具有更大的体外释放量、更好的自由基清除效果、更优的光保护作用,能够更好地抵御紫外线对皮肤的损伤。醇质体是一种含有较高浓度醇的脂质体,是渗透性、皮肤滞药量及包封率更好的脂质囊泡[6],Arora等[7]以磷脂、乙醇、硬脂胺、丙二醇为材料制备了Res醇质体,并将其分散至凝胶中,离体皮肤渗透研究表明,Res醇质体凝胶的渗透率/渗透系数和皮肤滞留量分别是传统乳膏剂的2.04倍和4.6倍,证明其可增强对皮肤病的治疗作用。
2.1.2 乳剂 Pickering乳液是一种以吸附于油水两相界面的固体微粒作为乳化剂的新型乳液,比传统乳液具有更好的抗聚结稳定性和安全性[8]。Sharkawy等[9]制备了以壳聚糖/阿拉伯胶纳米颗粒作为乳化剂的Res的Pickering乳液,并用于化妆品中,其冷冻扫描电镜图如图1所示。用Franz扩散池考察Res在猪离体皮肤上的吸收和渗透,给药24 h后,所制备的两种Pickering乳液的Res经皮渗透率比对照溶液明显更低,而皮肤滞留率明显更高。光稳定性测试表明,在紫外光下暴露4 h后,对照溶液中的Res损失至68.15%,而Pickering乳液中Res的量保持不变。以上结果说明Pickering乳液可使Res更多地滞留于皮肤中,且能提高Res的光稳定性。

图1 在冷冻扫描电镜下拍摄的Pickering乳液的乳滴结构(A)和完整乳滴(B)Fig 1 Droplet structure(A)and intact droplet(B)of Pickering emulsion under Cryo-SEM
纳米乳是乳滴粒径为1~100 nm的乳剂,具有比表面积大、粒径均匀、稳定性好、生物利用度高等优点[10]。Sharma等[11]以Sefsol 218为油相、Tween 80为乳化剂、PEG 400为助乳化剂,制备了Res纳米乳凝胶用于防止紫外线引起的氧化性皮肤损伤。与Res普通凝胶相比,纳米乳凝胶的皮肤沉积量更高,且能渗透到皮肤层的更深处。氧化应激研究中,纳米乳凝胶治疗组的皮肤中各抗氧化因子的水平显著高于普通凝胶治疗组,且Res纳米乳凝胶比普通凝胶更能抑制紫外线引起的海绵状变性、水肿和表皮增生反应。以上结果均证明,将Res制成纳米乳可更有效地预防紫外线造成的氧化损伤。
2.1.3 纳米粒/微粒 Shrotriya等[12]用双硬脂酸甘油酯和Tween 20制备了Res固体脂质纳米粒(solid lipid nanoparticle,SLN)凝胶,用于治疗刺激性接触性皮炎。与普通凝胶相比,SLN凝胶能使Res更多地滞留在皮肤中,适合局部治疗;Res-SLN凝胶比普通凝胶能更有效地抑制二硝基氯苯诱导的小鼠耳肿胀,与含有皮质类固醇的市售制剂相当,说明其药效明显。Fachinetti等[13]制备了PEG 40硬脂酸酯的Res纳米结构脂质载体(nanostructured lipid carrier,NLC),用于抑制皮肤色素沉着和黑色素生成。Res-NLC对酪氨酸酶的抑制作用是Res溶液的1.31倍,表明将Res载入PEG 40硬脂酸酯的NLC中可以增强其对酪氨酸酶的抑制作用。Abbas等[14]使用泊洛沙姆407/泊洛沙姆188混合表面活性剂制备了基于山嵛酸甘油酯的Res脂质纳米粒,用于皮肤抗氧化、抗炎和抗衰老。与Res混悬液相比,用Res脂质纳米粒对大鼠皮肤进行预处理可显著改善户外紫外线照射所导致的皮肤抗氧化能力下降、炎症反应、皱纹及光老化现象。Gokce等[15]研究了载有Res-透明质酸-二棕榈酰磷脂酰胆碱微粒的胶原蛋白真皮基质(微观结构如图2所示)对糖尿病大鼠的伤口愈合作用。结果显示与Res溶液相比,载Res微粒的真皮基质可明显促进伤口愈合,促进胶原纤维及有效的上皮再生,且抗氧化能力更优。综合以上各例,纳米粒/微粒可有效提高Res的治疗作用。
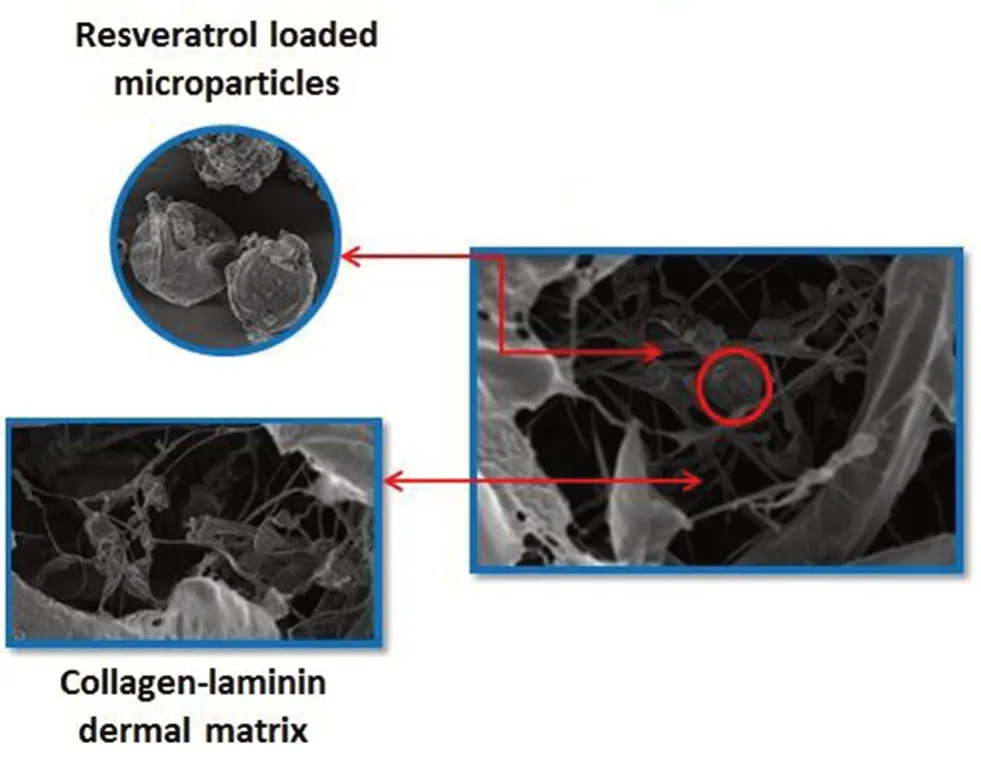
图2 载有Res微粒的真皮基质的微观结构图Fig 2 Microstructure of the dermal matrix impregnated with Res microparticles
2.2 其他给药途径制剂
2.2.1 鼻腔给药制剂 Res可防治神经退行性疾病,发挥神经系统保护作用[1-2]。鼻腔给药能够绕过血脑屏障,使药物靶向递送于脑部,因此,鼻腔给药制剂是治疗脑部疾病的研究热点[16]。但鼻黏膜纤毛的快速清除作用导致药物在鼻腔的停留时间短,且Res具有水溶性差的问题,导致生物利用度低,Res鼻腔给药的效果较差。将Res制成适宜的制剂可改善黏膜黏附性从而延长鼻腔滞留时间,并能提高Res溶解度、鼻黏膜渗透性、生物利用度等。
Salem等[17-18]分别制备了Res纳米乳凝胶和Res传递体凝胶。Res纳米乳凝胶在6 h内的体外鼻黏膜渗透量明显高于普通凝胶。Res传递体凝胶的体外释放率和鼻黏膜离体渗透率均高于Res混悬剂。与口服Res混悬液相比,鼻腔给予Res纳米乳凝胶或Res传递体凝胶均可使血浆Cmax和AUC0~∞明显提高,说明纳米乳凝胶和传递体凝胶均可显著提高Res的生物利用度。Rajput等[19]制备了载有Res-NLC的原位凝胶用于治疗阿尔茨海默病。体外鼻黏膜渗透实验显示,Res-NLC原位凝胶在鼻黏膜上的渗透率是Res混悬原位凝胶的5倍;Morris水迷宫实验对健忘症模型大鼠进行体内药效学研究发现,与口服Res混悬液相比,鼻腔给予Res-NLC原位凝胶可使大鼠的记忆功能显著改善。Trotta等[20]制备了Res脂质微粒(LMs-Res),并用8.75%壳聚糖溶液对微粒进行包被,制备了壳聚糖包衣微粒(LMs-Res-Chplus)。静脉注射游离Res后未在大鼠脑脊髓液中检测到Res,而鼻腔给予LMs-Res和LMs-Res-Ch-plus后,脑脊髓液中Res的Cmax分别为0.79 μg·mL-1和9.7 μg·mL-1,且180 min内未在血流中检测到Res,说明制备的Res微粒具有良好的脑靶向性。Ahirrao等[21]制备了Res立方晶并将其混悬于温敏型原位凝胶中。与口服或鼻腔给予Res溶液相比,鼻腔给予Res立方晶凝胶后,大鼠大脑中Res的Cmax、AUC0~24、AUC0–inf值均显著提高。Res立方晶原位凝胶的药物靶向效率和直接转运百分比分别为213.7%和53.1%。说明立方晶原位凝胶可提高Res在大脑的生物利用度且具有靶向效果。
2.2.2 眼部给药制剂 Res作用于眼部可降低青光眼的眼内压、治疗糖尿病性视网膜病等。但眼部保护屏障的存在会导致常规制剂的生物利用度较低[22]。将Res制成新型制剂,可以增加角膜渗透性、提高药效、减小刺激性等。
Pandian等[23]通过离子凝胶法制备了载Res的PEG修饰的壳聚糖(CS)纳米粒(NPs),用于治疗青光眼。与普通CS NPs只能累积在角膜表面相比,PEG修饰的CS NPs可穿过角膜并到达视网膜脉络膜。药效学研究显示,载Res的PEG修饰的CS NPs比Res分散液及普通Res CS NPs的降眼压效果更好。Ruginǎ等[24]制备了Res聚电解质微囊,用于将Res直接递送到视网膜色素上皮D407细胞中,从而治疗糖尿病性视网膜病。研究发现,用Res微囊分别处理在正常和高糖诱导的炎症条件下生长的D407细胞,24 h后微囊均入胞并位于细胞核附近。此外,Res微囊能够抑制高浓度葡萄糖导致的D407细胞中血管内皮生长因子和IL-6水平的升高。Natesan等[25]制备了Res和槲皮素(quercetin,QUR)共载的PEG修饰的CS NPs用于降低青光眼的眼内压。与游离Res相比,Res纳米粒和Res-QUR纳米粒均能更有效地清除自由基,且刺激性更低,降眼压效果更明显,作用持续时间更长。
2.2.3 口腔给药制剂 Res具有治疗口腔炎性病变及牙周袋的作用,但其口服生物利用度差,局部给药可克服这一缺点。将Res制成黏膜黏附性制剂,利用制剂的生物黏附性来延长其在黏膜表面的保留时间,从而达到更好的疗效[26]。
Martins等[27]用卡波姆934、羧甲基纤维素、聚乙烯吡咯烷酮K30和甘露醇制备了两种不同处方的Res颊黏膜黏附片剂来预防和/或治疗口腔炎性病变。用猪颊黏膜进行药物渗透研究,结果含较少黏度调节剂的处方表现出更好的黏膜渗透性和滞留性,且透过黏膜的药量远低于滞留在黏膜中的药量,说明其适合局部应用。Kassem等[28]用硫醇化海藻酸钠(TA)和海藻酸钠(A)制备了黏膜黏附性微珠,用于治疗牙周袋,结果显示,溶胀1 h后,A微珠及TA微珠(A∶TA=1∶1)的溶胀指数分别为18.793和7.033;离体黏膜黏附性实验中,1 h后TA微珠剩余26%,而A微珠只剩余2%;体外释放实验中,A微珠及TA微珠的释放指数n分别为1.464和1.124。以上结果证明TA微珠比A微珠溶胀和溶蚀的速度更慢,TA微珠能显著降低Res的释放速率。
2.2.4 阴道给药制剂 Res阴道给药可治疗局部感染,但Res的低溶解度及生物利用度使其应用受到了限制,且阴道液的清除作用会降低药物疗效。新型制剂可延长Res在给药部位的保留时间、改善溶解性、提高药效。
Jøraholmen等[29]制备了Res壳聚糖包衣脂质体用于治疗阴道感染。体外黏膜黏附性实验表明,壳聚糖包衣脂质体的黏膜结合能力显著高于未包衣脂质体。通过测定脂多糖(LPS)诱导的J774A.1细胞中的SOD活性来比较抗氧化活性,通过测定NO、TNF-α和IL-1β的产生来比较体外抗炎活性,结果显示与Res溶液相比,Res脂质体可更有效地提高SOD活性,并能更有效地抑制NO、TNF-α和IL-1β的产生,证明脂质体能提高Res的抗氧化和抗炎活性。此外,该团队还以壳聚糖为凝胶基质开发了Res脂质体凝胶,与Res溶液或Res普通凝胶相比,Res脂质体及Res脂质体凝胶持续释药的能力更好。离体黏膜渗透实验显示,Res脂质体及Res脂质体凝胶中大部分Res滞留在黏膜组织内,从而避免药物大量进入全身循环。此外,空白脂质体凝胶还表现出有效的抗炎活性,表明壳聚糖水凝胶在抗炎方面具有协同作用[30]。
3 讨论与展望
Res由于其特有的抗氧化、抗炎等药理作用而受到了广泛的关注和研究,其在局部应用方面的研究也取得了许多进展。但目前尚未有文章对Res局部应用制剂进行综述,本文总结了以往文献中关于Res局部应用制剂的研究情况,涉及到的剂型包括纳米粒、微粒、囊泡、乳剂、微囊、微珠等。不同剂型的应用可改善Res的水溶性差、渗透性差、不易通过血脑屏障等问题,还能增强Res局部滞留性、延长Res释放时间、提高药效等。但Res尚未有临床上市的制剂,这可能是由于其稳定性及溶解性差,增大了相关制剂在开发、生产、贮存、发挥疗效时的难度。Res因其调节三高、抗氧化、抗癌、保护心血管、抑制肥胖等作用而受到保健品市场的广泛欢迎,因其良好的抗氧化、抗衰老、美白等功效而受到化妆品市场的青睐,并已被列入《国际化妆品原料标准目录》中,目前已有多种保健品及化妆品上市销售,但Res在药品领域的应用仍需进一步探索。
