某肿瘤医院药物临床试验中611例次严重不良事件报告分析
2021-07-03杨凤黄哲衡建福李坤艳祖泽民黄钢禹华月湖南省肿瘤医院医学伦理委员会长沙4003南华大学研究生院湖南衡阳400
杨凤,黄哲,衡建福,李坤艳,祖泽民*,黄钢*,禹华月*(.湖南省肿瘤医院医学伦理委员会,长沙4003;.南华大学研究生院,湖南 衡阳 400)
上市前新药临床试验(包含有效性评价和安全性评价)是新药开发的重要环节[1-2],其中,安全性评价是全面、客观评价一个试验药物不可或缺的内容。安全性评价包括不良事件(adverse event,AE)与严重不良事件(serious adverse event,SAE)的收集、记录与上报。新药临床试验中受试者发生SAE可能会导致住院治疗、延长住院时间、致伤残、影响工作能力、危及生命、导致先天畸形甚至死亡等[3],严重影响受试者的用药安全。
本文通过收集某院2016—2018年期间临床试验受试者发生的SAE,对SAE从年龄、性别、癌种、受试者自身合并疾病/治疗、SAE与试验药物因果关系、药物类别与品种、SAE累及器官等基础性数据进行分析,总结SAE发生的规律和特点,以期对临床试验中受试者发生SAE提前预警,进一步保障受试者安全用药。
1 资料与方法
1.1 资料来源
资料来源于2016—2018年某院伦理委员会接收的临床试验中受试者发生的所有SAE,共计611例次。同一试验中同一受试者发生不同SAE按多例次计算,2016年接收101例次,2017年155例次,2018年355例次,共计611例次SAE。
611例次SAE共涉及118项临床试验,其中1项为非干预性临床试验,剩余117项均为干预性药物临床试验,无医疗器械临床试验。117项药物临床试验中,含3项非抗肿瘤药物临床试验,对应试验药物分别是红细胞生成素类似物、化疗止吐药、抗凝药。
611例次SAE中,除1例次SAE来源于抗凝药临床试验的健康受试者外,剩余610例次SAE均发生于肿瘤受试者。
1.2 数据处理
将611例次SAE报告进行数据提取,把收集到的数据整理并录入Excel表中,采用数据频数描述法,从年龄、性别、癌种、受试者自身合并疾病/治疗、SAE与试验药物相关性等方面进行统计分析。
本研究将研究者判断与试验药物相关性为“肯定无关”“可能无关”“无关”,以及因受试者发生SAE时尚未使用试验药物,研究者判断相关性为“不适用”的情况,归纳汇总为与试验药物“无关”。由于因果关系为“无法评价”或者“未知”的安全性事件均无法除外相关性,国家药品监督管理局药品审评中心要求,此类安全性事件也需加速报告[4]。基于保守原则或称之为“不利于”新药原则,本研究中将研究者判断与试验药物相关性为“无法判断”“肯定有关”和“可能有关”,一并归纳为“有关”SAE。采用归纳总结法,对165例次判断与试验药物“有关”的SAE进行药物类别及品种、SAE累及器官分析。不同剂型不同厂家的同一药物按不同药物品种计算。
2 结果
2.1 发生SAE受试者的年龄和性别分布
611例次SAE报告中,发生SAE的男性受试者253例(占SAE总例次的64.87%),女性受试者137例(占SAE总例次的35.13%),发生SAE受试者中男女比例为1.8∶1,发生SAE受试者平均年龄(57.95±10.42)岁,最大年龄82岁,最小年龄20岁(见表1)。
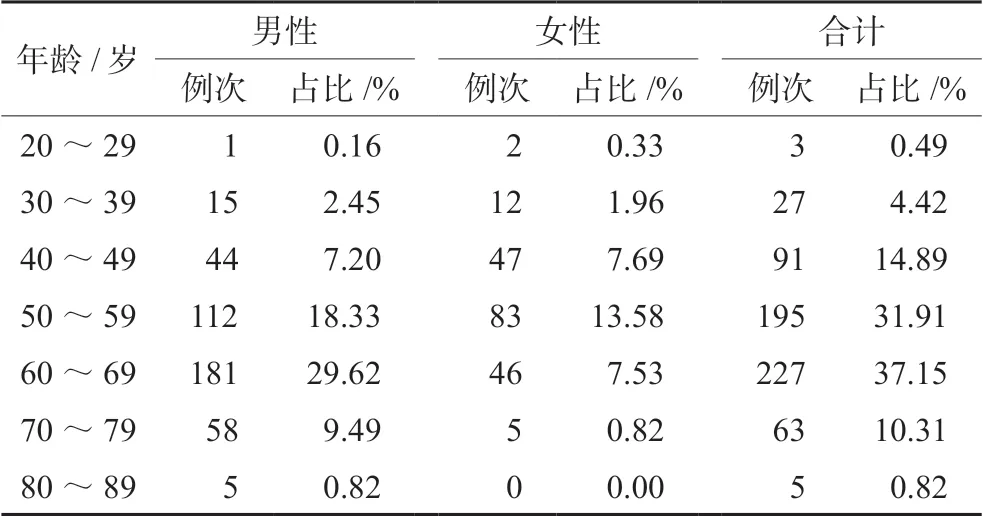
表1 611例次SAE受试者性别和年龄分布
2.2 SAE在不同疾病类别中的分布
611例次SAE的受试者涉及17个类别,其中排名前3的癌种分别是肺癌(占47.30%)、肝癌(占11.95%)、乳腺癌(占6.55%),见表2。
2.3 SAE在合并疾病/治疗情况中的分布
611例次SAE中,发生SAE受试者合并疾病/治疗者423例次(占69.23%),未合并疾病/治疗者188例次(占30.77%)。
2.4 SAE与试验药物因果关系分布情况
611例次SAE中,SAE与试验药物因果关系判断为“有关”的SAE 165例次(占27.00%),判断为“无关”的SAE 446例次(占73.00%),详见表3。
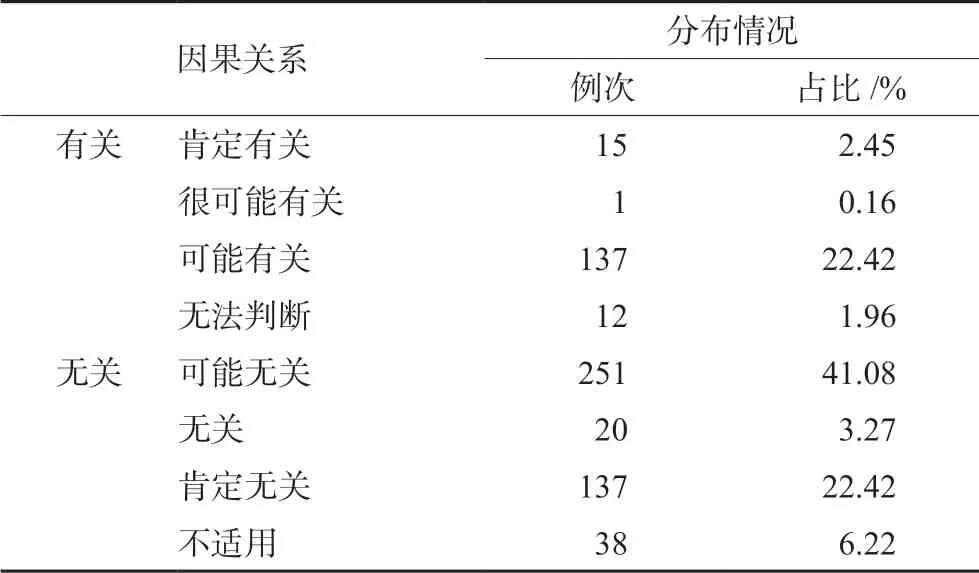
表3 SAE与试验药物因果关系判断结果分布情况
2.5 与试验有关SAE的药物类别及累及器官分析
研究者判断与试验药物因果为“有关”的165例次SAE,涉及44个药物品种,2个药物类别:一类为抗肿瘤药物,共计药物品种43个;另一类为非抗肿瘤药物,共计药物品种1个。将43个抗肿瘤药物品种进一步归纳汇总为4个药物类别,见表4。165例次SAE累及多个系统/器官,其中消化系统损害最多见(累计50例次),见表5。
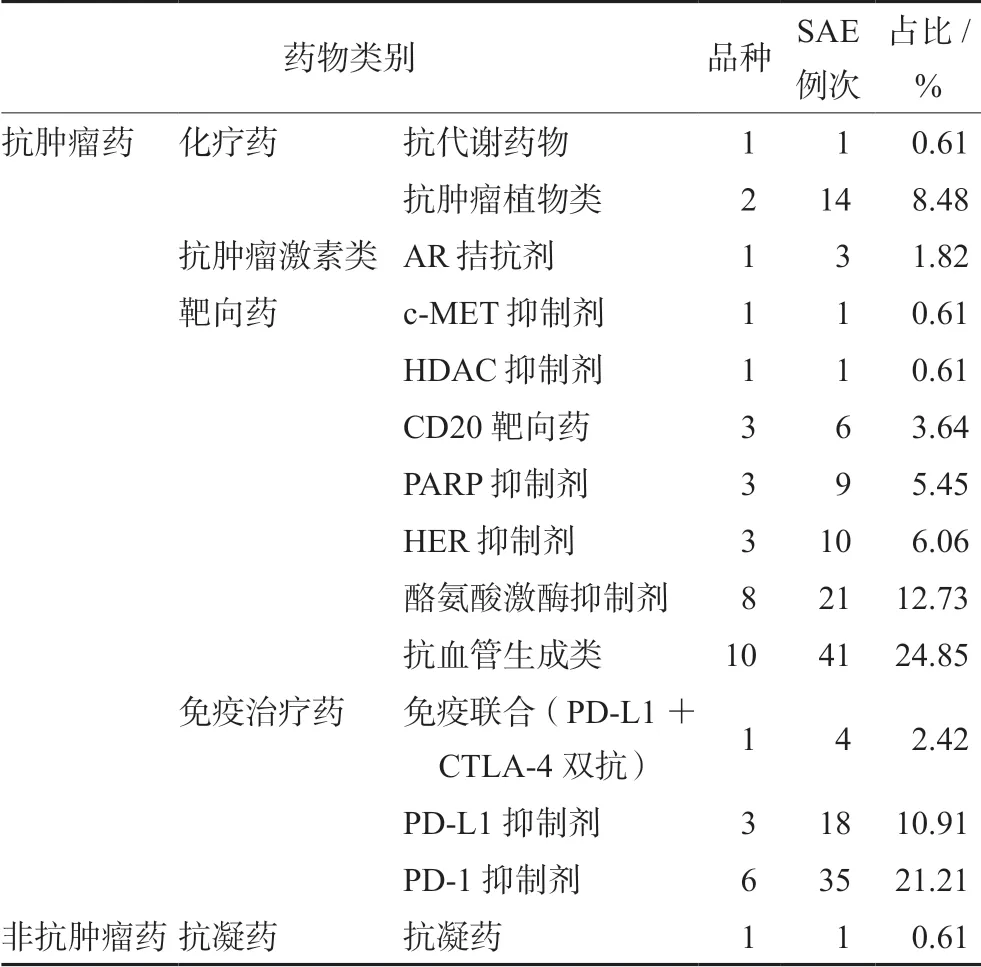
表4 165例次SAE在药物类别及品种分布
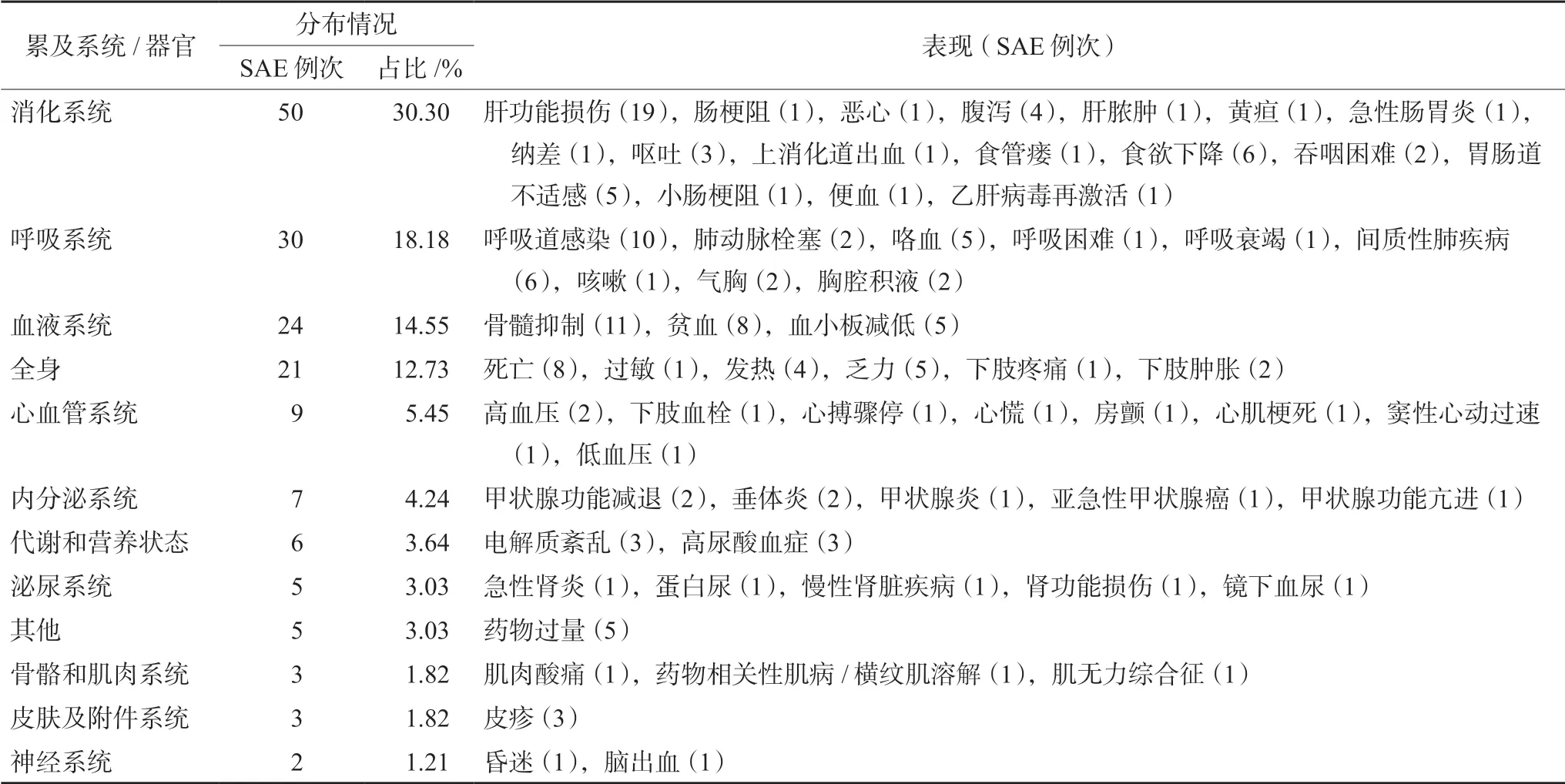
表5 165例次SAE累及系统/器官分布
3 讨论
3.1 611例次SAE发生的主要分布特征
GLOBOCAN预估从2025年起,每年将有2000万癌症新发病例,可见抗肿瘤药物仍是新药研发的热点领域[5]。2015年一份中国癌症流行病学报告显示,2015年癌症在男性中的发病率高于女性,最常见的包括肺癌、胃癌、结直肠癌、肝癌和女性乳腺癌[6]。本研究数据显示,抗肿瘤新药临床试验中发生SAE的受试者男性多于女性,发生SAE的受试者平均年龄为(57.95±10.42)岁,肺癌、肝癌与乳腺癌是该院发生SAE受试者的三大主要瘤种。
此外,本研究中自身合并其他疾病/治疗的受试者发生SAE例次占SAE总例次的69.23%,分析可能原因在于癌症的发生发展是多因素综合作用的结果,且发生SAE的受试者多数为老年人,50岁以上的受试者占总发生SAE受试者的80.19%,而老年患者具有肝肾功能退化严重,对药物代谢能力明显减弱,自身合并疾病多的特点,易导致药物在体内堆积,进而发生SAE[7]。例如该院肺癌药物临床试验中受试者基本上为高龄癌症晚期患者,具有器官功能老化,且自身合并多种老年性疾病等特点[8],导致SAE发生例次在总SAE中占比较高。
3.2 SAE对受试者安全的预警作用
受试者发生SAE时,研究者应始终将受试者安全作为首要目标,并对受试者的病情变化、SAE与试验药物相关性判断等进行公正判定和积极救治[9-10]。目前SAE与试验药物因果关系判断的方法尚无通用标准[11-13]。本研究中研究者判断SAE与试验药物可能无关的SAE占比最高(41.08%),其次为可能有关(22.42%)和肯定无关(22.42%)。“可能无关”即确定SAE的出现与用药无合理时间关系,且非该药的已知不良反应类型,但不能完全排除与试验的因果关系[14]。可见,该研究中心研究者对SAE相关性判断始终保持谨慎态度,以充分保障受试者权益。
2020新版《药物临床试验质量管理规范》进一步优化了安全性事件报告,要求研究者和申办方及时向伦理委员会报告可疑且非预期严重不良反应[3]。“可疑”则意味着不能排除SAE与试验药物的因果关系,因此,作者进一步从药物作用类别及累及系统/器官两方面,针对165例次SAE进行了深入分析。
傅志英等[15]对抗肿瘤药物临床试验134例死亡SAE进行质量管理分析,发现死亡病例主要来源于消化肿瘤内科,与本研究结果一致。本研究中165例次SAE主要累及消化系统,肝功能损害尤为常见,可能存在以下几个原因:首先,血液学检查是临床试验方案中常规的安全监测方法,而这其中就包括肝功能检查,导致消化系统不良反应较容易发现;再者,大多数抗肿瘤靶向药物为口服制剂,对胃肠道的影响最为直接;最后,消化道反应乃化疗药物的常见不良反应。因此,临床试验研究者应警惕预防受试者用药过程中的消化道等系统出现与试验药物有关的不良反应。
一项癌症患者分子靶向抗癌药物严重不良事件和致命不良事件(fatal adverse event,FAE)的meta分析结果显示,分子靶向抗癌药物可显著增加SAE和FAE的风险,SAEs和FAEs的风险分别增加57%和51%[16]。本研究165例次SAE中,有1例次SAE发生于某抗凝药的健康受试者生物等效性临床试验中,剩余164例次为抗肿瘤药物的SAE,靶向药物发生的与试验药物有关的SAE最多(占该院所有与试验药物有关SAE的53.95%),尤其是抗血管生成药物(占该院所有与试验药物有关SAE的24.85%);其次是免疫治疗药物(占该院所有与试验药物有关SAE的34.54%)。笔者分析可能原因有两个方面:一方面,该院开展的药物临床试验中,靶向抗肿瘤药物品种数最多,其中抗血管生成药物品种就有10个;另一方面,根据NCCN(The National Comprehensive Cancer Network)指南及国内CSCO(Chinese Society of Clinical Oncology)指南,单用抗血管生成药物一般不作为癌症患者的一线用药选择,常需联合治疗,常见为联合免疫治疗[17-18],抑或单用抗血管生成药物进行二线或三线及以上的抗肿瘤治疗。本研究中,抗血管生成药物临床试验入组对象多为一线治疗失败后的癌症患者,这一类用药患者基础条件较差,导致发生SAE例次较高。
本研究共有8例与试验药物有关的死亡SAE,受试者均参加靶向治疗药物临床试验,化学药品与生物制剂比例为1∶1,而傅志英等[15]研究显示,化学药品发生死亡SAE有关率比生物制剂的高(65.4%vs52.8%),这可能与本研究发生死亡SAE受试者病例数少有关。8例死亡SAE中,有5例受试者参加的是抗血管生成药物临床试验,因抗血管生成药贝伐珠单抗治疗会增加动脉不良事件的风险,尤其是心脏和脑缺血、静脉不良事件、出血和动脉高血压[19],推测此5例受试者死亡原因可能与患者基线情况差,抗血管生成治疗过程中心血管病变相关。因此,抗血管生成药物临床试验中研究者应高度关注受试者安全,尤其是心脑血管病变风险。
近年来免疫治疗在癌症治疗中的应用日益广泛,彻底改变了肿瘤的诊断及治疗策略。然而,临床上免疫靶向治疗的益处经常被高估,风险和安全性容易被忽略[16]。免疫治疗在抑制肿瘤免疫逃逸的同时,可干扰人体正常的免疫耐受机制,在正常组织中引发免疫激活,导致各种类型的免疫相关不良事件[20]。Marin-Acevedo等[21]报道,免疫治疗中任何器官都可能受到影响,包括肝、肺、肾和心脏,而皮肤、胃肠道、内分泌和肺部是最常见的受累部位。本研究共统计57例次与免疫治疗药物有关的SAE,其中排名前三的主要累及系统为消化系统(19例次)、呼吸系统(11例次)、内分泌系统(7例次),与文献报道[21]基本一致。虽然抗血管生成药及免疫检查点抑制剂为目前常见的抗肿瘤治疗药物,但其引发的与试验药物有关的严重不良反应仍不容忽视,尤其是免疫治疗药物引发的消化系统损害,研究者应在临床决策过程中精准识别、提前预防、积极治疗与之相关的SAE,正确判断靶向治疗的风险与获益,将受试者风险控制在最小范围内。
4 结语
药物安全性评价贯穿于整个临床试验的实施过程中,研究者应更多关注受试者的年龄、病种、受试者自身合并的其他疾病或治疗等基础条件,以及所参加新药临床试验的特点,同时重点关注不同药物类别SAE的常见累及器官/系统,提前预警,减少SAE的发生,进一步保障受试者用药安全。
