重症卒中并发阵发性交感神经过度兴奋1例并文献复习
2021-07-03曾文晶霍康陈晨刘福德宋文峰周青青韩建峰罗国刚屈秋民第一作者
曾文晶,霍康,陈晨,刘福德,宋文峰,周青青,韩建峰,罗国刚,屈秋民(*第一作者)
1 病例介绍
患者男性,35岁,以“左侧肢体麻木无力6小时”之主诉于2020年8月11日入院。6 h前自觉左手持物无力,左下肢无力,后逐渐出现烦躁、言语不利、意识障碍,病情进行性加重,遂就诊于我院。急诊行头颅CT提示右侧颞顶叶脑沟脑回边界欠清晰,提示脑水肿(图1A),考虑大血管闭塞,立即准备急诊介入取栓手术。
入院时神经系统查体:GCS 9分(E2V2M5),NIHSS 29分,压眶刺激后右侧肢体有自发活动,左侧瞳孔直径3.0 mm,右侧3.5 mm,双侧瞳孔对光反射灵敏,左侧肢体坠落试验阳性,左侧Babinski征阳性。
既往史:高血压病史2年,最高达150/100 mm Hg,间断服用降压药,控制尚可。吸烟史20年,平均30支/天,无戒烟;有饮酒史10余年,几乎每日饮酒,100~250 g/d。
诊疗经过:入院后立即进入卒中绿色通道,急诊行全脑血管DSA造影示:右侧颈内动脉末端闭塞及右侧大脑中动脉闭塞。取Solitaire取栓支架及抽吸导管到位。反复抽吸及开通支架拉栓后,前向血流恢复不佳(图1B),考虑操作时间过长,决定终止手术,气管插管状态转入ICU。当日晚患者烦躁明显,意识障碍加重(GCS得分变化9分→7分)。术后24 h复查头颅CT提示右侧额颞顶叶大面积不规则低密度影,伴随中线移位,右侧半球病灶内可见高信号影,考虑为造影剂残留(图1C)。遂于8月17日转入神经外科行右侧额颞顶去骨瓣减压术,术后患者意识障碍有好转,昏睡状,GCS 10分(E2V3M5),NIHSS 20分,术后复查CT提示右侧额颞顶叶大面积脑梗死,范围较前增大(图1D)。
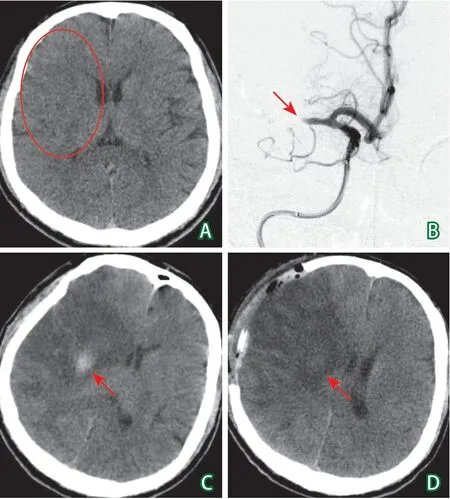
图1 患者入院后头颅CT检查
开颅术后第3天患者体温升高,给予万古霉素抗感染后体温下降。术后第10天患者开始反复出现发作性心率增快,血压升高,面色潮红,伴随全身大汗,心率最高可达140次/分,血压最高可达153/123 mm Hg(图2A)。2周后反复出现发作性上肢违拗,伴肌张力亢进(图2B~C),每日发作十余次,多在吸痰、翻身拍背等护理操作时诱发。发作时同步视频脑电图监控上未见异常放电或痫性发作脑电波。先后给予丙戊酸、左乙拉西坦等抗癫痫药物,效果不佳,肌张力亢进症状仍有发作。行阵发性交感神经过度兴奋(paroxysmal sympathetic hyperactivity,PSH)综合征PSH评估量表(PSH assessment measure,PSH-AM)评分为22分,考虑PSH,治疗上尽量减少吸痰、翻身等诱发因素,减少交感神经的兴奋,并注意营养支持、维持内环境稳定等综合治疗。给予α受体激动剂右美托咪定、γ-氨基丁酸(γ-aminobutyric acid,GABA)受体激动剂咪达唑仑微量泵静脉滴注,GABA-B型受体激动剂巴氯芬10 mg 3次/日,GABA衍生物加巴喷丁300 mg 3次/日,非选择性β阻断剂普萘洛尔10 mg 2次/日鼻饲,逐渐加量后患者症状好转,发作性体温升高、心率增快、血压升高、大汗、阵发性肌张力增高的频率明显减少(图3)。术后第21天逐渐减量右美托咪定、咪达唑仑,继续维持巴氯芬、加巴喷丁及普萘洛尔使用,术后第25天后基本无PSH发生,停用右美托咪定及咪达唑仑,减量巴氯芬、加巴喷丁、普萘洛尔,术后第30天停用巴氯芬、加巴喷丁及普萘洛尔,术后第33天患者出院。
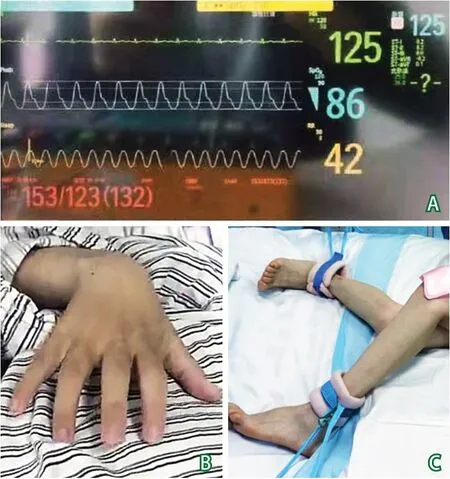
图2 PSH发作时期生命体征及肌张力情况
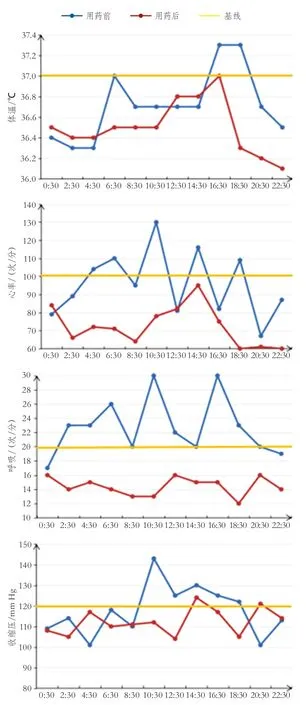
图3 患者用药前后体温、心率、呼吸和血压变化
最终诊断:
脑梗死(右侧颈内动脉远端
及大脑中动脉闭塞)
去骨瓣减压术后
阵发性交感神经过度兴奋
高血压病(3级,很高危)
高脂血症
肺部感染
2 讨论
PSH是一种以交感神经兴奋性增强为特征表现的临床综合征,好发于中重度脑损伤患者,表现为心动过速、血压升高、呼吸急促、发热、大汗及姿势异常或肌张力障碍。早在1929年就曾被报道,命名为间脑癫痫[1]。PSH综合征其他的命名包括:“自主神经异常”“自主神经风暴”“交感神经风暴”“自主神经癫痫”“下丘脑风暴”等[2-5]。
PSH的发病率为8%~33%,病因多样,约80%的患者继发于颅脑外伤[2],10%的患者继发于缺氧后脑损伤,脑积水、肿瘤、低血糖、感染等也是PSH的诱因[6]。重症卒中后继发PSH报道罕见。目前关于PSH有三种病理生理机制假说:①脑网络分离理论:大脑皮层抑制中心(如脑岛和扣带皮层)与参与交感神经调节的下丘脑、间脑和脑干中心之间连接断开[6-8]。②交感神经去抑制理论:脑干和间脑中存在脊髓传入的抑制中枢,当此抑制解除时,轻微刺激即可引起痛觉过度活化,引起交感神经过度兴奋[8-9]。脑损伤发生后轻微刺激即可驱动正反馈诱发PSH。护理措施如吸痰、翻身、洗澡,生理疼痛性刺激如便秘、疼痛、尿潴留等均可诱发PSH。③神经递质失调理论:PSH患者外周血中发现儿茶酚胺升高,提示中枢神经递质的改变参与了PSH的发病,神经递质异常可能导致了患者对无害或有害刺激产生过度反应[10]。
PSH容易出现漏诊。因PSH的非特异性症状,其诊断多采用排除法,需与癫痫、颅高压、脑积水、躁动、疼痛、中枢性发热、恶性高热、麻醉复苏、戒断综合征等疾病鉴别。PSH常被误诊为癫痫发作,而抗癫痫治疗无效,脑电图视频录像检测可发现患者发作时均无癫痫波。成人PSH典型临床表现为突发肌张力增高或姿势异常,突然增加的心率、呼吸频率、血压,体温升高及大汗。儿科PSH核心症状包括高血压、发汗、肌张力障碍等,具有预测意义。
该患者为脑梗死去骨瓣减压术后阵发性心率增快、血压升高、大汗、呼吸频率增快、肌张力增高,机体能量消耗增加,水电解质代谢紊乱,可能导致心功能异常,加重脑水肿,造成脑组织缺血缺氧加重,引起颅内压升高。患者脑电图检测未见异常放电或痫性脑电波,PSHAM评分21分,基本明确诊断。推测此患者可能的发病机制包括:①大脑中皮层抑制中心岛叶出现脑梗死,交感兴奋中心(下丘脑、间脑和脑干中心)出现功能损伤,造成皮层交感抑制中心与交感兴奋中心功能调节失衡。②患者病情危重,严重颅脑损伤后引起下丘脑功能障碍,大量儿茶酚胺和肾上腺素释放入血,引起神经源性水肿,诱发机体对刺激的过度反应。
为了解决PSH命名法的混乱,2014年国际社会达成共识,制定了PSH诊断标准,开发了诊断工具,将“paroxysmal sympathetic hyperactivity”作为命名,定义为:严重获得性脑损伤幸存者,同时发生短暂性交感神经兴奋症状(心率、血压、呼吸频率、体温、出汗)和运动(姿势)活动增加的综合征[11],并在16项特征[12]中选择了11项作为PSH的特征(表1),同时提出了一个PSH临床评分系统——PSHAM,以保证诊断的一致性。PSH-AM包括两部分:一是临床特征量表(clinical feature scale,CFS),用于评估肾上腺素能和运动活动过度的存在和严重程度;二是诊断可能性工具(diagnosis likelihood tool,DLT),用于评估PSH存在的可能性。CFS中的6项根据严重程度分别赋分,DLT中的11项各赋分值1分。将DLT和CFS的分数相加,<8分为不可能,8~16分为可能,≥17分为很可能。PSH-AM使PSH的诊断可量化,更加客观和准确。
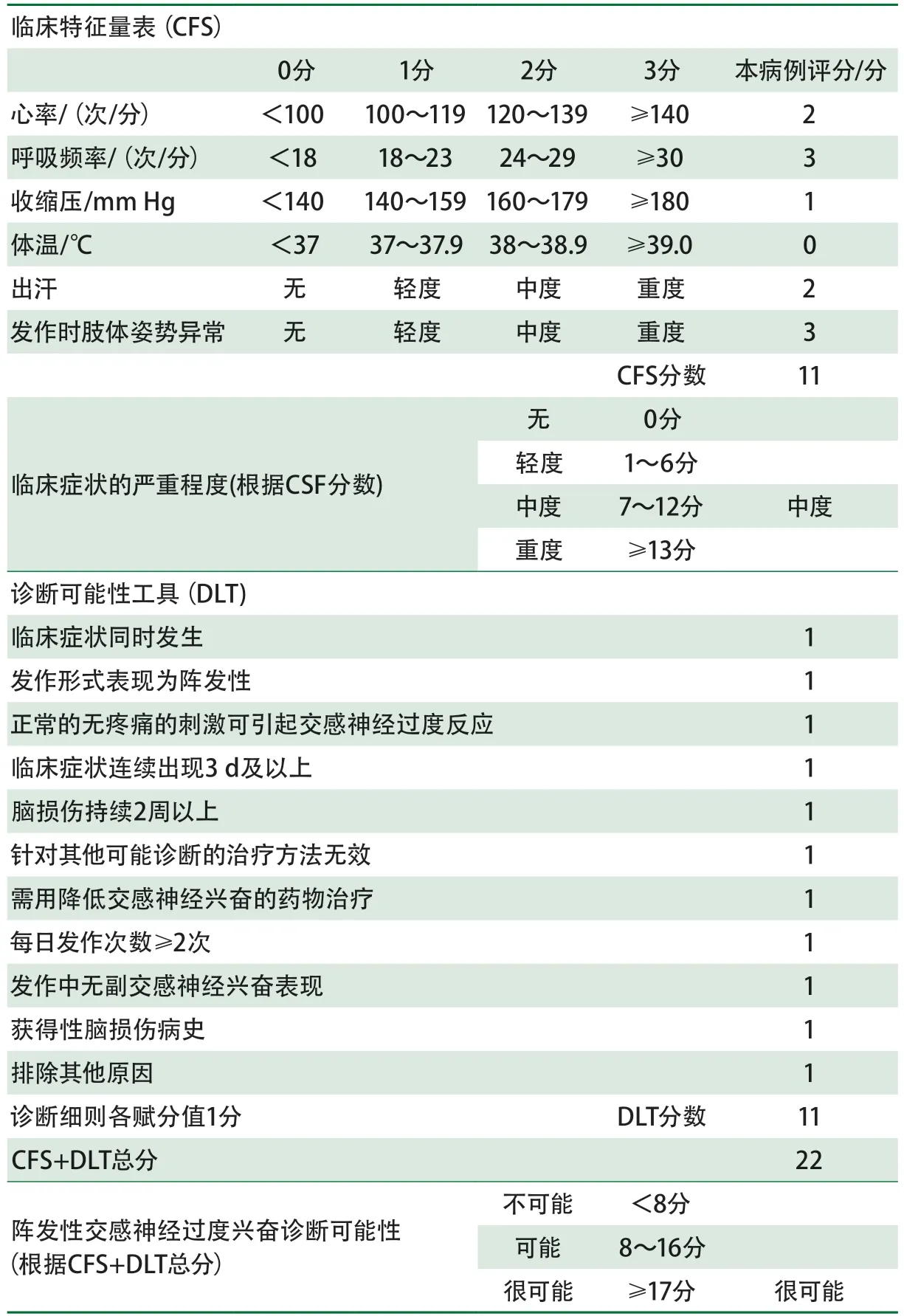
表1 阵发性交感神经过度兴奋临床评估量表
关于PSH的治疗,临床采用综合治疗措施。治疗PSH的主要目的是:避免触发疾病,减轻过度的中枢交感神经传出,以及通过支持治疗解决PSH对其他器官系统的影响。PSH治疗药物主要包括:①阿片类药物,尤其是吗啡,可能是最常用的治疗PSH的一线药物,吗啡可能通过调节PSH阵发的中枢通路而产生非镇痛性作用[13]。②苯二氮类如咪达唑仑、地西泮,除具有抗镇静、安眠、抗焦虑、抗惊厥,还有肌肉松弛作用,也作为一线药物用于PSH治疗。③α2-肾上腺素能受体激动剂通过作用于脑干α2-肾上腺素能受体,使交感神经从中枢传出减少,导致心率、血压、血液中儿茶酚胺降低。常用药物如可乐定,但其在控制体温方面疗效不明显,可能不适于阵发性症状,因其可能加剧症状阵发之间的低血压和心动过缓,使可乐定的滴定具有挑战性。而可乐定贴片可有效控制交感神经发作风暴[14]。有报道右美托咪啶在ICU治疗PSH有效[15]。④非选择性β肾上腺素能受体阻滞剂也作为治疗PSH的一线药物。普萘洛尔可能是最常用的β受体阻滞剂,具有亲脂性,可穿透血脑屏障在中枢发挥作用。心脏选择性β受体阻滞剂,如美托洛尔,效果可能较差,联合α和β肾上腺素能受体阻滞剂可能更适于控制阵发性症状发作[16]。⑤抑制性神经递质GABA类似物加巴喷丁常用于治疗神经性疼痛,对脊髓背角突触前电压门控性钙通道有明显作用,常用于对美托洛尔/溴隐亭无反应的PSH[17]。巴氯芬,一种GABA-B型受体激动剂[7,14],可能通过激活GABA-B型受体,产生骨骼肌松弛作用,可用于难治性PSH。⑥其他控制交感神经发作的调节剂包括多巴胺D2受体激动剂溴隐亭,其在降体温和出汗方面有不同的效果。
PSH发生后虽然不直接影响原发疾病死亡率,但PSH症状继发出现的脑损害、肌张力障碍和姿势异常等不良事件会增加患者的平均住院天数,加重医疗负担等。因此,需要重视PSH的早期诊断和治疗,为患者的救治争取更多的机会,改善患者预后,减少疾病负担。
