转化生长因子-β1 受体依赖的心肌纤维化伴随大电导钙激活钾通道的表达和功能下调
2021-07-02李磊董亚辉杨探李秋芳聂永梅李光于风旭
李磊,董亚辉,杨探,李秋芳,聂永梅,李光,于风旭
心肌成纤维细胞约占非心肌细胞90%以上,在维持心脏结构和功能中起重要作用。有研究表明,心肌微血管密度下降可能导致心肌纤维化加重[1]。此外,当某些刺激因素比如转化生长因子-β1(TGF-β1)、血管紧张素Ⅱ(Ang Ⅱ)等刺激心肌成纤维细胞后,心肌成纤维细胞发生表型转换为肌成纤维细胞,后者可大量合成Ⅰ型胶原(Collagen Ⅰ)、Ⅲ型胶原(Collagen Ⅲ)等细胞外基质[2]。大量胶原致过度沉积及异常分布将导致心脏间质重构,进而引起心肌纤维化。
大电导钙激活钾通道(big conductance Ca2+-activated K+channel,BKCa)是钾通道中重要成员之一,不仅对细胞内Ca2+浓度具有敏感性,对电压也具有敏感特性[3]。大量研究表明,BKCa 的开放、关闭以及突变与多种疾病的发病机制有关[4-5]。Ha 等[6]发现硫化氢(H2S)可下调人心房成纤维细胞上BKCa的表达从而抑制心肌纤维化的进展,表明BKCa 可能参与心肌纤维化过程。
TGF-β1 是目前已知最强的促进纤维化的细胞因子之一[7]。有多篇文献报道,TGF-β1 是心肌纤维化过程中的关键因子[8-10]。而TGF-β1 参与心肌细胞纤维化的机制是否与BKCa 有关目前还不得而知。SB431542 被证明具有抑制TGF-β1 介导的纤维化作用[11-12]。本实验使用SB431542 抑制TGF-β1 信号通路,探索TGF-β1 在促进纤维化过程中与BKCa 可能的关系,以为心肌纤维化的预防和治疗提供思路。
1 材料与方法
实验动物:出生 2~3 d 的乳大鼠,购自西南医科大学动物实验中心。
主要实验试剂:DMEM 高糖培养基(Hyclone 公司,美国),TGF-β1(Bioyknbs 公司,美国),SB431542(Sigma 公司,美国),超纯RNA 提取试剂盒(康为世纪公司,中国),逆转录试剂盒(东洋坊公司,日本),实时荧光定量PCR(qRT-PCR)试剂盒(Qiagen 公司,德国),BKCa 抗体(Abcam公司,美国),α-平滑肌肌动蛋白(α-SMA)抗体(Abcam 公司,美国),Collagen Ⅰ抗体(Abcam公司,美国),Collagen Ⅲ(Abcam 公司,美国),TGF-β1 受体抗体(Abcam 公司,美国),蛋白裂解缓冲液(碧云天公司,中国),DAB 显色试剂盒(迈新公司,中国)。
乳大鼠心室成纤维细胞的培养、传代:将2~3 d乳大鼠开胸取心脏,将心室剪碎、消化后收集细胞,以差速贴壁法培养成为成纤维细胞,传至1 代后制成细胞悬液,将细胞悬液接种到6 孔板,放置于37℃、5%CO2培养箱中培养,用于后续实验。
qRT-PCR :根据实时PCR 引物设计原则设计引物,引物序列见表1。细胞总RNA 提取及反转录参照逆转录试剂盒说明书进行,所提RNA -80℃保存备用。采用紫外分光光度计检测RNA 纯度合格后逆转录为互补DNA(cDNA),cDNA 置于-80℃冰箱保存。按照qRT-PCR 试剂盒说明书进行扩增,反应条件为:95℃,2 min;95℃,15 s;57℃,30 s;循环 40 次。添加溶解曲线以验证目的基因扩增特异性:95℃,15 s;60℃,15 s;95℃,15 s。采用 2-△△CT值的方法分析目的基因的表达水平。

表1 引物序列及产物长度
单通道及全细胞膜片钳记录 BKCa 电流:单通道记录:钳制电压为-80 mV,刺激电压为-60 mV。每隔1 s 刺激并记录一次,采样频率为10 kH,滤波为2 kH。电极电阻为3~5 mΩ。用Clampfit 软件分析BKCa 电流幅值、开放概率、开放时间及关闭时间。全细胞记录:钳制电压为-80 mV,测试电压从-60 mV去极化到+60 mV,脉冲阶跃为+10 mV,脉冲时程为300 ms。采样频率为10 kH,滤波为2 kH。电极电阻为2~3 mΩ。用Clampfit 软件分析BKCa 电流幅值、电压依赖性、Rmap 电流峰值。
不同TGF-β1 水平对乳大鼠心室成纤维细胞 上α-SMA、Collagen Ⅰ、Collag Ⅲ和BKCa 的mRNA 和蛋白表达水平影响的检测:将乳大鼠心室纤维细胞分为3 组:对照组、TGF-β1 5 ng/ml 组、TGF-β1 10 ng/ml 组。对照组不做处理,TGF-β1组分别给予5 ng/ml,10 ng/ml TGF-β1 处理细胞 24 h后收集细胞。qRT-PCR、蛋白免疫印迹(Western blot)分别检测TGF-β1 处理组和对照组细胞中α-SMA、Collagen Ⅰ、Collagen Ⅲ的mRNA 和 蛋白表达水平,仅检测TGF-β1 10 ng/ml 组BKCa 的mRNA 和蛋白表达水平(经实验组前期进行的药物浓度和时间的筛选确定)。采用目的mRNA 和β-actin 2-△△CT做比值的方法来统计目的mRNA 的表达差异,采用目的蛋白和甘油醛-3-磷酸脱氢酶(GAPDH)灰度值做比值的方法来统计目的蛋白的表达差异。
TGF-β1 及SB431542 对乳大鼠心室成纤维细 胞TGF-β1 受体蛋白,α-SMA、Collagen Ⅰ、Collagen Ⅲ、BKCa 的mRNA 和蛋白表达水平影响的检测:将乳大鼠心室成纤维细胞分为三组:对照组、TGF-β1 组 和TGF-β1+SB431542 组(TGFβ1+SB 组)。对照组不做任何处理,TGF-β1 组加入 10 ng/ml TGF-β1。TGF-β1+SB 组又设置三个浓度梯度:在加入10 ng/ml TGF-β1 基础上又分别加入SB431542 0.1 μmol/L、1 μmol/L、10 μmol/L。处理 24 h 后将以上组别细胞收集,检测TGF-β1 受体蛋白,α-SMA、Collagen I、Collagen Ⅲ、BKCa mRNA 和蛋白的表达水平。
TGF-β1 对乳大鼠心室成纤维细胞上BKCa 电流影响的检测:将乳大鼠心室成纤维细胞分为对照组和TGF-β1 组,对照组不做任何处理,TGF-β1组经前期实验筛查确定加入10 ng/ml TGF-β1 处理24 h,利用单通道膜片钳技术记录 BKCa 电流幅值、开放概率、开放时间及关闭时间。此外,还利用全细胞膜片钳技术记录BKCa 的全细胞电流幅值。
统计学分析方法:采用 SPSS 21.0 软件进行统计分析,数据以均值±标准差表示,两组比较采用独立样本t检验,三组及以上采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 乳大鼠心室成纤维细胞的培养及鉴定
传代后的乳大鼠心室成纤维细胞排列逐渐紧密,相互融合(图1),运用免疫荧光对第一代成纤维细胞进行鉴定,实验组、对照组均加入DAPI 标记细胞核(蓝色)。实验组加入波形蛋白抗体,对照组未加入波形蛋白抗体。结果显示,对照组仅能见到蓝色细胞核(图1A),实验组不仅能看见蓝色细胞核,还能看见绿色呈丝状改变的胞浆,波形蛋白表达阳性(图1B),证明所培养细胞为乳大鼠心室成纤维细胞。

图1 乳大鼠心室第一代心室成纤维细胞免疫荧光鉴定图
2.2 不同TGF-β1 水平对乳大鼠心室成纤维细胞上α-SMA、Collagen Ⅰ、Collag Ⅲ和BKCa 的mRNA和蛋白表达水平的影响
TGF-β1 5 ng/ml 组 和10 ng/ml 组α-SMA、Collagen Ⅰ、Collagen Ⅲ的mRNA 和蛋白表达均明显高于对照组(图2 A~F)。TGF-β1 10 ng/ml 组BKCa 的mRNA 和蛋白表达均明显低于对照组(P均<0.05,图2 G~H)。

图2 TGF-β1 对乳大鼠心室成纤维细胞上α-SMA、Collagen I、Collagen Ⅲ和BKCa 的mRNA 和蛋白表达水平的影响(n>3)
2.3 TGF-β1 及SB431542 对乳大鼠心室成纤维细胞上 TGF-β1 受体蛋白,α-SMA、Collagen I、Collagen Ⅲ、BKCa 的mRNA 和蛋白表达水平的影响
TGF-β1 10 ng/ml 组 的TGF-β1 受体蛋白,α-SMA、Collagen Ⅰ、Collagen Ⅲ 的mRNA 和蛋白的表达与对照组相比明显上调,与TGF-β1 10 ng/ml+SB431542 0.1 μmol/L 组相比无明显差异,与TGF-β1 10 ng/ml+SB431542 1 μmol/L 组,与TGF-β1 10 ng/ml+SB431542 10 μmol/L 组相比均明显上调(P均<0.05,图3 A~G)。

图3 TGF-β1 及TGF-β1 受体阻断剂 SB431542 对乳大鼠心室成纤维细胞上TGF-β1 受体蛋白,α-SMA、Collagen I、Collagen Ⅲ、BKCa 的mRNA 和蛋白表达水平的影响(n>3)
TGF-β1 10 ng/ml组 BKCa 的mRNA和蛋白表达量与对照组相比均明显下调,与10 ng/ml TGF-β1+10 μmol/L SB431542 组相比明显下调(P<0.05,图3 H~I)。
2.4 TGF-β1 对乳大鼠心室成纤维细胞上BKCa 电流的影响(图4)
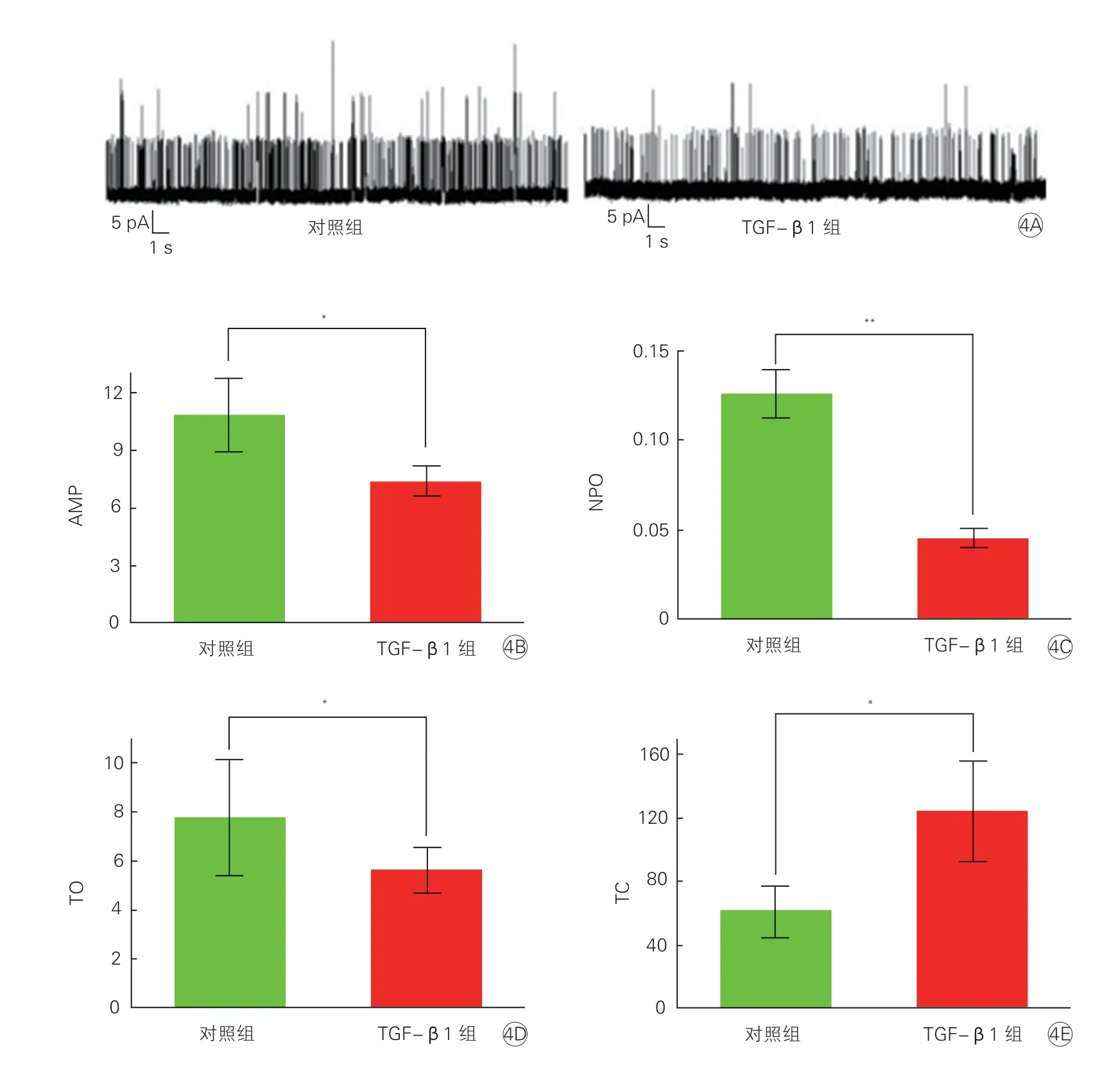
图4 单通道膜片钳记录TGF-β1 对BKCa 电流的影响(n>3)
在+60 mV 钳制电压下,与对照组相比,加入TGF-β1 后,BKCa 电流幅值被抑制,开放概率被抑制,开放时间显著减少,而关闭时间显著延长。全细胞膜片钳记录 TGF-β1 对BKCa 电流的影响结果显示:在-60 mV 至+60 mV 钳制电压下,随着刺激电压的升高,通道电流幅值明显升高,并且TGF-β1 组的电流幅值均低于对照组,表明BKCa具有明显的电压依赖性,并且在TGF-β1 处理后,BKCa 全细胞电流幅值被显著抑制。进一步采用Ramp 电压钳模式记录全细胞电流仍然表明,在TGF-β1 处理后,BKCa 全细胞电流幅值被显著抑制。
3 讨论
心肌成纤维细胞发生表型转换为肌成纤维细胞是心肌纤维化的关键步骤,抑制这一过程是治疗心肌纤维化的关键靶点。
本研究以乳大鼠心室成纤维细胞为研究对象,成功构建纤维化模型,以TGF-β1 和SB431542 为因变量,检测细胞中TGF-β1 受体的蛋白,α-SMA、Collagen Ⅰ、Collagen Ⅲ、BKCa 的mRNA 和蛋白的表达水平。本研究结果显示,TGF-β1 可明显上调心肌成纤维细胞TGF-β1 受体和纤维化指标的表达,同时可抑制 BKCa 的表达,TGF-β1 受体阻断剂 SB431542 可明显下调心肌成纤维细胞TGF-β1受体和纤维化指标的表达,同时可促进BKCa 的表达,此外我们前期的实验发现,过表达心房成纤维细胞的BKCa 可以明显抑制成纤维细胞α-SMA、Collagen Ⅰ、Collagen Ⅲ的表达[13],且 Ang Ⅱ通过抑制成纤维细胞上BKCa 的电流从而促进心肌纤维化进程。因此推测TGF-β1 可能是通过抑制BKCa 电流来参与心肌细胞纤维化的,该过程可能是由TGF-β1 受体介导的,BKCa 可能是Ang Ⅱ与TGF-β1 促进心肌细胞纤维化的共同作用靶点。
在乳腺癌细胞上BKCa 的作用与本研究结果一致[14]。然而,Sheng 等[15]研究发现,H2S 可抑制成纤维细胞的增殖,可能是通过抑制成纤维细胞上BKCa 的表达进而抑制成纤维细胞的增殖。同时,在子宫内膜癌HEC-1-B 细胞[16]、骨髓间充质干细胞[17]上与本研究结果不一致。目前有关BKCa 的激活、失活,对细胞增殖起到增强或抑制作用,尚不完全清楚,这也为未来的研究提供了新的方向。但就目前本研究结果分析,BKCa 参与心肌纤维化的过程,BKCa 和TGF-β1 受体可能成为心肌纤维化的潜在治疗靶点。
利益冲突:所有作者均声明不存在利益冲突
