活血接骨方对骨髓间充质干细胞成骨分化中Wnt信号通路及Sclerostin基因的影响*
2021-07-02俞云飞王建伟
俞云飞,王建伟,冯 骅,尹 恒,华 臻,吴 毛
(无锡市中医医院骨科 无锡 214000)
1 引文
骨折作为以骨小梁损伤断裂为病理特征的临床疾病,骨折愈合是指骨折处连续性组织修复,而骨组织的修复重建涉及多种组织和细胞参与,其中干细胞来源的骨组织重建是骨折修复的重要组成部分,骨髓则是干细胞的主要来源。骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)也称骨髓基质干细胞(bone marrow stromal cell,MSC)是骨髓内存在的一类非造血干细胞,当机体发生骨折时,在局部微环境的诱导刺激下,向骨折处聚集、迁移,诱导并分化成为成骨细胞参与骨组织修复与重建。现代研究表明[1],BMSCs可以在多种生物信号因子及信号通路的调控下参与骨代谢过程。骨形态发生蛋白(BMP)属于转化生长因子β(TGF-β)超家族,包括BMP-2、BMP-3、BMP-4、BMP-5、BMP-6、BMP-9等具有骨诱导活性的生物因子,被证实可以通过Smad、Wnt等骨代谢相关信号通路参与调控BMSCs介导的骨修复过程[2]。
Sclerostin也称骨硬化蛋白/硬骨素,作为骨细胞和软骨细胞特异性表达的分泌性蛋白,早期研究中被当做BMP抑制剂,通过调节Smad信号通路参与骨代谢形成过程。近期研究表明[3],Sclerostin主要通过阻碍Wnt信号通路激活,而非既往认为的抑制Smad通路调控骨代谢过程。国外有学者发现[4],Sclerostin基因敲除小鼠中骨量明显增加,而过表达小鼠出现骨量减少、成骨细胞数量减少等趋势。在对BMSCs细胞的相关研究中发现[5],Sclerostin不仅可以抑制BMSCs的成骨分化过程,还可以减弱BMSCs细胞增殖活性及钙化作用,对骨形成起负性调控作用。目前已证实,经典Wnt信号通路是调节BMSCs成骨分化的重要途径,该途径的激活可促进成骨细胞分化与细胞矿化现象发生。
“刘氏骨伤”作为无锡市非物质文化遗产,主张以中医手法为主、内服外敷为辅,要求内外兼治、动静结合[6]。多年来经多代传人总结、完善形成的我科经验方—活血接骨方,临床验证具有良好的治疗效果[7-9],但其中的作用机制仍不十分明确。祖国医学一般将其归属到“骨折病”范畴,并且与瘀血关系密切[10]。有研究表明[11,12],活血接骨类中药汤剂可以通过拮抗环氧化酶2(COX-2)抑制剂,促进上调BMP-2及骨钙素(OC)基因表达并增强成骨细胞活性,从而参与并促进骨折早期愈合过程。“续骨活血汤”作为中医传承经验方,主要功效活血祛瘀,止痛续骨,在治疗促进骨折愈合取得良好的临床疗效。我们前期研究发现,通过siRNA抑制Sclerostin基因可以促进BMSCs体外成骨分化过程[13]。在此基础上,本研究依托无锡市科教强卫项目(编号:ZDRC025),以BMSCs为研究对象,设计完整实验,探究在成骨诱导条件下,活血接骨方对BMSCs体外成骨分化过程中Sclerostin基因及Wnt信号通路的影响,揭示活血接骨方促进骨折愈合的可能作用机制。
2 材料与方法
主要试剂和仪器:DMEM(Hyclone,美国);胎牛血清(GlBICO,美国);胰蛋白酶(Sigma,美国);CCK-8试剂盒(Abcam,美国)、茜素红(Sigma,美国);总蛋白提取试剂盒(上海碧云天公司,中国);一抗:Col1A2(货号ab96723,稀释比例1∶500)、OC(货号ab13420,稀释比例1∶500)、OPN(货号ab8448,稀释比例1∶1000)、Sclerostin(货号ab63097,稀释比例1∶1000)、Wnt5a(货号ab72583,稀释比例1∶1000)、GSK-3β(货号ab227208,稀释比例1∶500)、P-GSK-3β(货号ab75745,稀释比例1∶500)及GAPDH(货号ab9485,稀释比例1∶2500)均为美国Abcam公司产品。二抗:山羊抗兔抗体(货号7074,稀释比例1∶2500)和马抗小鼠抗体(货号7076,稀释比例1∶2500)为美国CST公司产品;NanoDrop 2000(Thermo&Scintific,美国);细胞计数仪和Trizol(Invitrogen,美国);实时PCR试剂盒(TOYOBO,中国);实时PCR仪(RocheLightCycler480,德国);PCR反应体系和反转录试剂盒(Fermentas,美国);SDSPAGE凝胶配制试剂盒和ECL发光液(上海碧云天公司,中国)。
2.1 活血接骨方含药血清制备
活血接骨方组成:主要成分包括地鳖虫、血竭、川芎、川断、乳香、没药、白术、丁香、杜仲、骨碎补、党参、当归、黄芪、自然铜、熟地、苏木等药物组成等。无锡市中医医院药剂室制备,使用0.9%氯化钠配置成终浓度为0.45 g·mL-1生药,再经过瓶装、封盖、灭活,置于4℃冰箱保存。取与中药汤剂相同剂量的0.9%氯化钠溶液配置成对照溶液。
活血接骨方含药血清制备:取体重为200-250 g SD大鼠10只,依据《药理试验中动物间和动物与人体间的等效剂量换算》计算实际大鼠灌药剂量,空白血清组给予等量生理盐水。每天于8点、20点分别灌服中药或生理盐水1次,连续7天,第7天上午8点灌注全天量,灌服后1 h后于下腹主动脉采血,经静置、离心、灭活补体、过滤除菌等步骤制得,分装并标记含中药血清和空白血清,放置于-20℃保存备用。
2.2 BMSCs分离与培养
分离:取体质量100-150 g SD大鼠,采取颈断法处死后75%乙醇浸泡消毒,剥离并折断胫骨及股骨,用含双抗PBS液(终浓度为青霉素100 U·mL-1和链霉100μg·mL-1)冲洗出骨髓细胞,离心去上清液、PBS重悬,细胞计数。
培养:按1×105个·cm-2密度将细胞均匀接种于MGM培养基,加入10%FBS、1%双抗,37℃、5%CO2环境的恒温箱中培养,3天换液1次,继续培养7天后收集细胞,取部分用于实验,部分液氮冷藏保存。
2.3 BMSCs成骨分化诱导
将BMSCs按1×105个·cm-2密度接种于6孔板中,使用含MGM培养基的成骨诱导液(100 nmol·L-1地塞米松、10 mmol·L-1β-甘油磷酸钠、50 mg·L-1抗坏血酸)培养24 h后进行试验。依据干预培养条件分为4组:对照组(含10%空白大鼠血清)、中药组(10%含药大鼠血清)、BMP-4组(含0.1 ug·mL-1BMP-4),中药+BMP-4组(10%含药大鼠血清+0.1 ug·mL-1BMP-4),3天换液1次,共培养28天。采用CCK-8检测细胞活性;采用实时荧光PCR和Western Blot检测成骨分化相关分子(Col1A2、OC、OPN)及Sclerostin基因的mRNA和蛋白水平表达情况;采用ALP和茜素红染色检测细胞矿化程度。
2.4 中药含药血清对Wnt信号通路的浓度依赖性研究
将BMSCs按1×105个·cm-2密度接种于六孔板培养皿,依据培养血清浓度分4组:空白对照组(含10%空白大鼠血清)、低浓度组(5%含药血清)、中浓度组(10%含药血清)、高浓度组(含20%含药血清),最终使用空白大鼠血清调配使各组最终大鼠血清终浓度为20%,3天换液1次,共培养7天。采用CCK-8检测细胞活性;采用实时荧光PCR和Western Blot检测Sclerostin基因和Wnt信号通路相关分子(Wnt5a、GSK-3β)的mRNA和蛋白水平表达情况。
2.5 主要检测技术与方法
DNA含量分析:依照CyQUANT细胞增殖检测试剂盒操作步骤(购自Invitrogen公司)进行实验,其中激发波长为450 nm,发射波长为530 nm。
CCK-8法:依照CCK-8试剂盒操作步骤(购自Abcam公司)进行实验,使用酶联免疫检测仪OD 450 nm处测量各孔的吸光值并计算。
实时荧光PCR法:收集细胞样品,抽取总RNA,以2μg反转20μL体系进行反转录。检测Sclerostin、Col1A2、OC、OPN、Wnt5a、GSK-3β的mRNA表达。将反转的cDNA稀释5倍,进行实时PCR。扩增体系为10μL,反应条件:95℃预变性30 s;95℃5 s、60℃25 s,扩增50个循环。溶解曲线分析:95℃5 s;溶解曲线为单一峰说明是特异性扩增,阴性对照为ddH2O,GAPDH为内参,每个模板做3个复孔,结果使用相对定量2-△△Ct方法分析。引物序列详见表1。

表1 实时聚合酶链反应引物序列
Western Blot法:收集细胞样品,PBS清洗2次,按100∶1加入蛋白提取缓冲液RIPA(radioimmunoprepciption assay)和蛋白酶抑制剂PMSF(phenylmethanesulfonyl fluoride)提取蛋白,置于冰上30 min后,4°C 12000 rpm离心10 min,吸除上清,4℃备用,置于-20℃长期保存。BCA法检测蛋白浓度,SDS-PAGE电泳,用0.22μm孔径的PVDF膜转膜,5%BSA封闭1 h,4°C一抗孵育过夜后使用0.05%TBST充分洗涤;孵育二抗,常规ECL发光液显色。
ALP染色、活性分析与茜素红染色:在成骨诱导的第28天,使用固紫B试剂盒(购自Sigma公司)以及茜素红染色法进行染色,并通过倒置显微镜观察拍照记录。使用磷酸酶分析试剂盒进行ALP定量检测(购自上海碧云天);使用ImageJ软件对茜素红染色进行灰度检测半定量分析。
2.6 统计学处理
采用PASSStatistics 22.0统计学软件分析。数值采用(±s)表示,两独立样本采用t检验,符合正态分布且方差齐性采用方差分析,方差不齐采用秩和检验,以P<0.05为差异有统计学意义。
3 结果
3.1 活血接骨方含药血清对BMSCs体外成骨分化及Sclerostin基因的影响
CCK-8检测结果显示:成骨诱导28天后与对照组相比(0.974±0.069),中药组(1.239±0.108,t=2.922,P=0.043)和BMP-4组(1.386±0.043,t=7.132,P=0.002)细胞活性增强,且中药+BMP-4组(1.633±0.097,t=7.796,P=0.001)细胞活性明显增强。DNA含量检测结果也显示:相较于对照组(0.973±0.066),中药组(1.191±0.086,t=2.821,P=0.048)、BMP-4组(1.407±0.074,t=6.156,P=0.004)和中药+BMP-4组(1.627±0.063,t=10.135,P=0.001)高于对照组(1.004±0.066),提示含有活血接骨方的大鼠含药血清可以增强BMSCs细胞活性,且与BMP-4两者联用效果更强(图1)。
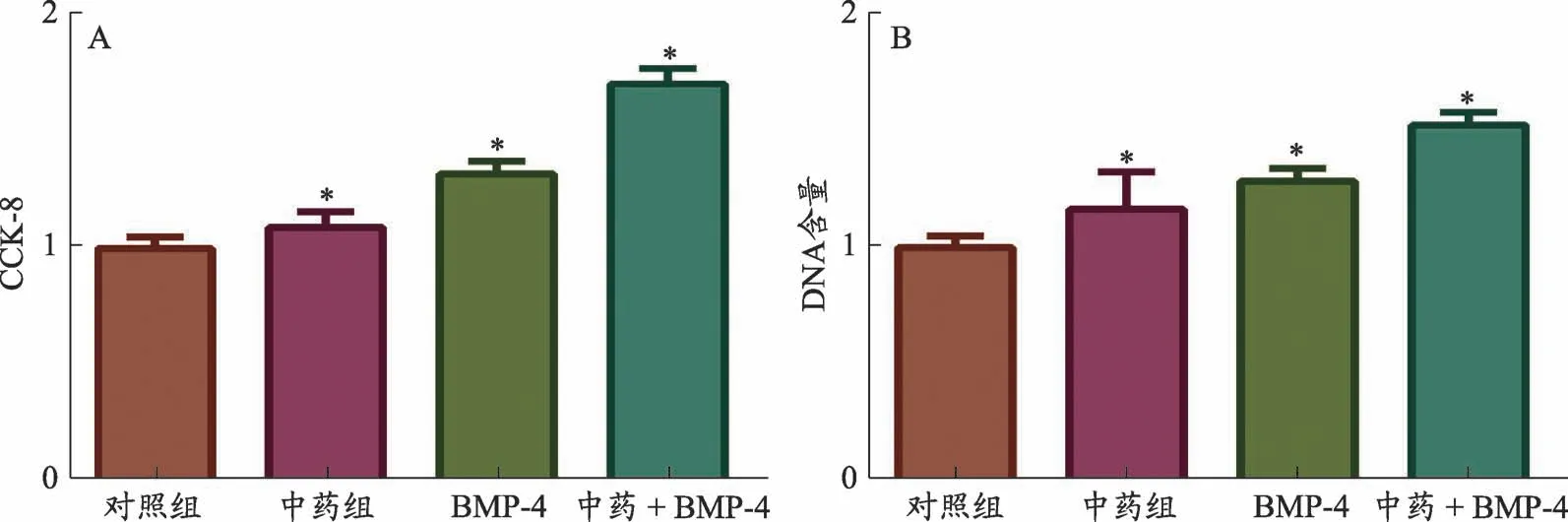
图1 各组BSMCs细胞活性比较。
ALP及定量检查结果显示:与对照组相比(0.913±0.055),中药组(1.221±0.105,t=2.848,P=0.022)、BMP-4组(3.193±0.209,t=14.591,P=0.001)和中药+BMP-4组(4.961±0.426,t=13.105,P=0.001)BMSCs出现矿化现象、ALP活性增强。茜素红染色及半定量检测结果也显示:相较于对照组(1.007±0.102),中药组(1.727±0.340,t=2.870,P=0.045)、BMP-4组(4.826±0.208,t=23.280,P=0.001)和中药+BMP-4组(8.627±0.620,t=17.161,P=0.001),提示含有活血接骨方的大鼠含药血清可以增强BMSCs细胞活性,且与BMP-4两者联用效果更强(图2)。
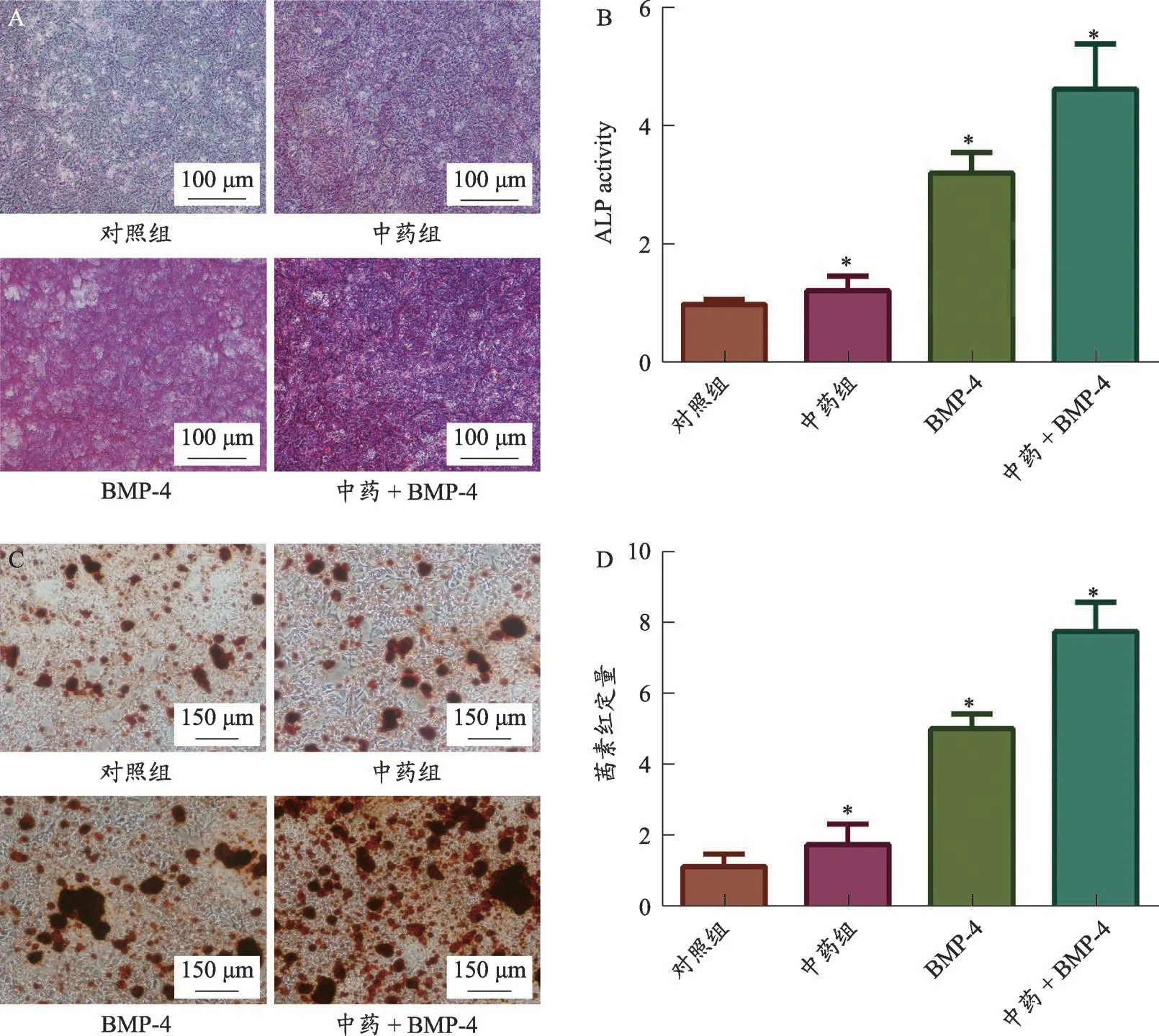
图2 各组BSMCs细胞矿化程度的比较。
实时荧光PCR和Western Blot结果显示:①与对照组相比,中药组、BMP-4组和中药+BMP-4组BMSCs成骨相关分子(Col1A2、OC、OPN)的mRNA和蛋白水平表达明显上调(P<0.05);②与对照组相比,中药组Sclerostin的mRNA和蛋白水平无明显统计学差异(P>0.05),但BMP-4组和中药+BMP-4组Sclerostin基因的表达明显上调,且中药+BMP-4组中Sclerostin基因的表达弱于BMP-4组(P<0.05),提示活血接骨方含药血清可能通过抑制BMP-4介导的Sclerostin基因表达上调,促进BMSCs成骨分化过程(图3-图4)。
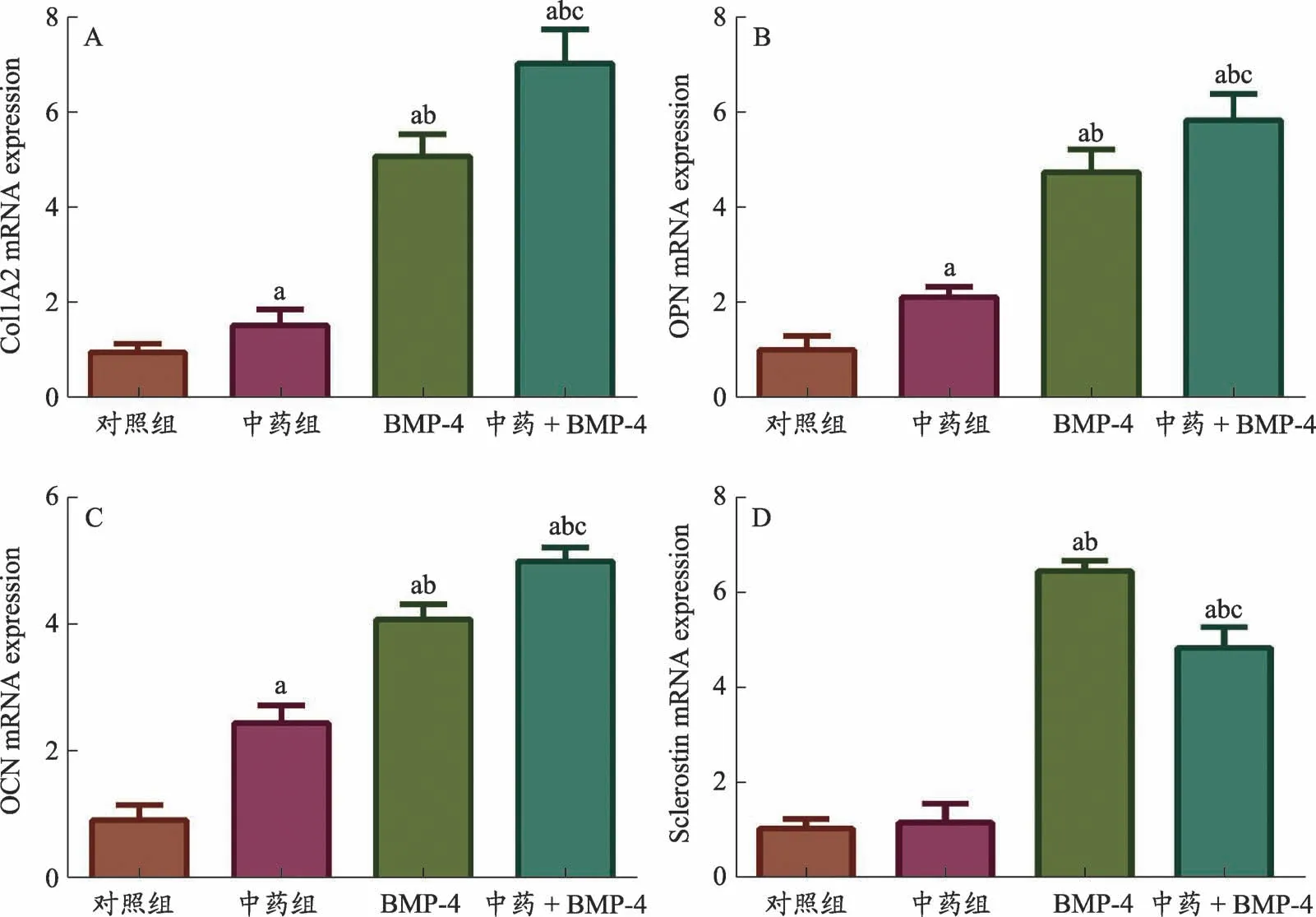
图3 各组BSMCs中成骨相关基因与Sclerostin基因mRNA水平表达比较
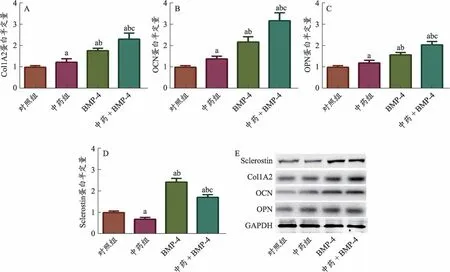
图4 各组BSMCs中成骨相关基因与Sclerostin基因蛋白表达比较
3.2 活血接骨方含药血清对BMSCs成骨分化中Wnt信号通路的影响
使用(低浓度、中浓度、高浓度)不同浓度活血接骨方含药血清干预BMSCs细胞7天并检测相关指标后发现:①各组细胞CCK-8结果(F=3.251,P=0.081)及DNA含量(F=1.499,P=0.287)无统计学差异;②相对于空白对照组,Wnt5a的mRNA和蛋白水平表达呈现浓度依赖性上调(F=3.251,P=0.081),而Sclerostin和GSK-3β的mRNA和蛋白水平呈现与之相反下降趋势(P<0.05),且Tyr216位磷酸化激活的GSK-3β蛋白含量逐渐降低,表明GSK-3β的蛋白活性也逐渐降低,提示随着含药血清浓度增加,Wnt信号通路激活呈现浓度依赖性增强。(图5-图6、表2)
表2 各组BMSCs中Wnt信号通路相关分子及Sclerostin基因的mRNA表达(n=3,±s)
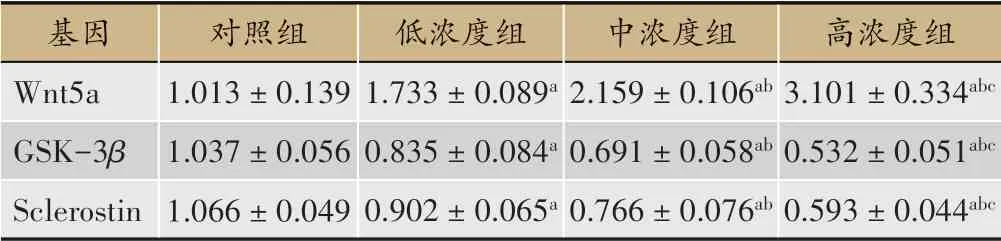
表2 各组BMSCs中Wnt信号通路相关分子及Sclerostin基因的mRNA表达(n=3,±s)
注:与对照组相比,a P<0.05;与中药组相比,b P<0.05;与BMP-4组相比,c P<0.05。
基因Wnt5a GSK-3β Sclerostin对照组1.013±0.139 1.037±0.056 1.066±0.049低浓度组1.733±0.089a 0.835±0.084a 0.902±0.065a中浓度组2.159±0.106ab 0.691±0.058ab 0.766±0.076ab高浓度组3.101±0.334abc 0.532±0.051abc 0.593±0.044abc
图5 各组BSMC细胞活性比较。
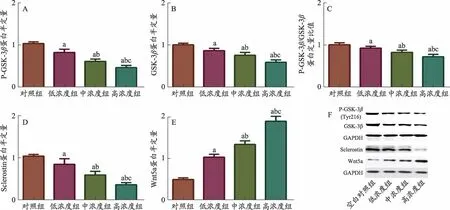
图6 不同浓度活血接骨方含药血清对BMSCs中Wnt信号通路相关分子及Sclerostin基因的作用
4 讨论
目前骨折的治疗方法主要包括手术、药物、电磁波、射频等多种治疗方法,但各种疗效均具有自身局限性。中医药治疗骨折由来已久,祖国医学将骨折其归属到“骨折病”范畴,中医药治疗骨折病要求辨证论治、和方圆之融,强调阴阳调和,具有多靶点、多因素、多方协同治疗骨折的天然优势。目前针对中医药治疗骨折多集中于加强骨代谢形成、促进BMSCs成骨分化及原始骨组织形成等方面。BMSCs作为骨髓组织中具有多向分化能力的干细胞亚群,当机体发生骨折时,细胞会趋向性迁移、聚集于骨折断端处并促成骨分化形成骨细胞,从而形成骨痂、促进骨折愈合。目前大量文献表明,活血续骨类中药可通过促进BMP-2、BMP-4、BMP-6等成骨因子表达或增加其促成骨作用,从而实现促进骨折愈合的作用。
“刘氏骨伤”作为无锡市非物质文化遗产[6],多年来经多代传人总结、完善形成的我科经验方-活血接骨方(又名刘氏正骨方),临床使用疗效确切。该方主要由地鳖虫、血竭、川芎、川断、乳香、没药、白术、丁香、杜仲、骨碎补、党参、当归、黄芪、自然铜、熟地、苏木等药物组成,方中杜仲、骨碎补、自然铜、川断入肾经,补肾壮骨,续骨止痛;土鳖虫性善走窜,能活血消肿续筋,熟地补血养阴,填精益髓;党参、当归、黄芪补益气血;血竭、川芎、乳香、没药均为均有活血散瘀消肿功效,诸药合用共奏“活血祛瘀,接骨续筋”之功效。大量临床研究表明[7-9],活血接骨方具有良好的临床疗效,但针对其促进骨折愈合的具体作用机制尚缺乏系统化、深层次的理论研究。基于上述中医理论及现代研究结果,课题组为探究活血接骨方BMSCs成骨分化的影响,开展相关研究,结果发现活血接骨方含药血清可以有效提高BMSCs细胞活性,且与BMP-4联合使用时效果更佳。ALP活性作为成骨前细胞及成骨细胞分化的早期特异性指标,与细胞增殖程度呈正相关,是细胞发生矿化及促成骨分化的基础。本研究结果中ALP染色和茜素红染色结果也证实,活血接骨方含药血清可以增强ALP活性及细胞矿化现象的发生。
骨代谢由多因素、多系统的复杂生物信息网络进行调控,其中多种因子存在相互协作又相互制约的辩证关系[14]。为探究活血接骨方与对BMSCs成骨分化的影响。课题组通过文献研究发现,Sclerostin基因作为BMP抑制物,对骨的形成代谢起负调控作用。骨源性细胞表达的Sclerostin可以通过抑制BMP因子活性降低骨源性细胞或成骨细胞的增殖,阻碍成骨分化过程,在体内受甲状旁腺、雌激素等生物因子间接或持续性的抑制影响[15,16]。我们既往研究发现[17],在人成骨细胞中BMP-4可以呈浓度依赖性促进Sclerostin基因表达。课题组前期研究发现[13],在BMP-4体外干预下,通过siRNA沉默Sclerostin基因可以有效促进BMSCs成骨分化及细胞矿化现象。本研究结果也再次证实BMP-4可以上调BMSCs中Sclerostin基因表达,但有趣的是,仅用含活血接骨方的大鼠血清进行28天的体外干预后,细胞中Sclerostin基因表达无明显统计学差异,但与BMP-4联合使用后可以部分抑制BMP-4介导的Sclerostin基因上调作用而增强BMP-4促成骨作用,提示含活血接骨方可能通过下调Sclerostin基因表达增强BMP-4的促成骨作用。
为了进一步探究活血接骨方的调节BMSCs成骨分化的机制途径,我们通过文献研究发现[18],Sclerostin主要通过抑制Wnt/β-catenin信号通路抑制成骨细胞活性。Wnt信号通路是与生长、发育以及肿瘤发生等生命过程息息相关,主要包括经典Wnt/β-catenin信号通路、非经典Wnt/Ca2+信号通路以及PCP途径,其中经典Wnt/β-catenin信号通路对骨代谢的调节具有至关重要的作用[19]。当Wnt/β-catenin处于未激活状态时,细胞质中β-catenin大部分被降解复合体磷酸化降解,从而维持一个较低的水平;而出现激活刺激信号时,BMSCs中Wnt蛋白(Wnt5a)与辅助受体低密度脂蛋白受体相关蛋白5/6(LRP5/6)和细胞跨膜特异性受体卷曲蛋白(Frz)相结合,通过磷酸化激活并作用于细胞质内Dsh蛋白,磷酸化的Dsh蛋白抑制糖原合成激酶(GSK-3β)活性,抑制β-catenin降解复合体活性,上调细胞质中β-catenin含量,β-catenin蛋白入核后启动下游多种成骨相关转录因子和靶基因表达,促进BMSCs成骨分化、调节骨代谢平衡[20-21]。Sclerostin作为Wnt/β-catenin信号通路的一种可溶性抑制因子,可以通过竞争性与Wnt/β-catenin信号通路中Lrp5/6中的El螺旋区域结合,从而抑制Wnt/β-catenin信号通路激活、阻碍骨形成。Wnt5a作为Wnt信号通路的关键因子既参与经典Wnt信号通路,又参与非经典Wnt信号通路;不仅促进BMSCs中成骨分化,也参与成骨细胞功能的调节[22]。在此基础上,国外有学者[23]通过研究Wnt/βcatenin信号通路及BMP信号通路两者与Sclerostin之间作用后发现,Wnt5a和GIN(GSK-3β抑制剂)均增加BMP-4诱导的BMP信号,BMP-4也可以增加Wnt5a和GIN诱导的Wnt信号。然而,GIN的效果要强烈得多;随着Wnt信号通路的增加,Sclerostin表达量呈剂量依赖性下降,而在此过程中BMP-4可以诱导Sclerostin表达[24]。因此,课题组通过使用不同浓度中药血清对BMSCs进行体外干预并检测Sclerostin基因与Wnt信号通路相关因子表达情况发现,随着含药血清浓度的逐渐增高,Wnt5a表达呈现浓度依赖性逐渐增高趋势,而Sclerostin基因和GSK-3β的mRNA和蛋白表达水平则呈现逐渐下降趋势。GSK-3β是Wnt/β-catenin经典信号通路的关键因子,是一种在高度保守的丝氨酸/苏氨酸激酶,可以通过不同位点磷酸化发挥不同作用,当Ser9位点磷酸化可抑制GSK-3β蛋白活性,上调细胞质内β-catenin细胞内含量,促进下游成骨基因表达;相反,当Tyr216位点磷酸化可激活GSK-3β蛋白活性,降低细胞质内β-catenin细胞内含量,抑制下游成骨基因表达。本次研究结果中,随着中药血清浓度增高,BMSCs中总GSK-3β蛋白含量逐渐降低,且Tyr216位点处的磷酸化GSK-3β蛋白也呈现降低趋势,提示活血接骨方含药血清体外诱导BMSCs成骨分化过程中,可能通过抑制Sclerosti基因表达,上调Wnt5a基因表达、下调GSK-3β基因表达及Tyr216位点的磷酸化从而促进Wnt/β-catenin经典信号通路激活,诱导BMSCs成骨分化过程。但在长期体外干预状态下,活血接骨方含药血清是否一直对WnWnt/β-catenin信号通路存在持续性影响还有待进一步探讨。
综上所述,活血接骨方含药血清可以体外促进BMSCs成骨分化,这种促成骨作用可能与BMSCs中抑制因子Sclerostin表达,激活Wnt信号通路从而促进成骨相关基因表达有关。采用现代分子生物细胞学技术,初步探讨活血接骨方治疗骨折可能的作用机制,为中医药治疗骨折提供新的思路与理论依据。
本研究局限:①本研究选用动物中药灌服法制备含药血清进行干预,受给药时机、给药方案、采血方法等因素影响,中药复方入血成分是否为药效的主要成分仍需进一步深入挖掘;②仅初步探究Wnt信号通路,针对多信号通路之间交互作用,仍需进一步研究。
