磁免疫结合单颗粒模式ICP-MS同时测定乳腺癌病人血清中的CEA与CA15-3
2021-07-02何永昱曹玉嫔覃东庙邓必阳
何永昱,曹玉嫔,覃东庙,邓必阳*
(1.广西师范大学 化学与药学学院 省部共建药用资源化学与药物分子工程国家重点实验室,广西 桂林 541004;2.广西中医药大学 药学院,广西 南宁 530200)
癌症是当今世界上最致命的疾病之一[1]。癌胚抗原(Carcinoembryonic antigen,CEA)是一种糖蛋白,是多种癌症中最重要的肿瘤标志物之一。目前,CEA已被证实与结直肠癌有关,并被认为是乳腺癌、卵巢癌和口腔癌的重要生物标志物[2-5]。糖类抗原15-3(Carbohydrate antigen 15-3,CA15-3)是一种来自muc1家族的400 kDa糖蛋白,也是一种与乳腺癌高度相关的生物标志物,常用于乳腺癌患者的早期诊断、进展和复发诊断[6-7]。但检测单个CEA或者CA15-3存在准确度不高的局限性,同时检测CEA和CA15-3可更大程度地提高相关癌症早期诊断准确性。目前已报道用于检测肿瘤标志物的方法有酶联免疫分析(Enzyme-linked immunosorbent assay,ELISA)[8]、放射免疫分析(Radioimmunoassay,RIA)[9]、电化学免疫分析(Electrochemical immunoassay,ECIA)[10]、化学发光免疫分析(Chemiluminescence immunoassay,CLIA)[11]和电感耦合等离子体质谱法(ICP-MS)[12-20]等。ICP-MS与元素标记相结合已成为一种极具潜力的肿瘤标记物检测方法,尤其是在大规模生物检测和临床诊断中具有多重分析的潜力[13]。纳米粒子由于粒径小、表面容易修饰、生物兼容性好等优点,在生物标记研究中呈现良好的应用前景[21-22]。等离子体离子化过程中离子放电产生的时间分辨瞬态信号可以反映纳米粒子的浓度,因此,可通过瞬态信号频率量化纳米粒子标记免疫复合物的浓度[13],已有多种金属纳米颗粒用于ICP-MS的生物分析[12-20]。上转换纳米粒子(Upconversion nanoparticles,UCNPs)因具有良好的生物相容性和化学稳定性已广泛应用于生物标记、生物传感和细胞检测[23]。CeO2-SiO2NPs中的140Ce原子在ICP-MS检测中几乎不受分子离子的光谱干扰,并具有较低的背景[24]。如Yang等[20]报道了一种多功能探针应用于ICP-MS测定和癌细胞的多模态成像的方法;Choi等[23]报道了基于ICP-MS的氧化铈沉积的介孔氧化硅纳米颗粒用于检测人血清中癌胚抗原的方法;Liu等[24]报道了上转换纳米颗粒标记结合ICP-MS测定人血清中甲胎蛋白的方法。目前,尚未见基于UCNPs和CeO2-SiO2NPs标记ICP-MS单颗粒模式同时测定人血清中CEA和CA15-3的报道。
本研究通过自主合成羧基功能化上转化纳米颗粒(UCNPs)和氨基功能化二氧化铈沉积的二氧化硅纳米颗粒(CeO2-SiO2NPs),并将其用于免疫标记检测抗体。同时还制备了具有良好分散性和水溶性的氨基功能化四氧化三铁磁纳米颗粒(Amino modified magnetic nanoparticles,AMNPs),用于包被抗体和高效快速的磁分离。夹心免疫反应完成后,用甲酸洗脱夹心免疫复合物,通过ICP-MS单颗粒模式同时检测纳米颗粒中的140Ce和174Yb,间接测定了CEA和CA15-3,并成功应用于乳腺癌病人血清中CEA和CA15-3的检测。
1 实验部分
1.1 仪器与试剂
NexIon 300 X型ICP-MS(美国PerkinElmer公司),工作参数:射频功率(RF power)为1 300 W;辅助气流速(Auxiliary gas flow)为1.2 L·min-1;等离子体流速(Plasma gas flow)为15 L·min-1;RPq为0.8;扫描方式(Scan mode)为跳峰(Peak hopping);驻留时间(Dwell time)为0.1 ms;Sweeps为1;监测同位素(Monitored isotope)(m/z)为140Ce和174Yb。Spectrum Two FT-IR红外光谱仪(美国PerkinElmer公司)。Rigaku D/max 2500/pc型X射线粉末衍射仪(日本理学)。JEM-2100透射电子显微镜(日本电子株式会社)。TG16-W微量高速离心机(湖南湘仪实验室仪器开发有限公司)。DZF-300真空干燥箱(郑州长城科工贸有限公司)。
N-羟基琥珀酰亚胺(NHS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl,98%)、3-氨丙基三乙氧基硅烷(APTES)、六水合氯化铁、乙二醇、无水醋酸钠、正硅酸乙酯(TEOS)、介孔二氧化硅纳米颗粒、六水合硝酸铈、聚氧代乙烯壬基苯基醚(IGEPAL CO-520)、3-氨丙基三甲氧基硅氧烷(APTMS)、三氧化镱、三氧化钇、三氧化铒、浓硝酸、甲酸、聚丙烯酸(PAA)和NaF均购于阿拉丁试剂公司(上海)。牛血清白蛋白(BSA)购于美国Sigma-Aldrich公司。癌胚抗原(CEA)、糖类抗原15-3(CA15-3)、鼠源CEA抗体(Mouse anti-CEA)、兔源CA15-3抗体(Rabbit anti-CA15-3)和纯化抗体IgG购于北京博奥森生物技术有限公司。无水乙醇、氨水、磷酸氢二钾和磷酸二氢钾(西陇化工股份有限公司)。质谱调谐液(1 ng·mL-1)包括Be、Mg、In、U、Ce混合标准液(美国PerkinElmer公司)。以上试剂均为分析纯。实验用水均为高纯水。
1.2 氨基功能化Fe3O4磁纳米粒子的制备
Fe3O4纳米粒子(Magnetic nanoparticles,MNPs)的制备参考文献[25]并稍作修改:称取1.35 g FeCl3·6H2O和3.60 g无水醋酸钠溶于40 mL乙二醇,超声分散15 min,充分搅拌15 min,将混合溶液放入压力釜中,于200 ℃反应12 h,磁分离,用水和乙醇交替洗涤4次,得Fe3O4磁纳米粒子。将Fe3O4磁纳米粒子重新分散于80 mL乙醇和20 mL水中,加入2 mL氨水,超声分散5 min。再加入1 mL TEOS,搅拌下反应24 h,磁分离,用水和乙醇洗涤。再将Fe3O4磁纳米粒子分散于50 mL乙醇和50 mL水中,超声分散均匀,加入2 mL APTES,60 ℃搅拌反应24 h,磁分离,用水和乙醇交替洗涤6次,得到氨基功能化的Fe3O4磁纳米粒子(AMNPs)。于70 ℃真空干燥4 h,备用。
1.3 氨基功能化CeO2-SiO2NPs的制备
氨基功能化CeO2-SiO2NPs的制备参考文献[23]并稍作修改:称取0.250 g SiO2超声分散于20 mL乙醇中,加入20 mL 乙醇、0.500 g Ce(NO3)3·6H2O和1 mL IGEPAL CO-520,搅拌反应1 h,向混合液中加入20 mL乙醇和0.050 mL NH4OH。8 000 r/min离心5 min,收集沉淀胶体,置于烘箱中干燥。将收集的胶体于500 ℃ 煅烧5 h,制得CeO2沉积二氧化硅纳米颗粒。称取0.001 g CeO2沉积二氧化硅纳米颗粒超声分散于2 mL乙醇中,加入100 μL APTMS,搅拌反应3 h,用乙醇离心洗涤4次,制备得氨基功能化CeO2-SiO2NPs。
1.4 羧基功能化UCNPs的合成
上转换纳米颗粒合成参考文献[24]并稍作修改:将2.260 g Y2O3、0.890 g Yb2O3和 0.096 g Er2O3溶于65 ℃浓硝酸,加热至140 ℃,蒸发溶剂,再重新分散至100 mL水中,制得镧系储备液,备用。将0.900 g PAA溶解于2 mL镧系储备液,倒入反应容器中,再向其中加入8 mL水、18 mL乙醇和0.210 g NaF,充分搅拌20 min,置于200 ℃反应10 h,冷却至室温,用乙醇和水离心分离洗涤3次,制得羧基功能化UCNPs,将其分散于水中,备用。
1.5 CeO2-SiO2NPs-Ab2-CEA偶联物的制备
准确称取0.001 g CeO2-SiO2NPs分散于1 mL PBS缓冲溶液中,超声分散5 min。加入0.050 g EDC和0.050 g NHS,缓慢搅拌反应24 h,活化氨基。以8 000 r/min离心5 min,再用PBS洗涤3次,分散于1 mL PBS中,于4 ℃保存备用。准确移取200 μL上述活化的CeO2-SiO2NPs纳米颗粒溶液,置于1 mL PBS中,向其中加入10 μL CEA的检测抗体(Ab2-CEA),缓慢搅拌反应2 h。再以8 000 r/min离心5 min,用PBS洗涤3次,以除去未结合的Ab2-CEA,收集得CeO2-SiO2NPs-Ab2-CEA。为封闭非特异性吸附位点,加入100 μL 2% BSA反应1 h。8 000 r/min离心5 min,用PBS 洗涤3次,最后分散于1 mL PBS中,于4 ℃保存备用。
1.6 UCNPs-Ab2-CA15-3偶联物的制备
准确称取0.001 g羧基功能化UCNPs,分散于1 mL PBS缓冲溶液中,超声分散5 min,加入0.050 g EDC和0.050 g NHS,缓慢搅拌反应24 h,活化羧基。以8 000 r/min离心5 min,再用PBS洗涤3次,分散于1 mL PBS中,4 ℃保存备用。准确移取200 μL上述溶液,用PBS稀释至1 mL,将10 μL CA15-3的检测抗体(Ab2-CA15-3)加入上述纳米颗粒溶液中,缓慢搅拌反应2 h。以8 000 r/min离心5 min,用PBS洗涤3次,除去未结合的检测抗体,收集得UCNPs-Ab2-CA15-3。为了封闭非特异性吸附位点,再加入100 μL 2% BSA反应1 h。8 000 r/min离心5 min,用PBS 洗涤3次,最后分散于1 mL PBS中,于4 ℃保存备用。
1.7 磁免疫反应过程
磁免疫反应流程如图1所示。准确称取0.020 g AMNPs,分散于10 mL PBS中,超声10 min使磁纳米粒子均匀分散,向其中加入0.060 g EDC和0.060 g NHS,活化氨基,室温轻轻振荡反应2 h,磁分离,用PBS洗涤3次。将AMNPs分散于2 mL PBS中,分别加入10 μL CEA包被抗体(Ab1-CEA)和10 μL CA15-3包被抗体(Ab1-CA15-3),室温轻轻振荡反应2 h,磁分离,PBS洗涤3次除去未反应的Ab1,AMNPs完成捕获包被抗体,得到AMNPs-Ab1。加入600 μL 1% BSA反应1 h,以封闭非特异性吸附位点,磁分离,PBS洗涤3次,重新分散于15 mL PBS中,4 ℃保存备用。每次使用前超声5 min使纳米颗粒均匀分散在溶液中。
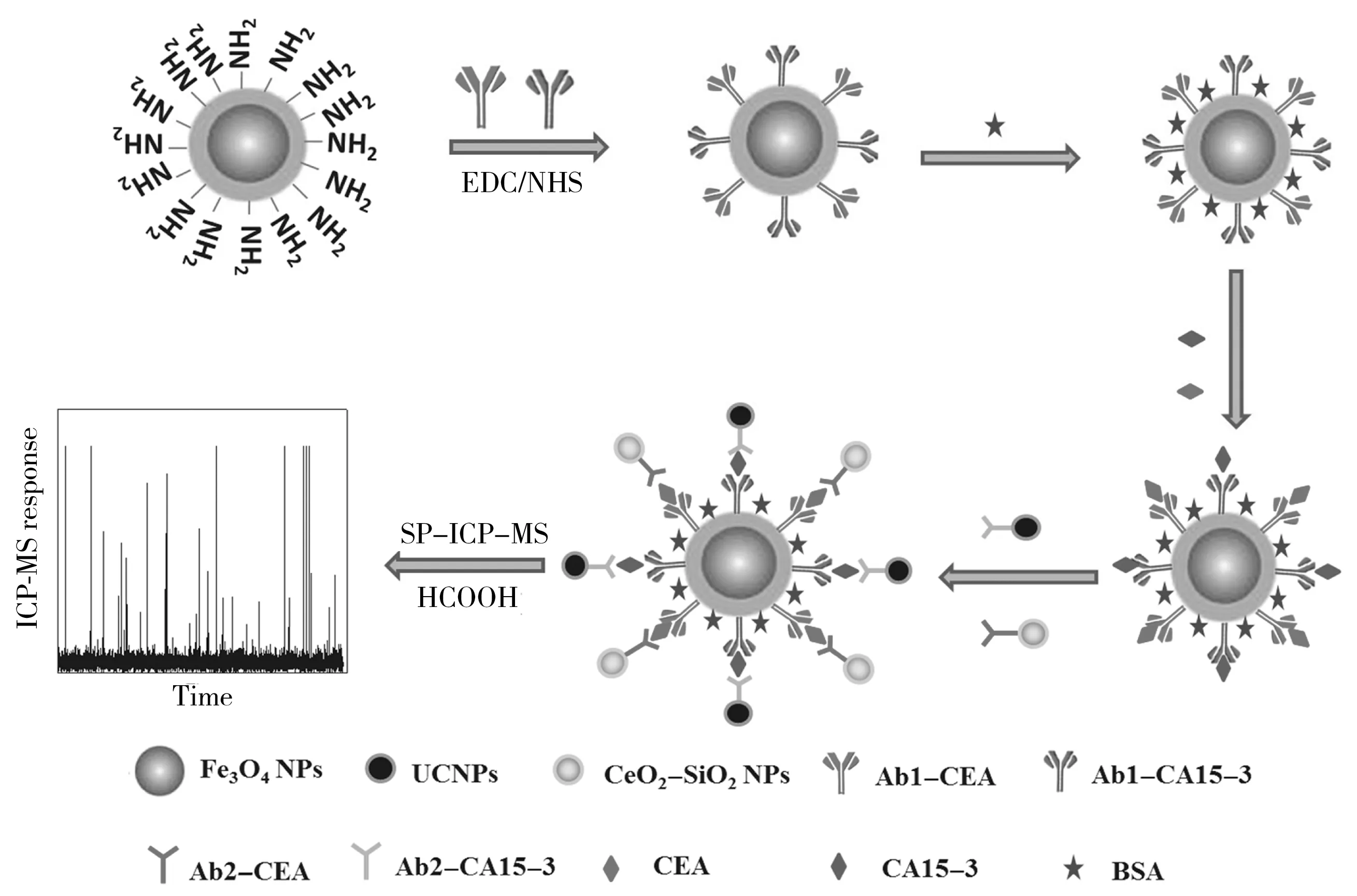
图1 磁免疫反应流程图Fig.1 Schematic diagram of magnetic immunoassay
准确移取0.5 mL AMNPs-Ab1,加入40 μL CEA和CA15-3混合溶液或人血清样品,37 ℃恒温振荡孵育1 h,磁纳米粒子捕获的包被抗体与抗原完成特异性结合。磁分离,PBS洗涤3次。分别加入50 μL CeO2-SiO2NPs-Ab2-CEA和40 μL UCNPs-Ab2-CA15-3,37 ℃温和振荡孵育1 h,完成抗原抗体特异性结合,形成双抗夹心免疫复合物。磁分离,用PBS洗涤6次。再用500 μL 1.5 mol·L-1甲酸洗脱双抗夹心免疫复合物,80 ℃下反应20 min,冷却至室温,超声15 min,使纳米颗粒从复合物中完全洗脱,磁分离,再将洗脱液定容至8 mL,采用ICP-MS的单颗粒模式检测纳米颗粒中的140Ce和174Yb。
2 结果与讨论
2.1 氨基功能化Fe3O4 磁纳米粒子的表征
采用透射电子显微镜(TEM)和红外光谱(FT-IR)表征合成的氨基功能化Fe3O4磁纳米粒子。结果显示,制备的纳米颗粒呈圆形,具有较好的分散性(图2A);尺寸分布统计图显示AMNPs的平均粒径约42 nm(图2B);FT-IR图可见,582 cm-1处为Fe—O键特征吸收峰,1 076 cm-1处为Si—O—Si的特征吸收峰,1 390 cm-1和1 634 cm-1处为磁纳米粒子表面上有游离的氨基特征峰(图2C)[26],表明氨基已成功修饰到Fe3O4磁纳米颗粒上。
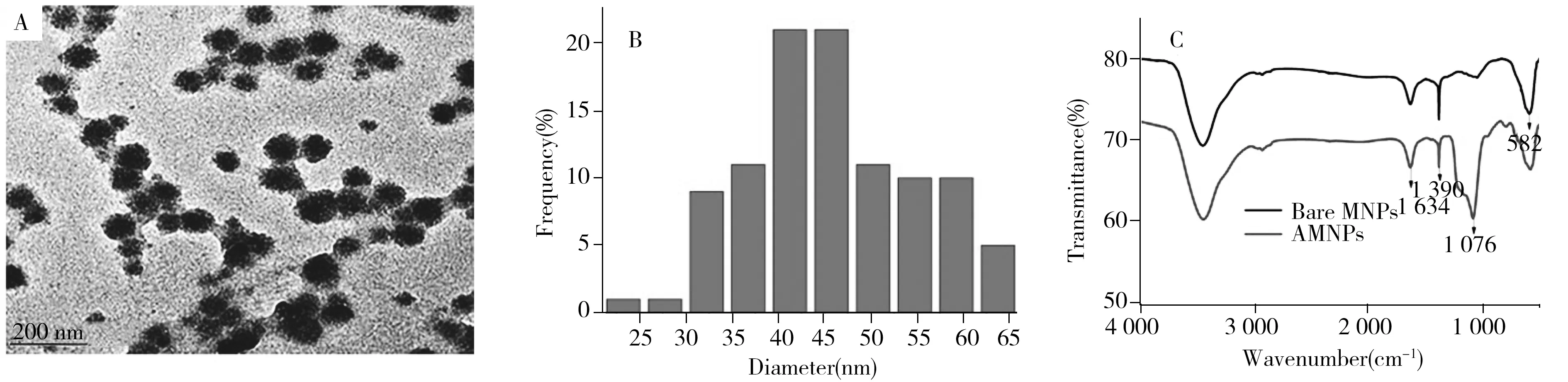
图2 AMNPs的透射电子显微镜图(A)、尺寸分布图(B)和红外光谱图(C)Fig.2 TEM image(A),size distribution image(B) and FT-IR spectra(C) of AMNPs
2.2 氨基功能化CeO2-SiO2NPs的表征
合成的氨基功能化CeO2-SiO2NPs的透射电子显微镜图、尺寸分布图及红外光谱图见图3,结果显示,CeO2-SiO2NPs具有较好的分散性(图3A),平均粒径约35 nm(图3B),1 619 cm-1处为—NH2特征吸收峰(图3C),表明APTMS已成功修饰到二氧化铈沉积介孔二氧化硅纳米颗粒表面。
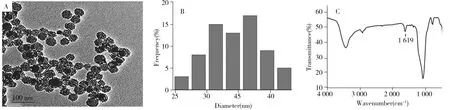
图3 CeO2-SiO2NPs的透射电子显微镜图(A)、尺寸分布图(B)和红外光谱图(C)Fig.3 TEM image(A),size distribution image(B) and FT-IR spectrum(C) of CeO2-SiO2NPs
2.3 羧基功能化UCNPs的表征


图4 UCNPs的透射电子显微镜图(A)、X射线粉末衍射图(B)和红外光谱图(C)Fig.4 TEM image(A),XRD spectrum(B) and FT-IR spectrum(C) of UCNPs
2.4 ICP-MS干扰的消除
174Yb的自然丰度为31.80%,易受到174Hf、158Gd16O和158Dy16O的干扰。140Ce的自然丰度为88.84%,不受同质量数原子和多原子分子的干扰[27]。因此,实验考察了乳腺癌病人血清样品和PBS缓冲溶液中Hf、Gd和Dy的含量。结果表明,乳腺癌病人的血清样品和PBS缓冲溶液均不含有Hf、Gd和Dy,因此,174Hf、158Gd16O和158Dy16O对174Yb的信号干扰可忽略。

图5 驻留时间对140Ce和174Yb的信号频数的影响Fig.5 Effects of dwell time on the number of detection events of 140Ce and 174Yb
2.5 SP-ICP-MS条件的优化
单颗粒ICP-MS中,为使每个瞬态信号对应一个粒子,驻留时间影响很大[12]。实验考察了驻留时间对收集纳米颗粒瞬态信号频数的影响(图5)。结果显示,当驻留时间为0.1 ms时,收集到的Ce和Yb纳米颗粒信号频数最大,由于团聚或多个纳米颗粒同时进入检测器的影响,随着驻留时间的增大,收集到的纳米颗粒瞬态信号频数逐渐减少,因此最终选择驻留时间为0.1 ms。实验还考察了CeO2-SiO2NPs浓度对颗粒信号频数的影响,发现当CeO2-SiO2NPs浓度大于25 ng·mL-1时,收集到的纳米颗粒(Ce)瞬态信号频数几乎不会再变化,因此CeO2-SiO2NPs的最佳浓度为25 ng·mL-1。另外,UCNPs浓度对颗粒信号频数也有影响,其浓度大于10 ng·mL-1时,可能是由于浓度过大造成颗粒团聚,使得导致收集到的纳米颗粒(Yb)信号频数几乎不再变化,所以UCNPs最佳浓度设为10 ng·mL-1。
2.6 磁免疫反应条件的优化
为获得最佳的捕获效率,实验考察了AMNPs-Ab1的体积对颗粒信号频数的影响。结果显示,当AMNPs-Ab1体积由100 μL增加到500 μL时,140Ce和174Yb的信号频数逐渐增多,当AMNPs-Ab1体积大于500 μL时,140Ce和174Yb收集到的信号频数几乎不再变化,因此选择AMNPs-Ab1体积为500 μL。
纳米颗粒与检测抗体的偶联物是免疫分析的关键因素。为确保CeO2-SiO2NPs-Ab2-CEA和UCNPs-Ab2-CA15-3与抗原完全反应,需加入过量的CeO2-SiO2NPs-Ab2-CEA和UCNPs-Ab2-CA15-3,但随着浓度升高也会导致非特异性吸附的背景强度增大。因此实验考察了CeO2-SiO2NPs-Ab2-CEA和UCNPs-Ab2-CA15-3体积对颗粒信号频数的影响。结果发现,140Ce和174Yb的信号频数随着CeO2-SiO2NPs-Ab2-CEA和UCNPs-Ab2-CA15-3的体积在10~50 μL范围内增大而逐渐增大,当CeO2-SiO2NPs-Ab2-CEA和UCNPs-Ab2-CA15-3的体积均大于50 μL时,纳米颗粒信号频数不再改变(图6A)。因此,确定CeO2-SiO2NPs-Ab2-CEA和UCNPs-Ab2-CA15-3的最佳体积为50 μL。另外,实验考察了磁免疫反应的孵育时间对纳米颗粒信号频数的影响。结果显示,140Ce和174Yb的信号频数随着孵育时间在20~60 min范围内增大而逐渐增大,60 min后几乎不再改变(图6B),因此,选择孵育时间为60 min。为了封闭非特异性吸附位点,实验选择含1% BSA的PBS溶液为封闭剂,并考察了BSA体积对非特异性吸附的影响。实验流程如图1所示,用PBS代替CEA和CA15-3抗原,收集磁免疫反应吸附后的残留液,发现当BSA体积从100 μL增至600 μL时,140Ce和174Yb的信号频数逐渐增多,当BSA体积大于600 μL时,140Ce和174Yb的信号频数几乎不再变化(图6C)。说明非特异性吸附随着BSA体积的增加而降低。因此BSA的最佳体积为600 μL。

2.7 线性范围与检出限
在优化实验条件下,对建立方法的分析性能进行评估。结果显示,CEA和CA15-3的脉冲频率(Y)与其浓度(X)分别在0.02~100 ng·mL-1和0.05~50 U·mL-1范围内呈良好线性,线性方程分别为Y=7.380X+24.69(r2=0.994 0)和Y=9.850X+29.33(r2=0.987 0),以3倍信噪比(S/N=3)计算得两者的检出限(LOD)分别为0.006 7 ng·mL-1和0.016 7 U·mL-1。本方法的检出限优于其他免疫分析方法(表1)[19,28-32]。

表1 多种分析方法的比较Table 1 Comparison of various analytical methods
2.8 实际样品分析
在优化条件下,采用磁免疫反应结合纳米粒子标记单颗粒模式ICP-MS测定3名乳腺癌病人血清中CEA和CA15-3含量,并进行加标回收实验,结果见表2。结果显示,3名乳腺癌病人血清中均检出CEA和CA15-3CEA在3名乳腺癌病人血清中的加标回收率为95.2%~98.9%,相对标准偏差(RSD)为3.0%~4.6%;CA15-3的回收率为95.5%~97.2%,RSD为3.4%~4.3%,表明方法具有较好的准确性和精确度,该结果与临床使用的化学发光免疫方法结果一致,可用于实际血清样品中CEA和CA15-3含量的测定。

表2 乳腺癌病人血清样品的分析结果(n=5)Table 2 Analytical results of breast cancer human serum samples(n=5)
3 结 论
本文建立一种以UCNPs和CeO2-SiO2NPs为标签的磁免疫反应结合SP-ICP-MS同时测定乳腺癌病人血清中CEA和CA15-3的新方法。方法具有通过多种元素标记同时定量检测多种生物样品中低浓度糖蛋白的潜力,表明基于金属纳米粒子标记的SP-ICP-MS方法在生物医学研究和临床诊断中具有潜在的应用价值。
