单颗粒光散射显微成像技术在生化医药分析中的应用
2021-07-02李孟效黄承志
程 茹,李孟效,黄承志,2*,王 健*
(1.发光分析与分子传感教育部重点实验室,西南大学药学院,重庆 400715;2.发光与实时分析系统重庆市重点实验室,西南大学化学化工学院,重庆 400715)
1 单颗粒光散射探针
等离子体纳米颗粒(PNPs)因优良的局域表面等离子体共振(LSPR)性质而被广泛用作单颗粒光散射探针[1-3]。当纳米颗粒的表面受到特定频率的光照射,且粒径远小于入射光波长时,颗粒表面的自由电子会产生振荡,当光子的频率与电子在克服来自中心带正电的核的束缚力产生的振动频率一致时,便会发生LSPR,并辐射出相同频率的电磁波,产生散射光。
Mie等科学家于1908年推导出金属纳米颗粒的消光光谱(公式1~2)[4]。
(1)
(2)
式中,I为散射光强度,m是激发波长处散射颗粒的相对折光指数,V为颗粒体积,εm为颗粒周围介质的介电常数,λ为入射光波长,ε1和ε2分别为介电常数的实部和虚部,σext是消光截面,α代表极化率。由此可得,当等离子体纳米颗粒的状态发生变化时,其LSPR性质随之改变。纳米颗粒的材质、粒径、形貌、所处微环境等因素都会影响其LSPR性质,具体分析如下:(1)纳米颗粒的材质:纳米颗粒的元素组成是决定其LSPR性质的最根本因素,不同材质的纳米颗粒,即使粒径、形貌、微环境等都相同,其LSPR性质也会具有很大差异,例如40 nm的银纳米颗粒(AgNPs)和金纳米颗粒(AuNPs)的散射光分别为蓝色和绿色(图1A~B)[5]。(2)纳米颗粒的粒径:一般而言,光散射的颜色会随纳米颗粒的粒径而改变,例如AuNPs的光散射随粒径增大而呈现绿色、黄色、橙色和红色(图1B~E)。(3)纳米颗粒的形貌:纳米颗粒的形貌是决定其LSPR的重要因素,直径相同但径向比不同的金纳米棒的性质也截然不同[6-7]。(4)纳米颗粒所处的微环境:微环境的折光指数会影响介电常数,从而影响散射光谱的峰位置[8];(5)其他影响因素:纳米颗粒之间的耦合等都会影响其LSPR性质[9]。

图1 白光激发下不同粒径的金银纳米颗粒溶液的散射光[5] Fig.1 The light-scattering of silver and gold nanoparticles solution when illuminated by a narrow beam of white lightA.40 nm AgNPs;B.40 nm AuNPs;C.78 nm AuNPs;D.118 nm AuNPs;E.140 nm AuNPs
2 单颗粒光散射显微镜
等离子体纳米颗粒光散射信号的获取依赖于单颗粒光散射显微镜,因其背景为黑色,又称暗场显微镜(DFM)[10]。与明场显微镜不同的是,单颗粒光散射显微镜上配备暗场聚光镜,只允许斜射的光照射到样品上,从而激发等离子体纳米颗粒使其发出散射光,因此该系统具有高信噪比、实时监控的特点[11-15]。散射光经过物镜后一部分被导入到真彩电荷耦合器件(CCD)相机内以获取暗场图像,另一部分散射光输入光谱仪可得到单个纳米颗粒的散射光谱(图2)。由于灵敏度高、可实时动态分析[16-18]等特点,DMF已广泛用于蛋白质[19]、核酸[20]等生物分子的分析检测[2,21]。

图2 暗场光学显微镜工作原理示意图[10]Fig.2 Typical dark-field microscopy and spectroscopy setup
3 常用的单颗粒光散射分析方法
由于暗场显微镜及其连接的光谱仪可得到等离子体纳米颗粒光谱特性、光散射的颜色及颗粒的数量等相关信息,因此可以根据光谱的位移[22]、光散射强度的变化[23]、颜色的改变[8]及颗粒数量[24]等信息建立分析方法(图3),实现靶物的灵敏分析及实时动态监控。

图3 常用的单颗粒光散射显微成像方法Fig.3 The common methods for single-particle light scattering microscopic imaging
3.1 基于散射光谱波长位移的分析方法
暗场光学显微镜可获取纳米颗粒散射光谱等多维信息,通过监测靶物诱导的LSPR散射光谱波长移动情况,即可实现靶物的准确、灵敏、定量检测。等离子体纳米颗粒的LSPR性质与纳米颗粒的材质及粒径息息相关,当颗粒的材料及粒径发生改变时,其单颗粒散射光信号随之发生改变。
通过生长/刻蚀等方式改变纳米颗粒的粒径以及纳米颗粒的组装/解组装是引起散射光谱变化的重要途径[25],例如直径为60 nm的AuNPs发出绿色的散射光,其LSPR峰位于560 nm;但当AuNPs与5′-三磷酸腺苷(ATP)在HAuCl4溶液中共同孵育后,纳米颗粒发生自催化生长粒径增大,其散射光斑逐渐由绿色转变为红色,LSPR峰红移至635 nm,据此可实现ATP的检测[22]。

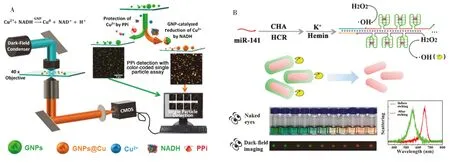
图4 基于壳层结构变化引起的光谱位移建立分析传感方法Fig.4 The analytical sensing method based on spectral shift caused by shell changeA.pyrophosphate detection based on the growth of copper on AuNPs surface(利用铜在金纳米颗粒表面的生长检测焦磷酸盐)[26];B.microRNA detection based on the etching of silver shell on gold nanorods surface(基于银包金纳米棒的蚀刻超灵敏检测microRNA)[27]
3.2 基于散射强度的分析方法
纳米颗粒的光散射强度可以通过Image-Pro Plus(IPP)软件对暗场图片进行处理获取,也可从散射光谱直接读取,再进一步利用散射强度的变化建立分析方法[30]。本课题组早期利用夹心免疫反应,实现了免疫球蛋白(IgG)的分析(图5A)[31]。先将一抗固定在载玻片上,IgG与一抗结合后,进一步与修饰AgNPs的二抗结合,随着IgG浓度的增大,AgNPs的散射强度随之增强。此外,根据等离子体共振能量转移(PRET)引起的散射信号变化,亦可实现分析的目的[32]。当纳米颗粒受到与之等离子体共振频率相匹配的光源激发时,其受激电子将会跃迁到激发虚态,而当周围存在与之匹配的能量受体时,能量将会通过非福射转移的方式传递到受体分子,发生PRET,贵金属纳米颗粒的散射光猝灭,在暗场显微镜下表现为散射光强度降低。本课题组利用静电作用将金纳米海胆与氧化态的3,3′,5,5′-四甲基联苯胺(TMB)分子进行有效连接,成功构建了PRET供受体对。进一步基于酸性磷酸酶(ACP)降解抗坏血酸磷酸酯产生的抗坏血酸能调节PRET对的状态,建立了高特异性检测ACP的分析方法[12]。但该法依赖于光谱仪,每次只能扫描单个颗粒,操作复杂耗时。

图5 基于散射强度变化的分析方法Fig.5 The analytical method based on the scattering intensityA.immunoglobulin detection based on the scattering intensity from spectra(基于散射光谱强度检测免疫球蛋白)[31];B.microRNA detection based on the scattering imaging intensity obtained by IPP software(基于IPP处理得到的散射强度检测microRNA)[33]
将获取的暗场图片用IPP软件处理,可快速获取批量颗粒的强度,不需要昂贵的光谱仪,方法简单易行。本课题组研究发现,microRNA-27a诱发的链置换反应可释放脂质体装载的葡萄糖氧化酶氧化葡萄糖产生H2O2,并进一步与I-作用生成I2刻蚀金纳米棒,该过程伴随着LSPR散射强度的显著降低。该方法结合链置换反应以及脂质体信号放大,能够检测乳腺癌细胞提取液中的microRNA-27a(图5B)[33]。2019年,本课题组利用金纳米三角片(AuNPL)开发了一种动态监测PPi的方法。由于铜离子和碘离子协同作用对于AuNPL具有刻蚀作用,导致暗场下AuNPL散射光斑的颜色从红色逐渐变为绿色,且散射强度降低,然而PPi与铜离子具有很强的亲和力,极大地抑制了Cu2+和I-对AuNPL的刻蚀作用,通过动态监测该反应过程中散射光斑的强度变化,可实现PPi的灵敏检测[34]。
3.3 基于单颗粒颜色变化的分析方法
2011年,本课题组首次提出将RGB法用于单颗粒散射光分析[8]。RGB分析是根据颗粒中颜色在R(红)G(绿)B(蓝)的比例将单颗粒光散射信号转化为数字信息从而代替散射光谱扫描。根据RGB颜色模型,任何颜色都可分解为R、G、B 3种颜色,通过计算将其转换为0~255之间的整数值,如蓝色可以用RGB=(0,0,255)表示,(255,0,0)表示红色光散射信号,而(0,255,0)表示绿色光散射信号。基于单颗粒RGB颜色变化的定量分析摆脱了复杂耗时的光谱扫描程序以及光谱仪器昂贵的限制,更加简单易行[35],具有明显的优势,自提出之后便得到了广泛的应用。
纳米颗粒的粒径变化及组装均可有效引起颜色的改变。Wang等[36]通过DNA将多个13 nm金纳米颗粒连接到50 nm金纳米颗粒上构建核心-卫星纳米结构。在加入靶microRNA和燃料DNA后,靶物microRNA直接结合到连接DNA上相应的toehold1序列,引发分支迁移反应,触发50 nm核心金纳米颗粒表面多个13 nm卫星金纳米颗粒的解离,导致核心-卫星纳米结构的解体及光散射信号的改变。暗场图像由DFM的彩色CCD捕获,然后通过计算机、智能手机或云平台进行图像分析,可在1 min内获得microRNA浓度,方法快速,不依赖光谱仪(图6A)。
RGB颜色分析法在应用时也存在一定的问题,如曝光时间影响颜色的变化[37],纳米颗粒自身的颜色背景高,不利于建立灵敏的分析方法。为解决该问题,本小组进一步发展了基于偏振光散射成像的RGB分析法。金纳米棒具有横向和纵向两个截面,首先在纵向侧面上修饰发卡H1,同时在13 nm的AuNPs表面修饰与H1互补的发卡H2,靶物miRNA-21催化H1和H2之间的杂交,使AuNPs偶联到金纳米棒(AuNRs)的侧面,形成核壳卫星结构。然而通常情况下,无论是否存在靶物,核壳卫星结构在DFM下都呈现红色的散射光斑,无法建立灵敏的分析方法,但在DFM光源处加入偏振片,可有效解决该问题。当偏振激发垂直于AuNRs时,由于AuNPs和AuNRs之间的横向耦合,AuNRs的侧向光散射大大增强,使 DFM图像的颜色从绿色变为红色,利用IPP软件分析核壳卫星结构的红光散射百分比变化情况,实现了miRNA-21的灵敏检测,并有效减弱了背景信号(图6B)[9]。

图6 基于RGB颜色变化建立分析方法 Fig.6 The analytical method based on RGB color changeA.principle of algorithm assisted microRNA detection imaging system(算法辅助microRNA检测成像系统原理) [36];B.polarized light scattering assisted RGB color change for microRNA analysis(偏振光散射辅助的RGB颜色变化用于microRNA分析) [9]
3.4 基于暗场单颗粒计数的分析方法
暗场显微镜可以实时获得纳米颗粒光谱、颜色和数量等信息,通过靶物与颗粒数量之间的联系,也可实现生物标志物等的定量检测[38-40]。一方面,该法简单高效,只需统计视野中纳米颗粒的数量即可,摆脱了昂贵的光谱仪的限制;另一方面,该法对实验条件要求较高,为了提高颗粒计数的准确程度,视野中不能存在杂质,否则将影响颗粒的数量,造成统计数据不准确;为了避免颗粒分布不均匀引起的误差,应尽量选取具有统计学意义的区域进行分析[41]。
为了提高计数分析法的效率,北京大学李娜教授课题组于2015年开发了一种基于暗场成像模式自动计数金纳米颗粒的方法(图7A)[39]。首先利用高通滤波消除干扰和脱焦的散射信号,然后根据形状将散射图像分为若干个子图像,每个子图像包含一个识别对象,将形状和颜色判断顺序应用于每个子图像以识别AuNPs,从而计算颗粒数量,并用空白对照和标准AuNPs图像作为色彩校准排除基底的干扰,提高识别的准确度。该法减少了人工计数的劳动量和误差,大大提高了计数的速度和准确度;另一方面,该法具有较高的通用性,可以扩展至其他纳米颗粒。

图7 基于计数法建立的分析方法Fig.7 The analytical method based on countingA.nucleic acid detection by combining automatic gold nanoparticle enumeration with target-induced strand-displacement(基于计数法和链置换反应的核酸检测)[39];B.simultaneous detection of CEA and AFP based on sandwich immune response(于夹心免疫反应的CEA和AFP的同时检测)[24]
这种基于暗场成像的单颗粒计数法可用于多种生物标志物的检测。Li 课题组将磁纳米颗粒上连接的金纳米颗粒通过链置换反应释放到溶液中,经磁力分离后,取上清液,统计视野中的纳米颗粒数量,建立了核酸的快速分析方法,该方法具有普适通用性[42]。清华大学Tan课题组[43]利用计数法实现了T4多核苷酸激酶活性的测定。Xiao课题组发展了一种基于上转换纳米粒子和金纳米颗粒之间发光共振能量转移的单颗粒计数法,实现了溶液中前列腺特异性抗原(PSA)的简单快速分析[44]。
计数法也可应用于多靶物分析。本课题组通过抗原抗体免疫反应形成三明治复合结构实现了两种癌症标志物的分析。先将甲胎蛋白(AFP)和癌胚抗原(CEA)的一抗固定在载玻片上,当AFP和CEA与抗体结合后,进一步特异性识别标记修饰AuNPs的AFP二抗和修饰AgNPs的CEA二抗,通过统计AuNPs发出的绿色散射光斑和AgNPs的蓝色散射光斑数量即可实现CEA和AFP的精准检测(图7B)[24]。
利用计数法进行单靶物识别时,不受纳米颗粒尺寸及形态的限制,同时避免了昂贵的光谱仪,方法方便快速;但在进行多靶物分析时,对纳米颗粒形貌及粒径的要求较为严格,否则杂散的散射信号将导致难以实现多靶物的分别准确定量分析。总体而言,计数法对低密度的纳米颗粒具有较高的灵敏度,但高密度的纳米颗粒易引起聚集,难以准确统计纳米颗粒的数量,不利于建立准确的计数定量分析方法。
3.5 其他单颗粒分析方法的探索
以上4种常用方法各有优势,但也存在着一定的问题,仍需开发新的分析方法。本课题组开发了一种新型时间分辨分析定量方法[45]。AuNRs具有优良的等离子体共振散射特性,在暗场显微镜中呈稳定而较强的红色光散射信号。在Fe3+和硫脲的共同作用下,AuNRs的形貌逐渐由棒状变为梭形,最后成为球形,该过程伴随着散射光的变化,在暗场成像中表现为红色转变为黄色再转变为绿色。由于AuNRs腐蚀后形成的Au[CS(NH)2]2+复合物能够与肝素钠进一步形成络合物,加速AuNRs的腐蚀,本小组基于肝素钠的浓度与AuNRs散射信号由红变绿的时间之间的关系建立了分析肝素钠浓度的方法,该法只需记录AuNRs由红色变为绿色的时间即可,无需额外的数据统计处理,方法简便。
4 总结与展望
暗场显微镜技术由于背景低、敏度高、实时监控[17,46]、检测样品量少等特点,已经被广泛用于定量分析检测。本综述主要从暗场显微成像分析技术入手,讨论了该技术在单颗粒水平上利用等离子体纳米探针建立的定量分析方法。基于等离子纳米颗粒LSPR散射光谱位移、散射强度变化、计数法以及单颗粒颜色变化的分析是近年来暗场显微技术在生化分析领域中主要的定量分析方法。从定量分析的角度来说,这些方法各有优缺点。基于纳米颗粒LSPR散射光谱位移变化的定量方法具有很高的灵敏度和准确度,但昂贵的光谱仪的联用及繁琐耗时的扫谱程序限制了该方法的广泛应用;基于纳米颗粒散射强度变化的方法易受多种因素的影响,除颗粒粒径外,曝光时间等因素的影响不容忽视;单颗粒计数法简单易行且灵敏度较高,但单颗粒计数法存在的固有缺点(如颗粒分布不均)从一定程度上降低了分析的准确程度;而高通量RGB分析方法和对散射光斑强度的定量分析利用计算机软件进行信号处理及数据采集[47-48],更加简单、准确,成本更低,但由于实验微环境等不可控因素,该方法的重现性较差。
尽管暗场显微成像技术趋于成熟,但仍存在重现性差、准确度低、干扰因素多等问题,因此亟需针对该方法提出改进策略。可从以下几个方面进行考虑:(1)将滤光片[49]、偏振片[9]等光学器件引入暗场显微技术,一方面起到消除背景干扰,提高灵敏度的作用;另一方面,将一些在暗场不易区分的颗粒散射光斑区分开来,如偏振成像可有效区分金纳米棒及其组装结构[9]。(2)将暗场光学显微镜与拉曼、电化学或圆二色仪等仪器联合使用,进一步提高时空分辨率和灵敏度,拓展方法的使用范围。(3)充分利用计算机算法[50]、编程技术、计算机软件或数学模型处理繁琐复杂的实验数据,如IPP、Imaging J、主成分分析法等,提高数据处理的效率和准确度。(4)将暗场显微技术与现代科技,如深度学习[51]、云计算、人工智能等结合,开发更加灵敏准确的定量分析方法。(5)外界环境对信号影响较大,需要发展一系列校正方法[37,50],提高方法的准确性和多次成像结果的一致性和重现性。
