功能肽段介导的铜离子荧光传感器的构建及应用
2021-07-02李昕翼冯富岩周晓东胡继明
李昕翼,冯富岩,周晓东,胡继明
(武汉大学 测试中心,湖北 武汉 430072)
铜是人体健康所必要的第三大过渡金属元素,仅次于锌和铁,可在多种生物酶合成过程中作为蛋白的功能辅因子或主要结构组成部分[1],在细胞呼吸、骨骼发育、结缔组织生长等过程中发挥着关键作用,是人体必需的微量元素[2-7]。
2.4 新生儿窒息后发生AKI的COX回归性分析 将尿液减少、Kim-1、Netrin-1、窒息程度纳入COX回归性分析发现,上述因素均与新生儿窒息后AKI发生呈正相关(P<0.05),见表2。
河北省作为全国加快实施最严格水资源管理制度试点之一,为从根本上解决地下水超采问题,按照国家试点工作总体部署,将地下水超采治理作为改善生态环境的三件大事之一,突出重点,抓住关键,全力以赴打好超采治理攻坚战。坚持突出重点、综合施策、强力推进,重点在“节、引、蓄、调、管”五个方面下功夫、作文章、要效益。按照实行最严格水资源管理制度要求和“政府市场协同发力、治理监管同步推进”的思路,凝聚群众智慧,创新发展模式,总结推广经验,敢于碰禁区,敢于先行先试,探索建立有利于水资源可持续利用的体制机制,不断增强治理地下水超采的内生动力。
美国环境保护署(Environmental Protection Agency,EPA)对饮用水中铜离子的含量限值是1.3 mg/L,正常情况下土壤或地表水中铜离子的含量范围为0.005~30 μg/L。由于铜离子重要的生理功能及其水平失衡所造成的严重病理反应,人们对环境水样及生物样品中铜离子含量的检测进行了诸多研究。Ndokoye等[8]通过Au—S键在合成的星状金纳米材料(AuNSs)表面修饰半胱氨酸分子(Cys-AuNSs),借助铜离子与半胱氨酸分子上氮、氧原子配位引起AuNSs聚集所产生的表面增强拉曼光谱响应信号(SERS)实现了对铜离子的定量检测。Zhao等[9]设计了一非对称纳米通道/离子通道混合耦合器,基于电化学方法实现了对血液中铜离子的检测。在该工作中,多孔氧化铝所提供的纳米通道表面修饰了多聚谷氨酸(PGA),铜离子经过时由于与谷氨酸上的氧、氮原子配位而使通道内的电化学信号发生改变,基于此可实现对铜离子的定量检测。Liu等[10]利用红蓝双色碳量子点(CDs)基于特定的光能量转移设计了铜离子比率荧光检测试纸,实现了对铜离子的半定量检测。类似的,硒化镉量子点也被用于自来水中铜离子的超灵敏检测[11]。诸如此类的检测方法不胜枚举,但对于实际检测而言均具备一定的局限性。如借助半胱氨酸、多聚谷氨酸与铜离子配位的方法中,氨基酸对金属离子的选择性低,在进行实际样品检测时其他金属离子的干扰难以避免。另外,CdSe/ZnS量子点(QDs)、CDs等纳米材料的应用,在显著提高检测灵敏度的同时也增加了检测过程的复杂性,检测中还会存在其他重金属离子的引入和间接污染。因此,对环境及生物样品中铜离子的最佳检测方法尚有待探究。
人们在对因铜离子失衡所引起的相关神经性疾病(如阿尔兹海默症、帕金森病)[12-13]的研究中发现,淀粉样蛋白在神经系统中发挥着重要作用,同时淀粉样蛋白的累积与神经性疾病的相关性也通过一定的转基因动物模型得到进一步证实[14-15]。相关铜蛋白的多样结构为对应肽段的设计和筛选提供了充足的资源,例如基于淀粉样蛋白的Aβ系列肽段。研究发现,多肽分子凭借丰富的结构组成和可变的结构特征,在生物分析、金属离子检测等领域表现出巨大的潜力[16-17]。Li等[18]建立了一种基于多肽RFPRGGD-金纳米粒子体系快速检测银离子的方法。利用多肽中精氨酸与金纳米粒子之间的静电吸力实现多肽的修饰,多肽另一端带负电的天冬氨酸则会因与金纳米粒子之间的静电斥力起到稳定作用。当银离子存在时,精氨酸的氨基和天冬氨酸的羧基会与其发生四配位,从而诱导多肽的构象发生折叠,致使金纳米粒子团聚,以此实现对银离子的高效检测。
为了判断5条肽段对铜离子亲和能力的大小,分别将其与铜离子溶液混合孵育并进行MALDI-TOF MS质谱分析。结合数据发现肽段P5(DDAEGHARHCR)对铜离子表现出较强的亲和力,其余肽段也对铜离子表现出一定的亲和性,但丰度较低(图1)。由此,本实验设计并筛选出多肽P5作为识别铜离子的功能肽段。
2.2.1体系pH值的优化pH值对整个反应体系的影响很大,主要体现在两个方面,首先就钙黄绿素而言,不同的环境pH值对其荧光强度有一定的影响,这与钙黄绿素分子的4个羧基及两个六元环上的羟基有关;另外,对于多肽分子,不同氨基酸序列肽段的等电点不同(本实验所设计的肽段等电点为6.49),在不同的环境酸度下表现的电性有所不同,整个多肽分子的电子密度也有所变化,表现出的与正电荷金属离子的亲和性也有所不同。因此考察了体系pH值对实验的影响。从图4A可以发现,在偏酸性的溶液环境下,钙黄绿素的荧光强度相对较低,这与钙黄绿素分子内的电子传导有关,其在pH 7.0左右表现出最强的荧光信号。图4B是环境pH值对体系荧光恢复效率的影响。在溶液pH值低于或接近多肽分子等电点时,多肽分子呈现正电性或电中性,此时肽段在接近金属阳离子时会表现出一定的静电排斥力,该斥力会影响多肽与金属离子的结合效率;当pH值大于多肽等电点时,肽段整体带负电,可与金属阳离子因静电引力的辅助作用实现更高效的结合,荧光恢复效率上升。综合钙黄绿素与多肽分子受pH值的影响情况,以及文献中对钙黄绿素溶液的配制方案[22],确定实验的最佳pH值为7.0左右。
1 实验部分
1.1 仪器与试剂
渗沥液产生量受地表降水、地下水以及垃圾自身降解特性的影响,地表水对渗沥液产生量的影响可以通过雨污分流措施加以控制,而地下水的影响则可以通过防渗衬垫系统加以隔离,但在没有防渗处理措施的填埋场中,地下水和渗沥液的影响是相互作用的。对简易垃圾场的渗沥液迁移问题,必须首先掌握场区地下水渗流场分布情况,其次分析渗沥液的扩散路径与范围,最终确定柔性垂直防渗墙的合理阻隔位置[3]。
钙黄绿素、氯化铜、硝酸锌、氯化钾、硝酸钴、氯化钙、硝酸锰、氯化铁、氯化镍、无水乙醇、二水合磷酸二氢钠、十二水合磷酸氢二钠、磷酸均购于北京国药集团。实验用多肽(P1:Asp-Ala-Glu-Phe-Gly-His-Ala-Arg-His-Arg;P2:Asp-Asp-Ala-Glu-Gly-His-Ala-Arg-His-Arg;P3:Asp-Asp-Ala-Glu-Phe-Gly-His-Ala-Arg-His-Arg;P4:Asp-Asp-Ala-Glu-Phe-Gly-His-Arg-His-Arg;P5:Asp-Asp-Ala-Glu-Gly-His-Ala-Arg-His-Cys-Arg)由南京杰肽生物科技有限公司合成。10 mmol/L 磷酸盐缓冲溶液 (PB);按浓HCl与浓HNO33∶1的体积比配制王水。
1.2 溶液配制
稳定的作物经济状况以及良好的种植条件促进了巴西种植的快速开始。有分析师认为未来巴西大豆面积将增加3%至5%,玉米面积将增加5%以上。
用10 mmol/L pH 7.4的PB缓冲溶液配制1 mmol/L的钙黄绿素溶液,冰箱4 ℃保存。氯化铜标准溶液由超纯水配制,并通过梯度稀释方法稀释至不同浓度。10 mmol/L不同pH值的PB缓冲溶液配制方法如下:分别配制100 mmol/L的磷酸氢二钠和磷酸二氢钠溶液100 mL,按不同体积比将两种磷酸盐溶液混合均匀,使用pH计检测缓冲溶液的实际pH值,并通过两磷酸盐溶液对pH值进行微调。所得缓冲溶液按1∶10体积比稀释。
1.3 铜离子检测
配制0~15 μmol/L的铜离子溶液,钙黄绿素浓度恒定为80 μmol/L,将不同浓度的铜离子溶液与钙黄绿素溶液混合5 min,待铜离子反应完全,检测荧光信号(F1);加入1.5倍物质的量的多肽分子,反应22 min。待反应完全后检测荧光恢复信号(F2)。取自来水在空气中静置2 h,代替铜离子溶液重复上述实验,检测自来水中的铜离子含量。取东湖水经0.22 μm滤膜过滤,代替铜离子溶液重复上述实验,检测湖水中铜离子的含量。
2 结果与讨论
2.1 实验设计及原理
识别元件的选择是传感设计的关键。大量文献证实,基于铜蛋白的功能肽段淀粉样蛋白肽对铜离子表现出一定的亲和性,通过一系列亲和系数的计算筛选出的mAβ16肽段(DAEFGHDSGFEVRHQK)具有最高的结合能力[16]。研究表明,由于铜离子体积较小,该肽段与铜离子结合时易发生构型折叠,部分区域相邻或相间氨基酸可同时与铜离子成键。其成键原子分别为天冬氨酸(Asp)氨基氮原子、丙氨酸(Ala)羰基氧原子、甘氨酸(Gly)肽键氮原子、组氨酸(His)咪唑环内氮原子以及Asp、谷氨酸(Glu)4个氨基酸残基上的某个羟基氧原子[16]。基于mAβ16肽段与铜离子相互作用的结构特征与配位点,本实验通过保留二者的作用位点与结合模型,同时更改其余氨基酸的排布方式,设计出5条能与铜离子特异结合的功能肽段,依次命名为P1~P5,具体序列如“1.1”所示。

图1 P5与铜离子的MALDI-TOF MS质谱图Fig.1 MALDI-TOF MS spectrum of the mixtures of P5 and Cu(Ⅱ)
本文通过对淀粉样蛋白肽结构与功能位点的分析,设计并筛选出铜离子高亲和性的功能肽段[19-21]。针对早期铜离子对部分荧光素的荧光猝灭作用,选用钙黄绿素(Calcein)作为荧光探针,借助功能肽段对铜离子的高特异性结合作用并能夺取Calcein-Cu(Ⅱ)的性质,设计了检测铜离子的荧光恢复型传感器[22]。通过基体辅助激光解吸电离源-飞行时间质谱(MALDI-TOF MS)对Cu(Ⅱ)-Peptide 配合物进行了表征分析,并进一步通过质谱分析证实了样品的选择性。通过对体系pH值、反应温度、钙黄绿素浓度、反应时间等条件的优化,实现了对环境水样中铜离子的高特异性检测。
生长过程中所需要的氮元素很大部分由根瘤菌提供,但仍需要从土壤中吸收大量的各种元素供其生长,缺素不仅会造成植株生长差、植株弱化、结荚少、病害多、病害重,导致产量低。不同生育期所吸收的养分数量也有所不同。其生长前期需肥量较少,花荚结实期,吸收养分的数量最多,此期所吸收的氮元素占全生育期的48%,磷占60%,钾占46%。此阶段养分不足,会造成减产减质。尤其是缺乏钾、磷元素的供应,会造成严重的减产。另外,在适时适量的满足蚕豆对氮、磷、钾三大主肥需求的同时,还要及时补施硼、钼等微肥,以确保产量和品质。
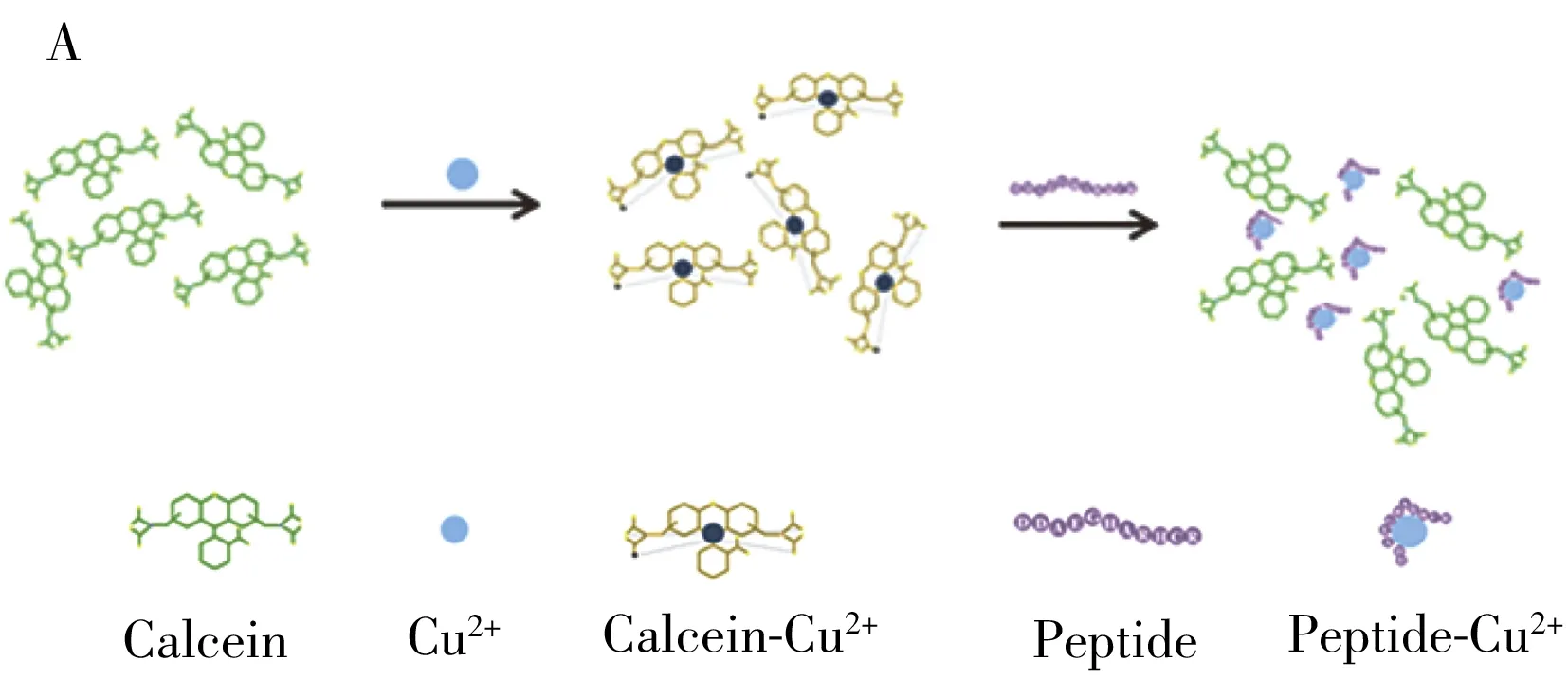
图2 钙黄绿素-多肽体系荧光检测铜离子的传感原理图(A)和反应前后的荧光变化(B)Fig.2 Schematic diagram of fluorescence-based calcein-peptide assay for Cu(Ⅱ)(A)and fluorescence signals change(B)
为了考察方法的可行性,通过MALDI-TOF MS分析了Na(Ⅰ)、Mg(Ⅱ)、K(Ⅰ)、Ca(Ⅱ)、Mn(Ⅱ)、Fe(Ⅲ)、Co(Ⅱ)、Ni(Ⅱ)、Zn(Ⅱ)9种常量、微量金属元素与多肽分子的亲和性。一定量的多肽分子与相当物质的量的9种金属离子混合液孵育60 min,质谱数据如图3A所示。9种金属离子和肽段均无可识别性的配位结合。当向金属离子混合液中加入铜离子时,可发现明显的分子离子峰(图3B),且相对丰度较高,说明该肽段与铜离子结合具有很强的靶向性和亲和性。钙黄绿素作为钙的指示剂与钙离子结合较为稳定,且不能通过EDTA(乙二胺四乙酸)掩蔽,为此考察了钙离子对体系的干扰情况。如图3C和图3D所示,在钙黄绿素溶液中加入等物质的量的钙离子,荧光强度有20%的增加,在该体系中继续加入等物质的量的铜离子,荧光很快猝灭,说明钙离子的加入不会干扰Calcein-Cu(Ⅱ)的生成。随后在该溶液中加入多肽分子,荧光逐渐恢复。结合多肽与钙黄绿素的浓度比估算得到荧光恢复率为80%,说明钙离子的引入并未造成明显的干扰。由此可见,肽段的设计成功地避免了钙黄绿素与其他金属离子结合致使荧光强度改变而对体系造成的干扰,同时Cu2+之处的其他金属离子与钙黄绿素的结合未对多肽配位效率产生影响,说明该方法具有较好的选择性。

2.2 实验参数的优化
黄庭坚(1045-1105),字鲁直,号山谷道人,晚号涪翁,洪州分宁(今江西修水县)人。宋英宗治平四年(1067)中进士,时年22岁。历官县尉、知县、知州、校书郎、秘书丞、国史馆编修等。与苏轼亦师亦友,以诗与书法闻名。
荧光分光光度计(F-4600,日本日立公司),紫外-可见吸收光谱仪(UV-2550,日本岛津公司),超纯水仪(Millipore Direct-Q3,德国默克密理博公司),MALDI-TOF MS质谱仪(AB 5800,美国爱博才思公司)。
本实验的设计原理是基于Cu(Ⅱ)对钙黄绿素(Calcein)的荧光猝灭作用,借助功能肽段特异性捕获铜离子而使荧光恢复来检测Cu(Ⅱ)。钙黄绿素是一种橙黄色固体粉末,溶于水呈黄色并显绿色荧光,遇铜离子荧光猝灭。由于钙黄绿素可与多种金属离子结合,使得其他金属离子对检测体系干扰严重。本文创新性地设计了可对铜离子特异性结合的肽段,实现了对Calcein-Cu(Ⅱ)配合物中Cu(Ⅱ)的捕获,钙黄绿素作为可化学发光的荧光分子将在肽段夺取铜离子后恢复荧光。根据荧光恢复强度差值(F2-F1)即可实现对铜离子的特异性定量检测(图2)。
2.2.2反应温度的优化一般情况下,温度主要影响化学反应的速率。本实验对反应温度的优化主要考虑两个因素:一是钙黄绿素的荧光信号会因分子碰撞等因素发生猝灭,因此反应温度不宜过高;二是多肽作为生物分子,需具备合适的温度环境,较低的环境温度将直接影响肽段与金属配位的化学反应效率。如图4C所示,钙黄绿素低温下的荧光强度相对较低,在25 ℃时荧光响应信号最高,继续升温至30 ℃时存在一定的分子荧光猝灭。多肽分子的荧光恢复效率受温度的影响如图4D所示,其在20~25 ℃范围内的荧光恢复效率最高。结合钙黄绿素分子自身荧光强度受温度的影响情况,选定25 ℃为最佳反应温度。
2.2.3钙黄绿素浓度的优化对浓度分别为10-7~10-3mol/L的钙黄绿素溶液进行荧光分析,结果如图4E所示。在钙黄绿素浓度低于10-5mol/L时,荧光响应信号较低。当浓度大于10-4时荧光信号出现一定程度的自猝灭且荧光发射光谱出现了一定程度的蓝移(蓝移原因尚未查明)。当钙黄绿素的浓度保持在10-5~10-4mol/L时,溶液表现出最高的灵敏度。因此后续实验选择钙黄绿素检测的最终浓度为10-5~10-4mol/L范围。
2.2.4反应时间的优化本实验中,钙黄绿素分子结合铜离子的荧光猝灭瞬间发生,这与分子间的能量传递有关。由于与铜离子间较强的亲和性,多肽分子会夺取calcein-Cu(Ⅱ)配合物中的Cu(Ⅱ)形成peptide-Cu(Ⅱ)配合物,钙黄绿素分子被释放因而荧光信号恢复。考察了肽段加入后的反应动力学,以荧光强度作为参考值,以2 min 为取样间隔,采集每个时间点的荧光恢复数据,结果如图4F所示。发现22 min时荧光达到最大值,并在20~25 min前后保持相对稳定。因此确定肽段夺取Cu(Ⅱ)的稳定时间为22 min。

2.3 铜离子的检测
在优化条件下,考察了不同浓度的Cu(Ⅱ)对钙黄绿素溶液的荧光猝灭作用,平行测定3组。铜离子与钙黄绿素反应迅速,将铜离子溶液加入到钙黄绿素溶液中反应5 min后检测该Cu(Ⅱ)-calcein体系的荧光强度,发现随着铜离子浓度的增加荧光强度逐渐降低(图5),说明随着铜离子浓度的升高,发生荧光猝灭的calcein-Cu(Ⅱ)配合物逐渐增加,并得到随Cu(Ⅱ)浓度(x)变化钙黄绿素荧光强度(y)梯度降低的标准曲线为:y=-248.45x(μmol/L)+3 994.12,相关系数R2=0.998。由于钙黄绿素可与多种金属离子结合产生荧光增强或猝灭,进行实际检测时,生活用水中的Ca(Ⅱ)、Mg(Ⅱ)等离子均会对其荧光强度产生干扰。本实验引入的对Cu(Ⅱ)具有特异性捕获功能的肽段P5可使荧光恢复到一稳定值。基于荧光强度恢复的平均值F2与相应的各铜离子浓度(x)对应的荧光强度猝灭值F1的差值(y),构建的铜离子检测的标准曲线为:y=249.42x(μmol/L)+470.36,线性范围为0.12~13 μmol/L(R2=0.995),检出限为127 nmol/L。

图5 不同铜离子浓度下钙黄绿素-铜离子体系的荧光光谱图Fig.5 The fluorescence spectra of calcein-Cu system in different concentrations of Cu(Ⅱ)
根据国家环境安全标准中Cu(Ⅱ)的限定浓度1 mg/L(15.74 mmol/L,EPA标准),该方法可满足日常生活用水及环境水中铜离子的定量检测要求。基于本文建立的方法,将加标处理后的自来水及湖水实际样品按照Cu(Ⅱ)标准溶液检测方法加入到钙黄绿素溶液中,保持5 min,检测其荧光信号F1,加入肽段22 min后检测其荧光信号F2,根据荧光恢复情况实现了对水样中铜离子检测,结果见表1。为了证实方法的准确性,通过原子吸收光谱法(AAS)进行验证。AAS法所得结果与本实验方法基本吻合(表1),说明该方法具有较好的实用性。

表1 实际样品中铜离子检测数据Table 1 The results of Cu(Ⅱ) detection in practical samples
3 结 论
本工作设计了一种基于特定多肽的荧光恢复型铜离子生物传感器。依据生物体内淀粉样蛋白与Cu(Ⅱ)的特异性作用,设计了一系列可与Cu(Ⅱ)靶向作用的功能肽段P5。该肽段可快速夺取Calcein-Cu(Ⅱ)络合物中的Cu(Ⅱ)并与其形成稳定的配合物,同时促使Calcein荧光信号恢复,从而实现对Cu(Ⅱ)的定量检测。方法成功避免了其他金属离子对铜离子检测的干扰,改善了已有报道中氨基酸荧光信号恢复而伴随的荧光稳定性差且选择性低等局限,增加了检测的准确度与可靠性。该方法简单、快速、稳定、选择性强,线性范围为0.12~13 μmol/L,检出限为127 nmol/L,可满足地表水及生活用水的正常检测要求。
