一种基于微芯片电泳平台的级联化学发光信号放大策略用于HIV-DNA的高灵敏检测
2021-07-02赵书林
钟 洁,赵书林
(广西师范大学 化学与药学学院,药用资源化学与药物分子工程省部共建国家重点实验室,广西 桂林 541004)
人类免疫缺陷病毒(Human immunodeficiency virus,HIV)即艾滋病病毒,它通过破坏辅助性的T淋巴细胞,并使体内的多种免疫细胞受到损害,最终引起各种机会性感染和肿瘤的发生。艾滋病(ADIS)也称为获得性免疫缺陷综合征,HIV不仅仅会侵蚀细胞,无视抗体甚至会助发癌变夺走人的生命,所以,艾滋病是目前全球范围内造成人类死亡的主要病因之一[1]。自HIV被发现以来,它已经吸引了越来越多的科学家致力于如何预防和治疗艾滋病。
HIV感染可通过检测病毒的抗体、抗原、核酸确定,其中HIV抗体或抗原检测是最常用的检测方法,它是诊断艾滋病病毒感染和艾滋病的主要指标和标准检测项目。常见的HIV抗体或抗原检测有酶联免疫吸附试验[2-3]、免疫荧光分析[4-6]和ADIS测试纸[7-10]等。人感染HIV病毒后,会在体内不断复制并产生大量HIV病毒,该过程要先于体内对HIV的识别和产生免疫反应(抗体抗原的产生等)。因此,在3~12周的窗口期间很难通过上述方法准确检测HIV抗体或抗原,这将会导致病毒的传播与恶化,使患者在不知道感染的情况下错过最佳治疗时间[11]。对于绝大多数HIV感染者,只要HIV病毒在体内开始复制(6~14 d),血液中就会有相应的病毒基因存在,通过核酸检测方法即可检出。与检测HIV抗体、抗原相比,艾滋病病毒基因(HIV-DNA)可以更早地检出[12],从而较早获得艾滋病的阳性检测结果。目前,用于HIV-DNA检测的分析方法有电化学[13-15]和荧光[16-18]分析方法等,但由于HIV感染初期的含量非常低,这些方法难以准确测定。为了更早更准确获得检测结果,构建灵敏、快速、有效的HIV-DNA检测方法对于艾滋病早期诊断具有重要意义。
本研究基于微芯片电泳-化学发光检测(MCE-CL)平台,建立了一种高灵敏检测HIV-DNA的新方法,与其它HIV-DNA检测方法[19-21]相比,该方法具有更高的灵敏度,将其用于实际人血清中痕量HIV-DNA的测定,结果令人满意。
1 实验部分
1.1 试剂与仪器
实验所用DNA片段和标记HRP的DNA序列,以及标记FAM的DNA序列均为自行设计并由大连宝生物公司合成,合成的DNA均为HPLC纯级,序列设计如下:HIV-DNA:5′-ACTGCTAGAGATTTTCCACAT-3′;P1:5′-ATGTGGAAAATCTCTGAGTCTTCCAGTGTGAAAA-3′;P2:5′-TTTTTTTTCACACTGGAAGACTC-3′;2-HRP:HRP-DNA-GAGTCTTCCAGTGTGTGGGTTTTGGATTTT-3′;FAM-DNA:5′-FAM-GAGTCTTCCAGTGTGTGGGTTTT GGATTTT-3′;T1:5′-ACTGCTAGAGATTTTCCAGAT-3′;T2:5′-ACTGCTAGAGATTTTCCTGAT-3′;T4:5′-ACTGCTAG AGTTTATCCTGAT-3′;Tn:5′-CAGTAGCTGTCGGCGATAAGC-3′。
MCE-CL检测系统为实验室自制[22-23],微流控芯片购自大连拓微芯片技术有限公司,为玻璃/玻璃双T型化学发光检测芯片,其结构如图1所示。芯片面积为8.5 cm×2.6 cm,通道顶部宽为70 μm(柱后氧化试剂传输通道和检测通道为250 μm),深度为25 μm,截面为弧形,有效分离通道长为5.0 cm。S为样品池,SW为样品废液池,S与SW两池距离分离通道均为5 mm,B为电泳缓冲液池,距离双T交叉点为5.0 mm,双T型交叉处的间隔为60 μm。

图1 玻璃/玻璃双T型化学发光检测芯片的构造示意图Fig.1 Structure of glass/glass double T chemiluminescence detection chipS:sample reservoir(样品池),B:electrophoresis buffer solution reservoir(电泳缓冲液池),SW:sample waste reservoir(样品废液池),BW:buffer waste reservoir(缓冲废液池),R:post-column oxidizer reservoir(柱后氧化剂池)
1.2 溶液配制
DNA储备液:将装有DNA冻干粉的离心管置于离心机中,以12 000 r/min离心5 min。离心结束后将DNA链溶于1.0×10-2mol/L Tris-EDTA(pH 8.0)中制备终浓度为5.0×10-5mol/L的储备液,于冰箱内在4 ℃环境下静置24 h后分装到各小离心管中,于-20 ℃冷冻储存。
Tris-HCl缓冲溶液:2.5×10-2mol/L Tris-HCl溶液(pH 7.4),含2×10-2mol/L KCl及0.2 mol/L NaCl。
电泳缓冲溶液:3×10-2mol/L的Na2B4O7溶液(pH 9.3),含2×10-2mol/L十二烷基硫酸钠(SDS)和1.2×10-3mol/L鲁米诺。
柱后氧化试剂溶液:3.5×10-2mol/L NaHCO3缓冲溶液(pH 9.5),含0.12 mol/L H2O2和1.0×10-3mol/L 对碘苯酚(PIP)。
1.3 信号放大反应
在反应管中加入2 μL P1/P2复合物(1.0×10-7mol/L)、1 μL HIV-DNA、1 μL 10×Buffer4 和6 μL H2O,于37 ℃恒温振荡水浴锅中反应1 h,随后加入2 μL HRP-DNA(2.0×10-7mol/L)和3 μL T7Exo(10 U/μL)。混合均匀后,将其于37 ℃恒温振荡水浴锅中反应1 h后继续反应80 min。酶切辅助靶标双循环反应结束后,加入35 μL Tris-HCl缓冲溶液定容至50 μL,供MCE-CL分析。
1.4 血清样品制备
正常人血清样品取自桂林市第五人民医院。检测HIV-DNA时,将溶于水的HIV-DNA加至血清中作为阳性样品,然后按“1.3”方法进行信号放大反应。
1.5 微流控芯片电泳化学发光检测
电泳芯片首次使用前依次用1 mol/L NaOH溶液和去离子水冲洗30 min,每次实验前需对芯片进行活化处理,两次电泳之间分别用0.1 mol/L NaOH溶液清洗8 min,去离子水清洗5 min。采用夹流方式进样,进样阶段在S池上施加500 V电压,SW池接地,B池和BW池分别施加250 V和400 V电压,R池悬空,进样时间20 s;随后进入分离阶段切换各路电压,B池施加2 400 V作为分离电压,S和SW各施加1 500 V电压作为反拉电压,而BW池接地,同时R池中施加500 V电压。利用电压驱动进样,再通过电渗流的作用使得样品组分在分离通道中以不同的速率迁移至Y型交叉处,与发光试剂混合产生化学发光,利用PMT收集化学发光信号,最终光信号经光电转换器转换后由计算机记录。
2 结果与讨论
2.1 方法的设计与原理
基于微芯片电泳的在线分离功能,可在极其短时间内有效分离待测物的特点,将HRP催化鲁米诺-H2O2化学发光,PIP增敏和T7Exo辅助信号放大技术联用,设计了一种基于MCE-CL平台的T7Exo辅助双循环化学发光信号放大方法,原理如图2所示。
首先将P1、P2两条DNA单链按照1∶1的比例在95 ℃下加热5 min,再自然冷却至室温形成稳定的P1/P2双链复合物。当靶标不存在时,由于P1/P2双链复合物的熔链温度设计高于P2与HRP-DNA杂交的熔链温度,HRP-DNA不能将P1置换下来,因此,此时不能形成P2/HRP-DNA双链,即使加入T7Exo酶后体系中也不存在HRP标记的单核苷酸片段。但当靶标HIV-DNA存在时,可形成P1/P2/HIV-DNA三元复合物,此时P1的5′末端(绿色部分)形成平末端,加入T7Exo可以特异性地沿5′→3′方向降解P1/P2/HRP-DNA三元复合物双链,释放的HIV-DNA序列则重新与P1/P2双链复合物杂交,T7Exo继续降解切割三元复合物,并释放P2单链(蓝色部分)。P2单链与HRP-DNA可以部分杂交形成P2/HRP-DNA双链,加入T7Exo后,探针DNA(HRP-DNA)链被降解,而与其杂交的P2序列重新与HRP-DNA杂交,T7Exo继续降解。如此循环,靶标HIV-DNA可产生大量信号分子,经过双循环过程可实现超灵敏的目标信号放大。由于加入的HRP-DNA过量,因此整个循环反应结束后,体系中存在大量HRP标记的单核苷酸片段和过量的HRP-DNA,两者均可催化H2O2氧化鲁米诺反应产生化学发光。为实现对目标分子的信号放大,利用MCE-CL对HRP标记的单核苷酸片段和过量的HRP-DNA进行分离。由于两者分子量不同,在电泳图中产生一前一后两个峰,根据HRP标记的单核苷酸片段峰高的变化,可以实现对HIV-DNA的定量分析。
为了验证方法原理的可行性,实验对3种含有不同组分的试样进行了MCE-CL分析。结果显示:当样品溶液中不含靶标HIV-DNA时,电泳图中仅出现一个电泳峰。存在靶标HIV-DNA时,电泳图中出现了两个电泳峰。随着HIV-DNA浓度的增加,切割并释放HRP标记的单核苷酸片段的量也随之增多,其HRP标记的单核苷酸片段的相应峰高也随着增加。由此证明了出现在上游的峰为HRP标记的单核苷酸片段的电泳峰,根据该峰的峰高或峰面积可实现HIV-DNA的定量分析。
2.2 凝胶电泳分析
为了进一步考察方法可行性,证实P1/P2双链复合物与HIV-DNA的结合以及加入T7 Exo后所引发的链剪切反应,设计了相应的凝胶电泳实验(图3)。通道1和2中的样品分别为HIV-DNA和HRP-DNA。由于HRP标记DNA改变了DNA的凝胶迁移速率,因此通道2出现了HRP-DNA停留在点样孔的拖尾色带。通道3中样品为P1/P2的反应产物,亮度较亮是因为两者结合形成新的复合物,而荧光染料SYBR Green I与双链DNA的亲和力非常高导致染色效果明显。由于HRP分子量比P1/P2双链复合物大,条带移动较慢,所以HRP-DNA的条带位置比该复合物滞后。通道4中的样品为P1/P2复合物和HRP-DNA的混合溶液,条带的移动情况与通道3基本一致,表明HRP-DNA并不能把P1从P1/P2中置换出来。通道5中的样品为P1/P2/HIV-DNA复合物,发现其条带位置稍微后移。由于两者分子质量相差不大,所以条带的位置和亮度变化并不大。通道6中的样品为T7Exo、HRP-DNA和P1/P2双链复合物的混合溶液,由于HRP-DNA滞留在点样孔,未观察到明显条带,P1/P2双链复合物条带仍然存在说明T7Exo不能与P1/P2复合物作用。通道7中为HIV-DNA存在的情况下,T7Exo、HRP-DNA、P1/P2 和HIV-DNA的反应混合物的条带,发现T7Exo不能与P1/P2作用,而能与P1/P2/HIV-DNA复合物作用,即HIV-DNA触发了整个循环放大反应,但反应后的HIV-DNA与P1都不能呈现明显的色带。

图3 琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis1.HIV-DNA;2.HRP-DNA;3.P1/P2 double-stranded complex(P1/P2双链复合物);4.HRP-DNA+P1/P2 double-stranded complex;5.P1/P2 double-stranded complex+HIV-DNA;6.T7Exo+HRP-DNA+P1/P2 double-stranded complex;7.T7Exo+HRP-DNA+P1/P2 double-stranded complex+HIV-DNA;8.HIV-DNA;9.FAM-DNA;10.P1/P2 double-stranded complex;11.FAM-DNA+P1/P2 double-stranded complex;12.P1/P2 double-stranded complex+HIV-DNA;13.T7Exo+HRP-DNA+P1/P2 double-stranded complex;14.T7Exo+HRP-DNA+P1/P2 double-stranded complex+HIV-DNA;concentrations of HIV-DNA,HRP-DNA,P1,P2 and AM-DNA were 3.0×10-6 mol/L,the amount of T7 Exo was 80 U(HIV-DNA、HRP-DNA、P1、P2和FAM-DNA浓度均为3.0×10-6 mol/L,T7 Exo用量为80 U)
为进一步验证整个体系的链结合和酶切循环情况,将HRP-DNA的HRP换成FAM,即FAM-DNA。通道8中的样品为HIV-DNA,通道9中的样品为FAM-DNA,两通道的电泳结果与通道1相同,均未呈现明显的色带。通道10为P1/P2双链复合物,通道11为FAM-DNA和P1/P2双链复合物的混合样品,两者的电泳结果基本相同,均为P1/P2双链复合物的色带。通道12为P1/P2双链复合物与HIV-DNA的混合样品,由于形成了P1/P2/HIV-DNA复合物,导致色带位置稍微后移。通道13为T7Exo、FAM-DNA和P1/P2的混合物,电泳图中也仅呈现P1/P2双链复合物的条带,说明T7Exo不与P1/P2复合物作用。这是由于实验设计的P1/P2复合物中P2的5′端是伸出的末端,不能被T7Exo切割。通道14为HIV-DNA、T7Exo、FAM-DNA、P1/P2和HIV-DNA混合物,通道中未呈现明显的色带说明T7Exo不与P1/P2复合物作用,但可与P1/P2/HIV-DNA复合物作用,即HIV-DNA触发了整个循环放大反应,而反应后的HIV-DNA与P1均未见明显的色带。凝胶电泳分析结果进一步证明了本研究方法原理的可行性。
2.3 实验条件的优化
为了实现基于MCE-CL平台对HIV-DNA的高灵敏准确定量,对影响电泳分离和化学发光的实验条件进行了优化。结果表明,电泳分离电压对于MCE的分离影响较大,分离电压过大时,会产生焦耳热,溶液出现大量气泡而呈现干扰峰,且基线不平稳。但如果电压过小,分离时间变长,且电泳峰展宽严重。为获得最佳的分离度(Rs),同时避免产生基线噪音和峰展宽及干扰峰等现象,优化后的分离电压为2 400 V。
羟丙基甲基纤维素(HPMC)、吐温-80和SDS等可作为添加剂改善MCE的分离效果。在本实验中,虽然HPMC分离效果更佳,但因HPMC粘度较大,清洗不完全易堵塞芯片通道,而使用吐温-80作为添加剂时,出现出峰时间不稳定的现象,因此采用SDS为添加剂以改善分离效果,优化的SDS浓度为2×10-2mol/L。另外,采用硼砂溶液为电泳缓冲剂溶液时,其浓度和pH值分别为3×10-2mol/L和9.3时,可获得最佳分离效果。
实验还考察了化学发光反应和信号放大反应的反应条件。结果表明,在化学发光反应中,鲁米诺、H2O2和PIP的浓度分别为1.2×10-3、0.12、1.0×10-3mol/L,柱后氧化剂溶液pH值为9.5时,体系的化学发光强度最大。在信号放大反应中,HRP-DNA 的浓度和T7Exo的用量分别为8×10-8mol/L和30 U,反应时间为140 min时,放大反应的效果最好,灵敏度最高。
2.4 HIV-DNA检测的校准曲线、线性范围及灵敏度
优化条件下对一系列不同浓度的HIV-DNA标准溶液进行分析。结果显示,HIV-DNA的信号峰强度(Y)与HIV-DNA浓度的对数值(X)在1.0×10-14~5.0×10-9mol/L范围内呈良好的线性,线性方程为Y=2.191 5X+12.693 2,相关系数(r2)为0.997 5。以3倍信噪比(S/N=3)计算得HIV-DNA的检出限(LOD)为1.6 ×10-15mol/L。
2.5 特异性考察
分别对单碱基错配的DNA(T1)、双碱基错配的DNA(T2)、四碱基错配的DNA(T4)、全部碱基错配的DNA(Tn)(浓度均为5×10-10mol/L)和靶标HIV-DNA(8×10-8mol/L)序列进行检测,以评估方法的选择性。结果显示,仅靶标HIV-DNA存在时,HRP标记的单核苷酸峰高(化学发光强度)才显著增强,而在相同实验条件下,全部碱基错配的DNA未能引起HRP标记单核苷酸的峰高发生明显变化,其余碱基错配DNA的化学发光强度随错配碱基数的增多而降低,表明本方法具有较高的特异性。
2.6 血清样品分析
采用本方法对采集自桂林市第五医院的正常人血清样品进行HIV-DNA测定,并进行加标回收实验(图4)。结果显示,正常人血清样品的电泳图(曲线a)中仅出现一个电泳峰,表明样品中不含有HIV-DNA;添加一定量HIV-DNA后,电泳图中出现一个新的信号峰(曲线b),且随着HIV-DNA浓度的增大而增高(曲线c)。在0.10、0.25、1.0、10(×10-12mol/L) 4个加标浓度下,HIV-DNA的回收率为93.0%~103%,相对标准偏差(RSD)为0.50%~3.7%,表明本方法具有良好的准确度,具有应用于艾滋病早期诊断的潜力。
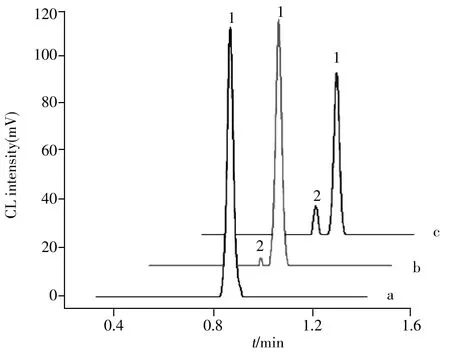
图4 正常人血清中HIV-DNA加标测定的电泳图Fig.4 Electropherograms for the detection of added HIV-DNA in normal human serum1:HRP-DNA;2:electrophoretic peak for HRP labeled single nucleotide fragment(HRP标记的单核苷酸片段的电泳峰);a:electropherogram for normal human serum(正常人血清电泳图);b:electropherogram for normal human serum added 1×10-13 mol/L HIV-DNA(正常人血清添加1×10-13 mol/L HIV-DNA电泳图);c:electropherogram for normal human serum added 1×10-11 mol/L HIV-DNA(正常人血清加入1×10-11 mol/L HIV-DNA电泳图)
3 结 论
本研究建立了一种基于微芯片电泳平台的级联化学发光信号放大策略用于HIV-DNA高灵敏检测的分析方法。通过对靶标HIV-DNA的信号进行双循环放大,实现了对HIV-DNA的超灵敏检测。将信号放大反应体系引入MCE-CL平台可在短时间(60 s)内对反应后的混合物进行快速有效分离。本方法具有仪器结构简单、检测速度快、灵敏度高、特异性好和操作方便等优点,可用于复杂生物样品中微量HIV-DNA的检测,为发展高灵敏度的MCE-CL方法提供了一种新途径,并具有应用于艾滋病早期诊断的潜力。
