1-萘酚诱导人血清白蛋白和牛血清白蛋白构象的变化
2021-07-02李梦硕朱亚先
李梦硕,朱亚先,张 勇*
(1.近海海洋环境科学国家重点实验室,厦门大学 环境与生态学院,福建 厦门 361102;2.厦门大学 化学化工学院 化学系,福建 厦门 361005)
环境中的中低分子量多环芳烃(PAHs)可经呼吸或饮食摄入人体,一部分PAHs在循环系统中被血液中的酶迅速代谢并激活,生成环氧化合物、羟基化PAHs等代谢产物,而这些代谢产物与生物大分子的相互作用可对人体健康产生危害[1-3]。血清白蛋白是人体循环系统中含量最丰富的运输蛋白,其与PAHs代谢产物的相互作用可调节后者的分布和运输。因此,血清白蛋白与PAHs代谢产物相互作用的研究备受关注[4-6]。牛血清白蛋白(Bovine serum albumin,BSA)因生产成本低、易于获取的优点被广泛用作模式蛋白研究血清白蛋白和外源小分子的相互作用。BSA与人血清白蛋白(Human serum albumin,HSA)晶体结构中的氨基酸序列表现出76%的相似性,但Maity等[7]的研究表明碳纳米点-BSA复合物的稳定性较碳纳米点-HSA更高,而Bourassa等[8]的研究表明,叶酸-BSA的结合常数较叶酸-HSA的结合常数更高,同一污染物与BSA、HSA的结合作用也存在差异。本课题组对BSA与1-羟基芘(1-Hydroxylpyrene,1-OHPyr)相互作用的研究结果显示[9],1-OHPyr-BSA的荧光特征峰与Carmona等[10]的研究结果差异明显;并利用芘(Pyrene,Pyr)的微环境极性探针性质证实Pyr在HSA、BSA中结合位点的微极性存在差异[4]。Sun等[11]在吸烟人群血液中检测到大量1-羟基萘(1-Naphthol,1-OHNap),该物质可嵌入BSA的疏水空腔并形成复合物[5],但其与HSA、BSA的相互作用与1-OHPyr间的异同尚未见报道。
本文采用稳态荧光光谱、同步荧光光谱、荧光共振能量转移技术结合分子对接法,考察了1-OHNap与HSA、BSA相互作用的异同。尝试进一步阐明不能用BSA代替HSA开展相关工作,并藉此为吸烟对人体健康的影响研究提供分子水平的实验证据。
1 实验部分
1.1 试剂与仪器
BSA(>96%)和三羟甲基氨基甲烷(分析纯)均购于阿拉丁试剂公司;HSA(≥97%)和1-OHNap(分析纯)购自Sigma试剂公司;无水乙醇等其余药品均为分析纯,购自国药集团化学试剂有限公司。
QM 8000光谱仪(日本Horiba公司);J-810圆二色光谱仪(日本Jasco公司);Five Easy Plus台式pH计(美国Mettler Toledo公司);DF-101S恒温水浴锅(中国华美公司)。
1.2 实验方法
1.2.1荧光发射、同步荧光光谱的测定依次向两组10 mL棕色比色管中,分别加入100 μL 1.0×10-4mol/L 的HSA、BSA,然后加入不同量的1.0×10-3mol/L 1-OHNap,使其终浓度分别为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5×10-5mol/L,以0.05 mol/L Tris-HCl缓冲溶液定容,摇匀后静置30 min,待体系达到平衡后分别进行荧光发射、同步荧光光谱测定。荧光光谱仪参数设定:激发、发射狭缝均为5 nm,扫描停留时间为0.05 s,步距为1 nm;测定激发波长为280 nm时,上述体系在290~550 nm范围内的荧光发射光谱;以及Δλ=15 nm和Δλ=60 nm时,体系在290~360 nm和300~420 nm范围内的同步荧光光谱。
1.2.2CD光谱室温(T=291 K)下,扫描190~250 nm波长范围内不同浓度1-OHNap与HSA、BSA混合体系中HSA、BSA的CD光谱。CD光谱仪参数设定:扫描速度100 nm/min;响应时间0.2 s;响应波长宽度1 nm。将样品CD光谱值输入CDPro软件,通过SELCON3方法,计算获得结合1-OHNap后HSA、BSA中各自α-螺旋的占比。
1.2.3分子对接模拟采用Auto Dock4.2.1和 Auto Dock Tools软件计算1-OHNap分别在HSA、BSA中对接能量最低的构型。对接过程、参数均参考文献方法[12]。分子对接时选择的HSA(PDB编号:1AO6)和BSA(PDB编号:4F5S)的晶体结构均由PDB数据库下载。利用Pymol软件进行可视化研究并计算最优构型结合口袋处1-OHNap周围4Å范围内氨基酸的极性和与色氨酸(Tryptophan,Trp)残基之间的距离。
2 结果与讨论
2.1 1-OHNap诱导HSA、BSA构象变化的差异
2.1.1荧光猝灭光谱荧光法是在低浓度、非破坏生理条件下,评估蛋白质二级结构变化的有效检测手段[13]。如图1所示,当λex=280 nm时,HSA(335 nm)、BSA(340 nm)的荧光发射强度主要由Trp、酪氨酸(Tyrosine,Tyr)荧光团贡献,此外,在330~340 nm范围内的荧光信号均不受1-OHNap(476 nm)荧光信号的干扰。如图2A所示,当HSA溶液中加入1-OHNap后,HSA在λem=335 nm处的峰由1个变成3个,其位置分别为λem=315 nm、328 nm和340 nm。Bobone等[14]的研究结果表明磷酸盐缓冲溶液中单独Trp、Tyr残基的特征荧光发射峰分别在λem=305 nm和360 nm处。文献指出BSA特征荧光发射峰的位置、强度与其Trp、Tyr残基微环境的极性有关[15]。Abou-Zied等[16]的研究表明HSA的构象展开后,其特征荧光发射峰可由1个峰变成位于λem=308 nm和355 nm的两个。由此可知,HSA与1-OHNap结合后会导致HSA中荧光团Trp、Tyr残基周围微环境的极性发生改变,且与1-OHNap的结合作用可诱导HSA构象的变化。Wu等[5]的研究结果表明,1-OHNap以π-π堆积或与BSA分子内氨基酸残基形成复合物。如图2B所示,当向BSA体系中加入梯度浓度的1-OHNap后,BSA在340 nm的荧光发射峰呈现出4 nm的红移,说明BSA中荧光团周围的极性增加,疏水性减弱。显然,结合1-OHNap后,HSA的特征荧光光谱较BSA有明显变化,且1-OHNap诱导HSA构象的变化更显著。

图1 HSA(A)、BSA(B)和1-OHNap(C)的荧光发射光谱Fig.1 Fluorescence emission spectra of HSA(A),BSA(B) and 1-OHNap(C)λex=280 nm,Ex./Em.slit=5/5 nm(for 1-OHNap and HSA,BSA);c1-OHNap=5.0×10-6 mol/L;cHSA=cBSA=1.0×10-6 mol/L

2.1.2同步荧光光谱利用同步荧光光谱考察了1-OHNap对1-OHNap-HSA、1-OHNap-BSA体系中HSA、BSA的Trp(Δλ=60 nm)和Tyr(Δλ=15 nm)残基微环境极性的影响[17]。如图3A所示,随着1-OHNap浓度的增加,1-OHNap-HSA体系中HSA Tyr残基的荧光强度降低,Trp残基的荧光特征峰红移。文献[14]的工作表明,Trp、Tyr残基特征荧光发射峰的位置会随溶剂极性的不同而变化。由此可知,加入1-OHNap后,1-OHNap-HSA体系中Trp、Tyr残基周围微环境的极性改变。如图3B所示,随着1-OHNap浓度的增加,1-OHNap-BSA体系中BSA Tyr、Trp残基的荧光强度均降低,Trp残基的荧光特征峰红移2 nm。因此,加入1-OHNap后,1-OHNap与BSA形成复合物,1-OHNap-BSA体系中Trp残基周围微环境的极性增加,疏水性减弱。
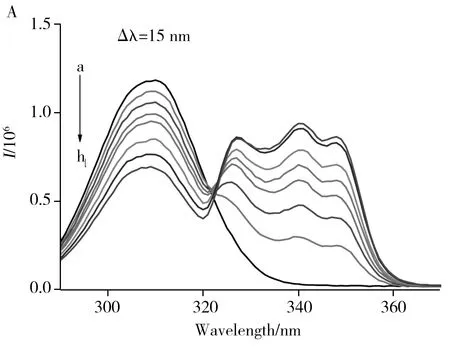
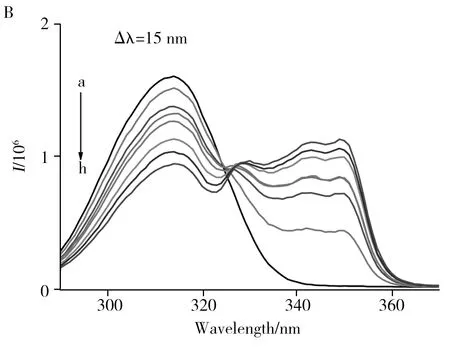
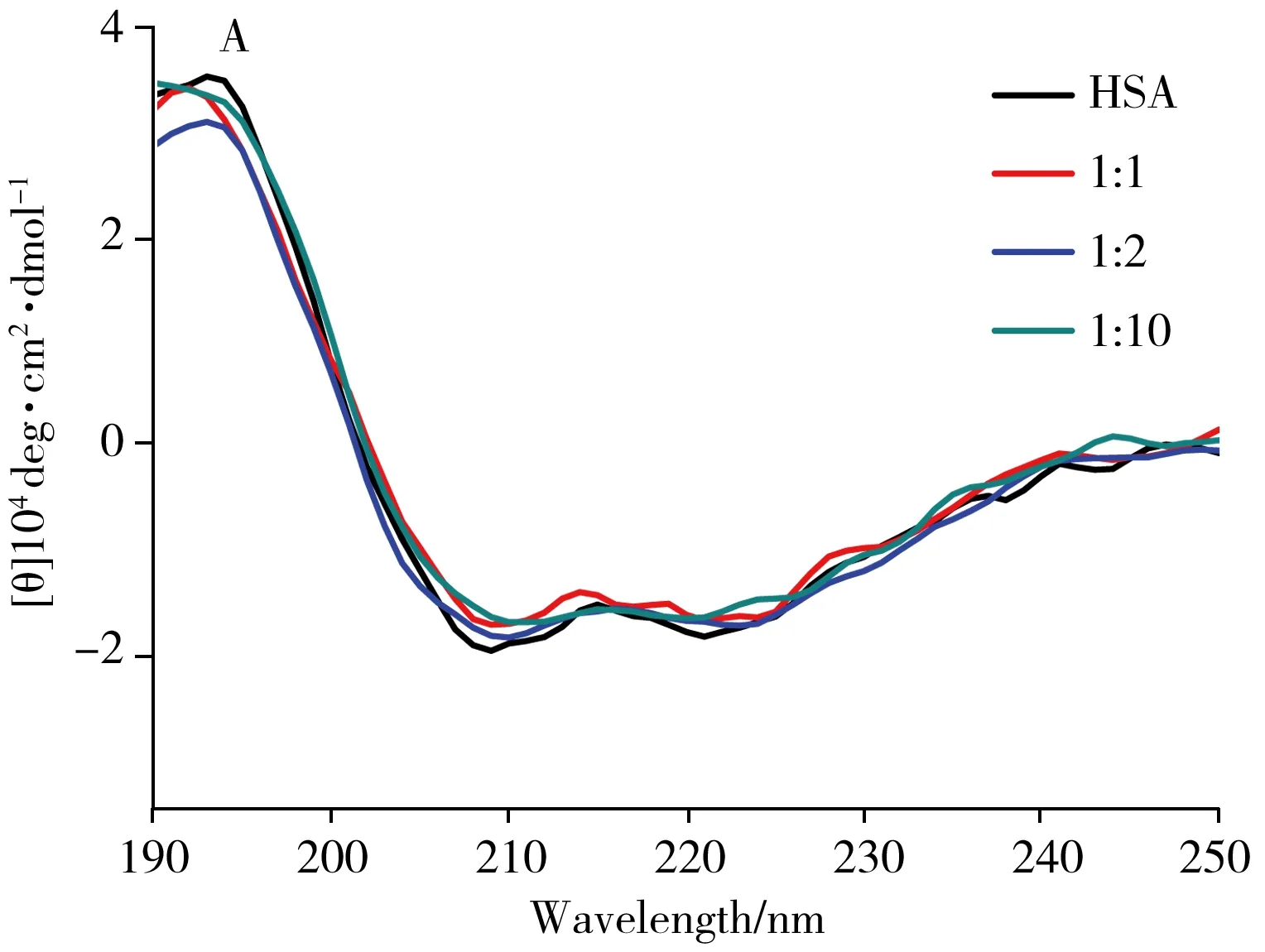
2.1.3CD光谱利用CD光谱法定量考察了不同浓度1-OHNap对HSA、BSA二级结构的影响[17]。如图4A、B所示,210 nm和220 nm两个负峰表示血清白蛋白中的α-螺旋结构[18]。当向HSA、BSA中各加入等浓度的1-OHNap时,HSA中α-螺旋含量的占比由50.5%降至44.3%,BSA中α-螺旋含量的占比由50.4%降至48.7%。HSA中α-螺旋占比的降幅较BSA更大,说明1-OHNap诱导HSA构象的变化更显著 。当混合体系中1-OHNap的浓度增至HSA、BSA浓度的2倍和10倍时,HSA、BSA中α-螺旋含量的占比分别为48.7%、45.8%和46.0%、50.3%。由此可见,1-OHNap的加入可改变HSA、BSA的二级结构,这是由1-OHNap与HSA、BSA形成复合物引起的[5]。
2.2 1-OHNap与HSA、BSA结合常数的差异
研究表明,1-OHNap与血清白蛋白的结合作用力以范德华力和氢键作用为主[5]。当1-OHNap与HSA、BSA以1∶1结合形成复合物时,利用双对数方程拟合[19]得到1-OHNap分别与HSA、BSA作用的结合平衡常数(Kb)和结合位点数(n)。如表1所示,1-OHNap-HSA和1-OHNap-BSA体系的Kb值分别为1.49×104L/mol和8.76×103L/mol,有一个数量级的差异。

表1 不同体系的结合常数和结合位点数Table 1 Binding constants and number of binding sites of different systemsT=291 K
2.3 1-OHNap与HSA、BSA结合位点的差异
为进一步从分子水平探究1-OHNap与HSA、BSA形成稳定复合物时结合位点的差异,分别进行HSA、BSA与1-OHNap的分子对接研究。经计算,1-OHNap在HSA、BSA中的最优结合位点分别是ⅡA子域和ⅠB子域,结合自由能分别为-5.47 kJ/mol和-5.61 kJ/mol,表明1-OHNap与HSA、BSA的结合过程均可自发形成。如图5所示,利用Pymol软件获得最优结合位点处1-OHNap与HSA中Trp214(1.26 nm),BSA中Trp134(1.24 nm)和Trp213(2.77 nm)的距离。结合态1-OHNap在HSA作用位点4Å范围内的非极性氨基酸有Ile264、Ala291、Ala261和Leu238,极性氨基酸有Tyr150,带正电荷的极性氨基酸有Arg257和His242,带负电荷的极性氨基酸有Glu292;而1-OHNap在BSA作用位点4Å范围内的非极性氨基酸有Ile141、Pro117、Met184、Ile181,极性氨基酸有Tyr137、Tyr160和Asn 267,带正电荷的极性氨基酸有Arg185,带负电荷的极性氨基酸有Glu182,表明ⅠB子域因其不完全疏水而表现出一定极性,与Zhang等[9]发现的1-OHPyr可进入BSA中ⅠB子域的结合位点并导致其周围氨基酸残基疏水性降低的结果一致。

图5 1-OHNap在HSA(A)和BSA(B)中不同结合位点的分子对接图像Fig.5 Molecular docking images of HSA(A) and BSA(B) with 1-OHNap at different binding sites
2.4 1-OHNap与HSA、BSA中Trp作用距离的差异
为进一步明确1-OHNap分别与HSA、BSA结合位点的差异,根据Förster能量转移理论[20],采用Felix GX 4.1.2软件计算了1-OHNap分别与HSA、BSA的能量转移效率(E)和表观距离(R0)。如图6所示,1-OHNap的最大吸收峰位于295 nm左右,与HSA、BSA的荧光发射光谱有一定程度的重叠,受体1-OHNap满足与供体HSA、BSA发生能量转移的要求。当1-OHNap与HSA、BSA等浓度混合时,1-OHNap与HSA、BSA的E分别为8.7 %和4.7 %,结合位点处的1-OHNap与HSA和BSA中Trp残基的R0分别为1.53 nm和1.42 nm,与“2.3”中1-OHNap分别与HSA中Trp214(1.26 nm)、BSA中Trp134(1.24 nm)的距离接近,该结论与分子对接的实验结果一致。

图6 HSA(A)、BSA(B)的荧光发射光谱与1-OHNap(C)的UV-Vis吸收光谱Fig.6 Fluorescence emission spectra of HSA(A),BSA(B) and UV-Vis spectrum of 1-OHNap(C)
3 结 论
本文通过实验发现1-OHNap与HSA、BSA相互作用时的结合位点及微环境极性存在差异,且造成的HSA构象的变化更为显著;低分子量1-OHNap通过π-π堆积或形成复合物作用,对HSA构象的影响高于BSA。进一步说明用BSA代替HSA开展有关PAHs代谢产物与血清白蛋白相互作用机制研究时,血液中的1-OHNap对HSA转运功能的影响被低估。同时,利用时间分辨荧光光谱和荧光寿命显微成像技术等方法有望更好地从分子水平全面了解PAHs代谢产物分别与HSA和BSA作用机制的差异。
