重症肌无力患者外周血淋巴细胞亚群水平及其临床意义*
2021-07-02罗婷张艺凡楚兰陈美秋夏聪徐凯翎刘磊
罗婷, 张艺凡, 楚兰, 陈美秋, 夏聪, 徐凯翎, 刘磊
(贵州医科大学附属医院 神经内科, 贵州 贵阳 550004)
重症肌无力(myasthenia gravis,MG)是一种由乙酰胆碱受体抗体(acetylcholine receptor antibody,AChR-Ab)介导、细胞免疫依赖、补体参与的累及神经肌肉接头(neuromuscular junction,NMJ)突触后膜的自身免疫性疾病,主要临床表现为部分或全身骨骼肌无力和易疲劳性[1]。目前对MG尚无有效根治方法,需要长期随访并及时调整治疗方案,使患者病情达到由美国重症肌无力基金协会(Myasthenia Gravis Foundation of America,MGFA)制定的干预后状态(post-intervention status,PIS)分类中的最轻微表现状态(minimal manifestation status,MMS)或更好[1]。但因MG发病机制不明确,尚缺少有效的观察指标来指导临床诊疗方案。目前研究表明,MG主要的发病机制可能与机体的自身免疫平衡被打破,尤其是淋巴细胞亚群比例的失衡有关[2],在部分MG患者胸腺中还存在部分异常具有抗乙酰胆碱受体抗体(acetylcholine receptor antibody,AChR-Ab)的CD4+T细胞,能促进B淋巴细胞活化和生成AChR-Ab[3]。CD8+作为要主要组织相容性复合体Ⅰ(major histocompatibility complex,MHC Ⅰ)类限制性T细胞识别辅助受体,具有抑制T细胞活性和B细胞产生抗体的作用,可作为免疫调节的标志物[4]。自然杀伤(natural killer,NK)细胞具有独立生物活性,参与细胞免疫,在肿瘤、病毒感染等疾病中其重要作用,具有免疫调节作用[5]。研究发现NK存在潜在调节T细胞活化能力,在实验性自身免疫性重症肌无力(experimental autoimmune myasthenia gravis,EAMG)小鼠体内发现,NK细胞能激活机体CD4+淋巴细胞来辅助活化后的B淋巴细胞分泌AChR-Ab[3]。国内外文献对淋巴细胞与MG病情的相关性研究相对较少,因此本研究以90例MG患者作为研究对象,探讨MG患者淋巴细胞亚群与病情严重程度和AChR-Ab阳性率的关系。
1 对象与方法
1.1 研究对象
选取2015年4月—2018年12月医院神经内科收治的MG患者90例,要求符合《中国重症肌无力诊断和治疗中国专家共识》[6]中MG的诊断标准、新斯的明实验阳性、肌电图检查及临床表现确诊,为首次发病或稳定后复发者;排除近3个月使用过激素、免疫抑制剂等,排除合并严重的代谢性或其他免疫性疾病,排除合并急慢性肝炎、获得性免疫缺陷综合征(acquired immune deficiency syndrome,HIV)等感染性疾病,排除严重的心肝肾功能障碍及合并Good综合征等。90例MG患者按照受累肌群分为眼肌组(40例)和全身组(50例),眼肌组患者男21例、女19例,年龄18~65岁、平均(38.4±6.4)岁,病程3月~4年、平均 (1.4±0.5)年;全身组患者男23例、女27例,年龄18~63岁、平均(40.2±5.9)岁,病程2月~4年、平均(1.4±0.5)年。选取同期医院体检中心40例健康人作为对照组,男21例、女19例,年龄16~62岁、平均(42.1±6.2)岁。3组受试者性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究为回顾性研究,经医院道德伦理委员会审核批准(2017伦审第16号),所有受试者均口头同意或签署书面知情同意书。
1.2 实验方法
1.2.1标本采集 MG患者于免疫治疗前采集空腹静脉血5~10 mL,对照组受试者于健康体检日抽取空腹静脉血5~10 mL,2组样本取3~5 mL加乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝,置于-80 ℃冰箱保存用于检测淋巴细胞亚群;剩余样本于3 500 r/min离心10 min,取上清液于-80 ℃冰箱中保存用于检测血清AchR-Ab。
1.2.2流式细胞法检测外周血淋巴细胞亚群 取2组受试者全血0.5 mL分别装100 μL于A~E流式管,分别加标记抗体(美国Becton Dickinson),其中A管加CD8-APC(CD8-allophycocyanin)、CD45RA-FITC(CD45-fluorescein isothiocyanate)、CD45RO-PE(CD45-P-phycoerythrin)及CD3-PerCP(CD3-peridinin chlorophyll protein)各5 μL,B管加CD4-APC、CD45RA-FITC、CD45RO-PE及CD3-PerCP各5 μL,C管加CD56-APC、CD3-PerCP及CD16-PE均5 μL,D管加CD19-FITC、CD5-APC及CD1d-PE各5 μL,E管为CD4-FITC和CD25-APC各10 μL、CD127-PE 5 μL ,每管分别设置对照,各管混匀后实验室室温下避光放置20 min;A~D管及其对照管中各加溶血素2 mL,混匀、避光放置5 min,1 200 r/min离心5 min并取沉淀;沉淀中加2 mL磷酸盐缓冲液(phosphate buffer saline,PBS)清洗,1 200 r/min离心5 min并取沉淀,重复操作3次,在最终得到的细胞沉淀加1%甲醇固定,重悬细胞至细胞液达到500 μL,采用CyFlow Robby 6型流式细胞仪(广州吉源生物有限公司)检测并能保证每管中至少能获得3×104个细胞为有效结果,T淋巴细胞亚群和NK细胞检测结果采用二维点阵图判断,分别计算CD4+、CD8+、CD4+/CD8+、CD19+及NK细胞(CD16+CD3-CD56+)所占比例。
1.2.3酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测MG患者血清AchR-Ab阳性率 采用ELISA试剂盒(南京森贝伽生物科技有限公司)对MG患者血清AChR-Ab进行检测,取出试剂于20 ℃室温下放置0.5 h,所有样品和试剂在使用前需短暂离心30 s,分别以1 ∶100和1 ∶25对样品稀释液和洗涤液进行稀释;在酶标板孔中加阴性(100 μL)、阳性对照(100 μL)及稀释的待测标本(100 μL),留3个空白对照孔并加样本稀释液、混匀,25 ℃恒温箱中放置1 h,孵育结束后取出,吸去孔板中液体,采用稀释后的洗涤剂清洗孔板,按300 μL/孔加洗涤剂浸泡清洗3 min,重复洗3次;每个孔板中加入试剂盒中底物A、B,20~25 ℃避光放置0.5 h终止;采用酶标仪测量各孔的光密度(optical density,OD)值(波长为450 nm),应用Gen5分析软件分析检测结果。参照试剂盒说明,以OD≥0.21为AChR-Ab阳性,OD<0.21为AChR-Ab阴性,每个样本至少检测3次。
1.2.4MG患者评分[7-9]所有MG患者首次就诊时采用重症肌无力定量评分(quantitative myasthenia gravis score,QMGS)和重症肌无力绝对和相对评分(absolute and relative score of myasthenia gravis,ARS-MG)对MG病情严重程度进行评价,QMG评分按照4个程度分别计0~3分,共13个项目、总分0~39分;ARS-MG评分按照5个程度分别计0~4分,共8个项目、总分0~32分;2组患者评分分值越高,受累肌群越多,肌无力症状越重;评分均由主治医师进行。
1.3 统计学分析
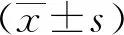
2 结果
2.1 T淋巴细胞亚群
结果提示,全身组MG患者外周血CD4+、CD4+/CD8+及NK细胞比例分别高于对照组和眼肌组,但CD8+细胞比例分别低于对照组和眼肌组,差异均有统计学意义(P<0.05);眼肌组MG患者外周血CD4+/CD8+及NK细胞比例高于对照组(P<0.05),但CD4+、CD8+细胞比例与对照组比较、差异无统计学意义(P>0.05)。见表1。
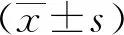
表1 各组受试者外周血淋巴细胞亚群水平
2.2 QMG评分和ARS-MG评分
全身组MG患者QMG评分和ARS-MG评分均高于眼肌组,差异均有统计学意义(P<0.05)。见表2。
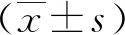
表2 全身组和眼肌组MG患者QMG和ARS-MG评分
2.3 MG患者外周血淋巴细胞亚群与病情评分的相关性
结果提示,MG患者外周血CD4+、CD4+/CD8+及NK细胞比例分别与QMG、ARS-MG评分呈正相关(P<0.05),CD8+细胞比例与QMG、ARS-MG评分呈负相关(P<0.05)。见表3。
表3 MG患者血清淋巴细胞亚群与病情评分的相关性
2.4 MG患者血清AChR-Ab水平
全身组MG患者血清AChR-Ab阳性率高于眼肌组,差异有统计学意义(P<0.05)。见表4。

表4 全身组和眼肌组MG患者血清AChR-Ab表达
2.5 MG患者外周血淋巴细胞亚群与血清AChR-Ab阳性率的相关性
Spearman相关性分析结果表明,MG患者AChR-Ab阳性率分别与外周血CD4+(r=0.721,P<0.001)、CD4+/CD8+(r=0.641,P<0.001)及NK细胞比例(r=0.655,P<0.001)呈正相关,CD8+与AChR-Ab阳性率呈负相关(r=-0.744,P<0.001)。
3 讨论
MG是一种自身免疫性的慢性疾病,病情迁延难愈、反复发作,多数患者需长期服用免疫抑制类药物来控制病情,但长期服用免疫抑制药物可引发机体免疫功能紊乱以及严重不良反应的发生[10]。因此,需要长期跟踪随访患者,定量评估治疗合理性并及时调整治疗方案,从而使患者获得更好的疗效并减少复发率和不良反应的发生。MG的发病机制取决于T细胞、B细胞以及补体和细胞因子,其中抗原特异性T细胞及其功能性亚群的激活是MG发病的始动环节,是产生自身免疫反应的基础[11]。CD3是T细胞表面的一种分化抗原,由γ、δ、ε、ζ4种成分或γ、δ、ε、ζ、η5种成分的跨膜蛋白组成,表达于成熟T淋巴细胞表面,是总T细胞群的特征性表面标志[12]。CD3分子与T细胞受体(T cell receptor,TCR)组成TCR/CD3复合物,当TCR特异性识别并结合抗原后,CD3分子参与将信号转导至T细胞胞内,作为诱导T细胞活化的第一信号[13];基于上述机制,抗CD3单克隆抗体被广泛研究应用于治疗各种器官移植后急性排斥反应以及如1型糖尿病、系统性红斑狼疮等自身免疫性疾病,并取得了一定的疗效[14-16]。Kuhn等[17]研究表明,在治疗1型糖尿病过程中,CD3特异性抗体可能通过诱导效应T细胞凋亡,恢复效应T细胞与调节T细胞的平衡而产生治疗作用;但Xu等[18]研究表明,在实验性自身免疫性重症肌无力(experimental autoimmune myasthenia gravis,EAMG)动物模型中,连续5 d注射抗CD3单抗后并未能改善小鼠的临床体征及临床评分,实验组小鼠AChR-Ab滴度与对照组亦无明显差异,猜测CD3特异性抗体不能使MG的致病T细胞产生耐受。由此可见,尽管T细胞在MG发病机制中有重要作用,但是CD3+T细胞并不能很好地反映MG的病理生理进展状态,尤其是在临床中对于部分使用了如环胞霉素A、他克莫司等针对T细胞药物的MG患者。此时,探讨CD3+T细胞亚群的改变可能对判定体内免疫紊乱及病情严重程度更有意义。按照表型的不同,CD3+T细胞可进一步分为CD3+CD4+CD8-和 CD3+CD4-CD8+T细胞,即CD4+T细胞和CD8+T细胞[19]。正常情况下,CD4+T细胞与CD8+T细胞相互拮抗而维持平衡,两者之间互为协调和对立,变化不同步[20]。在自身免疫性疾病中,因自身免疫耐受已被打破,细胞亚群及比值发生紊乱[21]。因此,通过对CD4+T细胞和CD8+T细胞等亚群的分析可以了解体内免疫紊乱的情况。在MG的发病机制中,各淋巴细胞亚群的激活水平仍不清楚。本研究评估了MG患者T细胞、NK细胞亚群与病情严重程度(QMG、ARS-MG)与AChR-Ab阳性率之间的关系,鉴于CD4+T细胞、CD8+T细胞与CD3+T细胞之间的依存及包含关系,本研究未纳入CD3+进行分析。
淋巴细胞作为机体免疫的核心细胞,通过与主要组织相容性复合体递呈的多态抗原反应被激活使CD4+T细胞激活分泌细胞因子,辅助T淋巴细胞转变为效应细胞和B淋巴细胞生成抗体等作用发挥其细胞免疫及体液免疫作用[22]。CD8+T细胞分为T抑制细胞和细胞毒细胞,具有抑制细胞免疫及体液免疫、杀伤靶细胞的功能[23]。CD4+及CD8+相互诱导、相互制约形成一个复杂的免疫调节系统,一旦失调会导致自身机体免疫紊乱,因此在免疫应答的调控及免疫自身稳态等方面具有重要的临床意义[20]。细胞免疫在MG患者起病和发病过程中起到重要作用,Homma等[24]研究发现,通过分离MG患者T淋巴细胞,建立了AChR反应性细胞株,发现该细胞株表达CD3+CD4+,是Th亚群的代表细胞,说明CD4+T细胞参与了MG致病性抗体产生。而在Yan等[25]动物实验中,EAMG模型中CD4-CD8-和CD4+CD8+均处于被抑制状态。以上结果提示淋巴细胞在MG的发生发展中起着重要的作用。本研究得出,MG患者CD4+、CD4+/CD8+均高于对照组,CD8+低于对照组,再次证明MG患者中存在免疫调节紊乱和失衡,免疫平衡紊乱可能与MG发病有关;MG患者CD4+、CD4+/CD8+、CD8+细胞具有差异,提示CD4+升高、CD8+降低可能是全身型MG患者致病的原因之一,且可能与眼肌型向全身型进展密切相关。因此,淋巴细胞可以作为临床上评估病情严重程度的客观指标。
NK细胞是一种异质性多功能免疫细胞,受白细胞介素2(interleukin-2,IL-2)及干扰素等因子的调控,具有重要的免疫调节作用,参与了自身免疫性疾病的发生发展过程,现认为NK细胞数量减少和功能缺陷是导致MG患者机体免疫调节功能紊乱的重要原因之一[26]。NK细胞具有独立生物活性,是细胞免疫的代表,可对肿瘤和病毒感染细胞进行直接杀伤作用[5]。NK细胞在白细胞介素12(interleukin-12,IL-12)培养条件下可分泌白细胞介素10(interleukin-10,IL-10)、干扰素-γ(interferon-γ,IFN-γ),而淋巴细胞辅助性T(T helper cell,Th1)细胞中也主要分泌IFN-γ,因此认为NK细胞与具有相似功能,IFN-γ可增加主要组织相容性复合体II(major histocompatibility complex,MHC II)类分子的表达,可诱导B细胞成熟,辅助产生AChR-Ab,诱导MG的产生[27]。研究发现在EAMG小鼠体内,NK细胞能激活机体CD4+T细胞来辅助活化后的B淋巴细胞分泌AChR-Ab[5];葛梦茹[26]研究发现,病情加重的MG患者中CXCR5+NK细胞比例较对照组显著增高,病情缓解的MG患者中CXCR5+NK细胞比例却较加重组有明显下降趋势。本研究结果得出实验组NK细胞较对照组升高,与文献报道一致。因此,NK细胞可能与MG的病情密切相关,其有可能成为衡量MG症状严重程度的一个潜在指标,但具体的发病机制需进一步深入研究。
MG的临床表现可为全身多组肌群均可受累,1958年Osserman首次提出重症肌无力分型,在临床上得到广泛的应用,但缺乏客观判断指标,不利于临床观察与比较。因此,2000年MGFA提出新的临床分型及QMG评分,对MG患者受累肌群肌无力严重程度具有客观的评价,不同MGFA分型的MG患者治疗前后采用QMG评分进行病情评估具有较高敏感性,更能客观、细致地反映出病人病情以及治疗前后的变化与波动,有利于进行预后分析与疗效判断[28]。QMG评分和ARS-MG评分是临床上常用对MG患者病情严重程度进行评估的客观量化指标,在近年来的研究中已经得到广泛应用,评估指标可靠[9]。就患者淋巴细胞亚群与QMG评分和ARS-MG评分进行Pearson相关性分析,结果表明CD4+、CD4+/CD8+、NK细胞与QMG评分和ARS-MG评分呈正相关,CD8+与QMG评分和ARS-MG评分呈负相关,提示CD4+、CD4+/CD8+、NK升高,而CD8+降低,MG病情更严重。临床上可通过淋巴细胞亚群的数值对MG患者进行病情评估。
在以往研究中,AChR-Ab阳性率与MG患者病情严重程度无相关性,仅在临床分型上有一定差异,袁东风等[29]研究中全身型MG患者AChR-Ab阳性率达85%以上,眼肌型MG患者介于60%~85%。本研究结果显示,全身组MG患者AChR-Ab阳性率高于眼肌组,与以往研究结果一致。另外,本研究通过Spearman相关性分析,发现CD4+、CD4+/CD8+、NK细胞与AChR-Ab呈正相关,CD8+与AChR-Ab呈负相关,提示CD4+、CD4+/CD8+、NK升高,而CD8+降低,MG患者的病情相对较重,AChR-Ab更倾向于阳性,其具体发生机制有待进一步研究。 因此,淋巴细胞亚群水平可能作为评价MG患者病情严重程度和AChR-Ab阳性率的重要参考指标,并指导临床诊疗方案。
