RC-AVF术后肱动脉血流量和头静脉直径对动静脉内瘘成熟的影响
2021-07-02丁志珍陈卫东马续祥
丁志珍 陈卫东 王 菡 马续祥
1 蚌埠医学院第二附属医院肾内科,安徽 蚌埠 233000
2 蚌埠医学院第一附属医院肾内科,安徽 蚌埠 233000
自体动静脉内瘘(arteriovenous fistula,AVF)是血液透析患者首选的血管通路,具有可重复穿刺,感染率、狭窄率及血栓发生率低,使用寿命长等优势[1]。但AVF 也存在一定缺陷,受限于患者血管条件,患者腕部桡动脉-头静脉吻合内瘘(radial cephalic arteriovenous fistula,RCAVF)建立后无法立即使用,需成熟后才可用于透析[2]。中国现行的内瘘成熟标准为[3]血流量>500 ml/min,血管直径>5 mm,且血管与皮肤深度间距<6 mm;这与美国标准血流量>600 ml/min,血管直径>6 mm,且血管与皮肤深度间距<6 mm标准[4]存在差异,这可能与种族、血管条件等因素有关。由于中国地域辽阔,是多元化民族,各地区人群内瘘成熟标准可能出现一定差异。因此,探讨RC-AVF 术后AVF 成熟影响因素对血液透析治疗工作具有实际意义。本研究采用彩色多普勒超声技术对RC-AVF 术后患者肱动脉血流量和头静脉直径进行评估,探讨其对RC-AVF 成熟的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年8月至2020年8月在蚌埠医学院第二附属医院行RC-AVF 端侧吻合的终末期肾病患者临床资料。纳入标准[5-6]:(1)慢性肾衰竭4~5期,需血液透析治疗者;(2)年龄≥18岁。排除标准:(1)有严重感染、恶性肿瘤、心血管疾病、凝血功能障碍等;(2)术前双侧桡动脉、尺动脉和肱动脉搏动异常;(3)伴有精神疾病。根据纳入与排除标准,纳入98例患者,男性63例,女性35例;61例年龄<50岁,37例≥50岁;体重指数19.20~24.40 kg/m2,平均(22.09±1.01)kg/m2;原发疾病:慢性肾炎69例,糖尿病肾病19例,其他10例。
1.2 手术方法
对患者腕横纹上侧5 cm处进行消毒,1%利多卡因局部麻醉,切开皮肤3~4 cm,暴露并对头静脉进行5 cm游离,于远端进行45°角剪开,选用肝素和生理盐水(1 ∶100)进行冲洗,观察血流流出情况以297~1909 ml/min后将头静脉夹闭。同时暴露并分离桡动脉,将两端阻断后,设置5 mm开口,并同头静脉进行端侧吻合,松开两端夹闭,该区域血管可闻及杂音,并触感存在震颤显示为手术成功。
1.3 观察指标及判定标准
术后4~8周内定期对患者进行监测:采用彩色多普勒超声及血管超声探头对患者肱动脉、桡动脉及头静脉直径和血流量进行检测;动态血压监护仪监测患者血压;全自动生化分析仪监测患者生化指标。AVF 成熟标准:血流量>200 ml/min,且穿刺后无渗漏;血流量<200 ml或穿刺困难为AVF 成熟不良[7]。
1.4 统计学方法
应用SPSS 22.0统计学软件对数据进行分析,计量资料采用(±s)表示,组间比较采用两独立样本t检验;计数资料采用n(%)表示,组间比较采用χ2检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under the curve,AUC)评估肱动脉血流量和头静脉直径对RC-AVF 成熟的预测价值;多因素采用Logistic回归分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 AVF 成熟情况
98例患者中,RC-AVF 成熟者75例, 成熟率为76.53%;AVF 成熟不良者23例,成熟不良率23.47%。
2.2 RC-AVF 成熟影响因素的单因素分析
AVF成熟不良患者年龄≥50岁比例和收缩压明显高于AVF成熟患者;而肱动脉直径、肱动脉血流量和头静脉直径低于AVF成熟患者,差异有统计学意义(P<0.05);AVF成熟和成熟不良患者性别、体重指数、舒张压、空腹血糖、原发疾病、血红蛋白、白细胞、血小板计数、白蛋白、甘油三酯、总胆固醇、桡动脉直径、桡动脉流速和头静脉流速比较,差异无统计学意义(P>0.05,表1)。
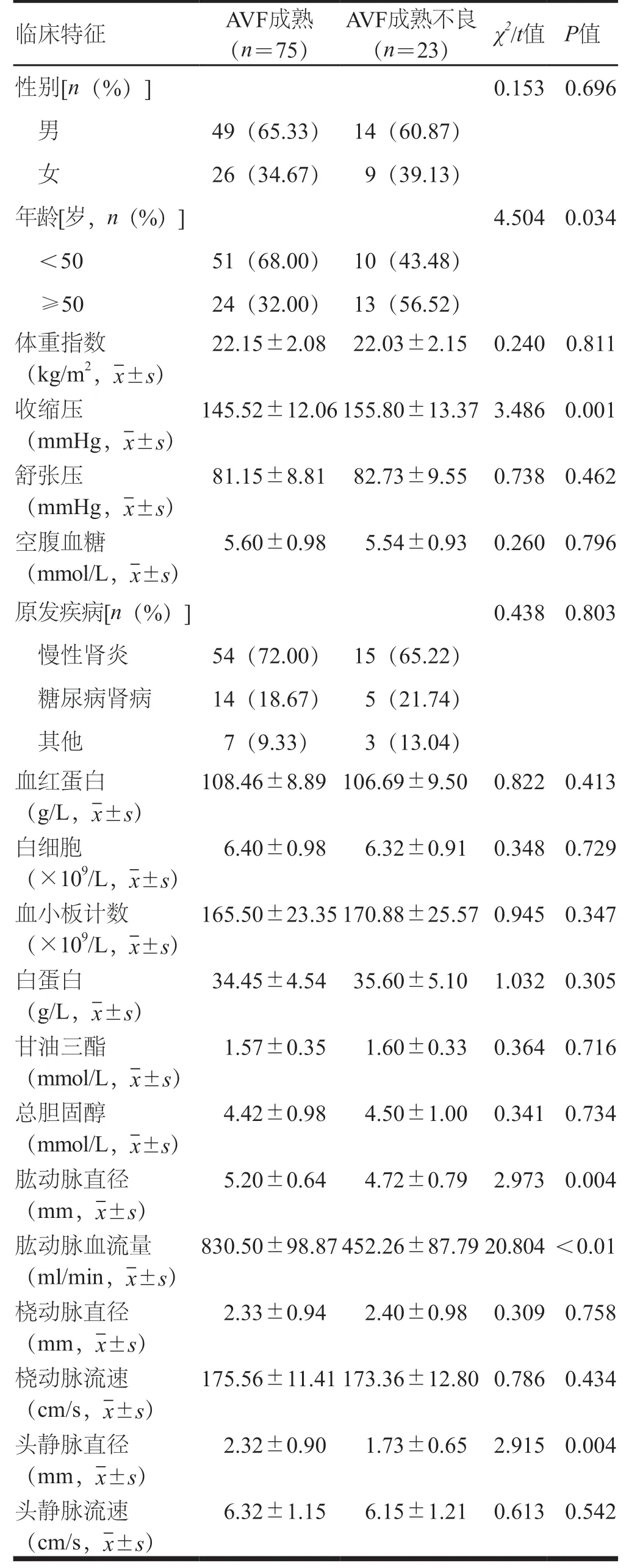
表1 AVF成熟和成熟不良患者临床特征比较
2.3 RC-AVF 成熟影响因素的多因素分析
将年龄、收缩压、肱动脉直径、肱动脉血流量、头静脉直径作为自变量,RC-AVF成熟作为因变量进行Logistic回归分析,结果显示:年龄≥50岁是RC-AVF成熟的危险因素;肱动脉血流量≥650 ml/min、头静脉直径≥2.10 mm是RC-AVF成熟的保护因素(P<0.05,表2)。
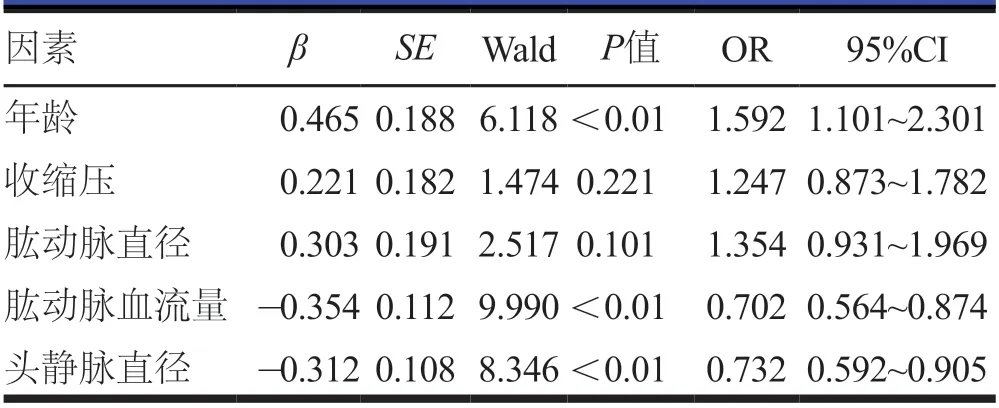
表2 RC-AVF成熟影响因素的多因素分析
2.4 肱动脉血流量预测AVF 成熟的价值
肱动脉血流量和头静脉直径预测RC-AVF 成熟的AUC为0.937(95%CI:0.812~0.988) 和0.801(95%CI:0.734~0.891),最佳截断点分别为650 ml/min和2.10 mm,灵敏度分别为98.50%和84.00%,特异度分别为81.00%和65.00%(图1)。
3 讨论
多种因素如血管解剖特征或血液透析泵控参数等,RCAVF成熟判定时间存在一定差异[8]。日本推荐在RC-AVF术后10 d进行成熟判定[9];美国肾脏病预后质量倡议工作组则推荐术后4~6周进行成熟判定[10];中国相关标准推荐RCAVF成熟判定时间为术后8~12周[11]。但本研究通过术后4~8周内定期的血管指标检测发现,患者术后6周RC-AVF已基本成熟或成熟不良,其原因可能与样本基数及地域人口差异有关。研究显示,血液透析患者年龄及血管并发症等因素增加RC-AVF建立及成熟难度,且存在不良因素的患者AVF成熟不良率为10%~50%[12]。本研究RC-AVF成熟率为76.53%,成熟不良率为23.47%,这略高于之前的研究结果,可能由于本研究严格参照《中国血液透析用血管通路专家共识》[3]进行RC-AVF建立。
本研究结果显示,RC-AVF成熟不良患者年龄≥50岁比例和收缩压高于RC-AVF成熟患者,而肱动脉内径、肱动脉血流量和头静脉内径明显低于RC-AVF成熟患者,提示年龄、收缩压、肱动脉内径、肱动脉血流量和头静脉内径可能是RC-AVF成熟影响因素。RC-AVF成熟是一个静脉向动脉转化的过程,RC-AVF构成后,静脉将在动脉血流及血压刺激下逐步扩张,管腔内血流量也随之增加[13]。而老年人群血管壁弹性较弱,整体血流速下降,这可能影响静脉的动脉向转化效率,进而影响RC-AVF成熟结果[14]。收缩压增高提示人体动脉内压上升,这将导致内瘘静脉同期内获得更高压力冲击,诱使患者静脉微结构损伤加剧,不利于静脉的缓慢性动脉转化进程,最终影响RC-AVF成熟率。动脉供血则是RC-AVF成熟的关键,RCAVF成熟过程中肱动脉将逐步扩张,以缓冲增加的血流冲击力,其血流量也将随之上升[15]。如果患者术后肱动脉直径、肱动脉血流量过低,则不利于RC-AVF成熟。头静脉直径过低将导致其扩张难度增大,进而影响RC-AVF成熟效果[16]。本研究Logistic回归分析结果显示:年龄≥50岁是RC-AVF成熟的危险因素;肱动脉血流量≥650 ml/min、头静脉直径≥2.10 mm是RC-AVF成熟的保护因素,这表明临床可通过观察患者年龄、肱动脉血流量和头静脉直径来预测RC-AVF 成熟结果,并且可酌情延长生存期,肱动脉血流量、头静脉直径异常患者的RC-AVF 成熟时间,确保RC-AVF 的有效建立。进一步的ROC曲线显示,肱动脉血流量预测RC-AVF 成熟具有较高的灵敏度和特异度,其可能原因:(1)肱动脉是RC-AVF 的主要供血动脉,90%以上的RC-AVF 血流由肱动脉提供,观察其血流量可直观分析RC-AVF 血流状态[17-18];(2)肱动脉湍流较少,稳定性高,超声检测难度及精度较佳;(3)手术无损肱动脉结构,肱动脉血流量测量结果不被血肿或水肿干扰[19]。但值得注意的是,动脉硬化、静脉阻塞及流入道狭窄等将可能影响肱动脉血流量,当监测到肱动脉血流量异常情况时,临床需仔细排查。
老年、合并肥胖及心血管疾病的终末期肾病患者建立RC-AVF 具有较高的难度[20],对上述患者建立RC-AVF 时具有重要指导意义。
综上所述,RC-AVF 术后肱动脉血流量和头静脉直径是RC-AVF 成熟的保护因素,对预测RC-AVF 成熟存在一定价值。
