维生素C第二步混菌发酵技术研究新进展
2021-07-01杨伟超李嘉文
徐 慧, 杨伟超 ,李嘉文
(中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016)
维生素C(简称维C),又名L-抗坏血酸(L-Ascorbic acid)(图1),是一种水溶性维生素。因其所含还原性质子起电子载体的作用,而具有抗氧化特性,在人体胶原蛋白合成、氨基酸和胆固醇代谢、保持酶活性等方面发挥着重要的生理作用,是人体必需的维生素[1]。由于人体不能表达维C合成的关键酶——L-古洛糖酸内酯氧化酶,所以必须从外界摄入。近年来,随着人们生活水平的提高和健康意识的增强,维C的全球市场需求呈快速增加趋势。国外曾采用“莱氏”化学法生产维C,但在2005年前,德国巴斯夫公司和荷兰DSM公司分别停止了在日本、丹麦和美国的维生素C生产线。目前,工业发酵的维C原粉已全部产自中国,我国年产维C 15万~16万t,出口量约14万~15万t。维C是我国出口量最大的原料药,我国维C产业不仅成为世界第一,更成为世界唯一。目前,维C工业化生产采用的是我国科学家20世纪70年代独创的“维C两步生物发酵法”(图2),该方法较传统“莱氏法”的生产成本低、有毒有害物料少,因此成为目前唯一工业化应用的方法[2]。然而,随着生产成本不断攀升和环保要求日益严格,延用了近50年的“两步生物发酵法”虽然不断改进,但仍存在许多技术难题甚至瓶颈问题,严重制约着维C产业的可持续发展,亟待革新生产技术和工艺。维C两步发酵法的显著特征是其第二步发酵为两种菌的混合发酵。一种菌为产酸菌(普通生酮基古龙酸杆菌(Ketogulonicigeniumvulgare),俗称小菌),可单独将山梨糖转化为2-酮基-L-古龙酸(维C前体,2-keto-L-gulonic acid, 2-KLG),但其单独培养困难,转化效率极低。另一种菌为伴生菌(如巨大芽胞杆菌(Bacillusmegaterium),俗称大菌),不能转化合成2-酮基-L-古龙酸,但能提供促产酸菌生长和产酸的“伴生物质”,从而大幅度提升产酸菌的发酵效率[3]。这种产酸菌对伴生菌高度依赖的混菌发酵模式,存在两菌间营养和空间竞争、伴生菌抑制产酸菌等固有问题,是当前阻碍发酵效率进一步提升的瓶颈难题。维C是高消耗、高排放产业,其生产中排放两种大宗废弃物,一种是废菌渣,是超滤膜截留的分子量在30 kD以上的菌体和蛋白类大分子物质,COD值为5万~10万mg/L,我国年排放量达20万t[4]。另一种为废古龙酸母液,是生物发酵液经超滤、浓缩和结晶等工序后的剩余釜底残液,COD值高达80万~100万mg/L,且pH<0.5,呈强酸性,我国年排放量达5.0万t[5]。这两种废液目前进入环保水处理系统处理,但处理难度大、出水不易达标,是目前维C企业亟需解决的环保难题。本文针对我国维C产业面临的科学和技术难题,综合分析近年来国内外研究机构在维C发酵领域的研究新进展,提出了解决上述问题的思路和未来研究方向,以期为维C产业技术升级和可持续发展提供参考。
1 混菌发酵机制
维C的第二步发酵是两种菌的混合发酵,将L-山梨糖转化为2-KLG。大量研究证实,发酵效率的高低取决于产酸菌的数量和催化酶(山梨糖/酮脱氢酶)活性,而产酸菌的高转化能力又依赖于伴生菌所释放的“伴生物质”。因此,挖掘“伴生物质”、查明关键酶催化特性、阐明相互作用机制,一直是维C发酵研究领域的热点和难点。
1.1 伴生菌的“伴生物质”及其作用机制
多数学者认为伴生菌提供某种或某些物质促进了产酸菌的生长和产酸,并提出其依据。迄今,已报道的“伴生物质”主要有以下几类。
1.1.1 蛋白质 中国科学院沈阳应用生态研究所维C新技术研发团队在国内率先开展了“伴生物质”的研究,发现巨大芽胞杆菌(大菌)培养液中分子量在30~50 kD及大于100 kD的组分明显促进产酸菌产酸,并初步证实它们为两种蛋白质[6]。罗曼等[7]经过超滤分级分离巨大芽胞杆菌25-B胞外组分上清液、胞内组分上清液和全组分上清液,发现相对分子质量大于30 kD的组分对小菌生长和产酸的促进作用最明显,并且高温处理明显降低这种作用,因而推测伴生因子为蛋白质。宫晓丽等[8]和吕淑霞等[9]研究巨大芽胞杆菌Bm 2980促进产酸菌代谢的活性物质具有蛋白质的部分属性,推测是一种或多种由伴生菌在胞内合成并释放到胞外的蛋白质。Jia等[10]通过蛋白质定位分析,检测了内生芽胞杆菌Hbe603释放到细胞外环境中的蛋白质,发现能够降解产酸菌周边环境中大分子物质的胞外酯酶、氨基肽酶和多糖脱乙酰酶,并且还发现了能清除超氧物的超氧化物歧化酶。白玲等[11]通过研究2株伴生菌——巨大芽胞杆菌25b和短小芽胞杆菌HJ04的生长特性、胞外蛋白含量和两种伴生菌之混菌发酵体系的抗氧化能力,发现伴生菌分泌活性蛋白能力及抗氧化能力与混菌体系2-KLG产量呈正相关性,推测在混菌发酵前期大菌通过释放胞外活性蛋白为小菌的生长提供营养,而在发酵中后期,大菌通过释放具有抗氧化能力的活性蛋白或小分子物质平衡体系的氧化还原状态,降低发酵体系ROS水平从而改善小菌的产酸环境。因此,众多研究结果表明,伴生菌能合成并分泌活性蛋白为产酸菌提供营养并清除活性氧ROS,从而促进产酸菌生长和产酸。但是,截至目前,所有具有伴生作用的蛋白质均没有得到鉴定和功能验证,这是维C发酵研究中尚待解决的关键科学问题。
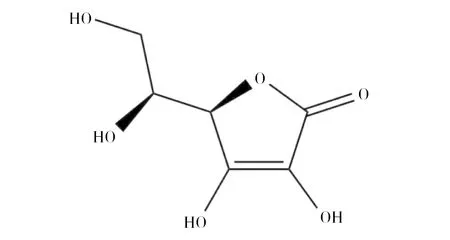
图1 维生素C结构式Fig.1 The structure of vitamin C
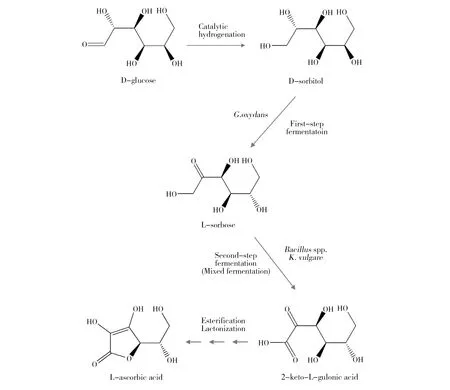
图2 二步发酵法生产维生素C的工艺路线[2]Fig.2 The process of two step fermentation for vitamin C production [2]
1.1.2 氨基酸 蛋白质是生物功能的主要载体,而氨基酸是蛋白质的构件分子。Liu等[12]通过全基因组序列注释重建氨基酸代谢途径,发现在8种不同氨基酸(L-组氨酸、L-甘氨酸、L-赖氨酸、L-脯氨酸、L-苏氨酸、L-蛋氨酸、L-亮氨酸和L-异亮氨酸)的从头生物合成途径中,产酸菌缺乏一种或多种关键酶。其中L-甘氨酸、L-脯氨酸、L-苏氨酸及L-异亮氨酸4种氨基酸最重要,并且外源添加后能显著提高2-KLG产量,提高幅度为11.8%~20.4%。但是在产酸菌中参与氨基酸转运和代谢相关的基因只占基因总数的15.2%,这提示在混菌培养时,小菌可能是通过转运源自于环境中的氨基酸来满足自身生长需要,而氨基酸的来源除了培养基提供之外,更多可能是由伴生菌提供[13]。
1.1.3 维生素类物质 研究表明,小菌需大菌提供(或额外添加)B族维生素才能维持其正常代谢[14]。Leduc等[15]研究了K.vulgareLMP P-20356对叶酸类物质的需求,发现外源添加叶酸不能促进细胞生长,但添加叶酸衍生物则能显著促进细胞生长,推测小菌可能是缺乏叶酸还原酶,无法将叶酸还原为二氢叶酸和四氢叶酸。Cai等[16]把L.lactisMG1363的叶酸合成基因簇在K.vulgareDSM 4025中进行过表达,细胞内叶酸浓度较野生型提高了8倍,细胞密度和2-KLG产量分别提高了25%和35%。Jia等[10]基于基因组学比较了两种大菌B.megaterium与B.endophyticusHbe603的B族维生素合成途径,发现它们均具有8种B族维生素的合成途径,这为大菌能向小菌提供B族维生素的假说提供了理论线索。
1.1.4 嘌呤类物质 Zhou等[17]利用气相色谱仪与飞行时间质谱仪联用技术研究了大小菌间的关系,认为两菌间通过交换代谢产物而达到相互作用,发现在伴生菌周围累积的鸟嘌呤被产酸菌利用。Ma等[13]研究显示伴生菌芽胞释放过程中所产生的腺嘌呤、鸟嘌呤、黄嘌呤和次黄嘌呤能够帮助小菌抵御活性氧(ROS)。后续的研究证实了大菌的产孢裂解可以为小菌提供嘌呤类物质以合成嘌呤核苷酸,从而弥补小菌嘌呤合成的缺陷[18]。
综上所述,伴生菌的“伴生物质”应该有多种,除了大家所公认的蛋白类物质外,氨基酸、维生素、嘌呤类等小分子有机物也具有促进产酸菌生长和产酸的作用,都应归属于“伴生物质”。
1.2 产酸菌的关键酶——山梨糖/山梨酮脱氢酶
产酸菌中与2-KLG催化直接相关的催化酶的数量和活性显著影响着2-KLG合成效率。研究已证实产酸菌中催化L-山梨糖转化为2-KLG的关键酶为山梨糖脱氢酶(SDH)和/或山梨酮脱氢酶(SNDH),L-山梨糖在SDH的催化下转化成L-山梨酮/2-KLG,而L-山梨酮在SNDH的催化下继续转化为2-KLG。目前已从不同产酸菌中分离出SDH和SNDH,而且发现产酸菌存在多种SDH和SNDH或SSDH(L-山梨糖/L-山梨酮脱氢酶),这可能与其山梨糖的转化效率不同有关。文献报道,K.vulgareWSH-001含有5种SSDH和2种SNDH;K.vulgareY25含有4种SDH和多种SNDH;K.vulgareHbe602含有6种SDH和2种SNDH;K.vulgareSKV含有6种SDH和1种SNDH[19-22]。Du等[23]发现在K.vulgareHbe602中单独过表达关键酶的基因sdh和sndh不能使2-KLG的产量提高,然而将合成辅酶吡咯喹啉醌(Pyrroloquinoline quinone,PQQ)的基因簇和sdh、sndh同时过表达则能使2-KLG的产量提高20%,证明PQQ是K.vulgare合成2-KLG的脱氢酶的辅酶。王盼盼[24]通过导入PQQ合成基因构建PQQ合成重组菌株E.coliBL21(DE3)/pRSF-ssda1-pET-pqq和E.coliBL21(DE3)/pRSF-ssda3-pET-pqq,实现重组细胞在不添加PQQ情况下全催化产2-KLG,但产量(11.2 g/L和12.4 g/L)和转化率(56.8%和61.7%)均偏低。
1.3 伴生菌与产酸菌的相互作用研究
大菌可为小菌提供伴生因子,促进小菌生长和产酸,这是普遍共识。但是在混菌发酵体系中,小菌的生长代谢又对大菌产生了什么影响?它们之间如何互相交流、互相影响?小菌是否也有利于大菌生长?通过研究维C二步发酵营养组学,发现随着传代时间的延长,在小菌生长和代谢速度加快的同时,大菌对营养物质有更强更快的摄取能力,对环境的适应性也在不断增强,延滞期缩短的同时稳定期也有更高的生物量。马倩[25]对连续发酵传代的B.cereus-K.vulgare混菌体系进行了蛋白组分析,经150代传代,两菌各自获得了更强的生长能力。周剑[26]在固体培养基上间隔培养大小菌时发现了大菌向小菌移动的现象,经过分析胞内外化学组分,他们认为小菌通过在胞外积累营养物质吸引大菌向其移动,并能产生吡啶二羧酸促进大菌产生芽胞,而大菌在胞外积累赤藓糖等物质又促进了小菌产酸。杜瑾[27]通过基因组分析发现小菌编码了分解、吸收并利用大菌提供的蛋白质、肽类和氨基酸类物质的系统以及响应环境变化的转录蛋白和趋化调控系统,而大菌基因组编码完整的芽胞形成套件,但缺失大量芽胞合成基因及rap-phr信号系统。他们进一步利用两菌的全基因组数据构建基因组水平代谢网络,发现大菌可能通过弥补小菌合成途径中的代谢缺陷形成代谢互补关系而构成稳定的共生关系。张林[28]发现短小芽胞杆菌在衰亡期裂解死亡,释放出大量的碱性物质导致发酵环境pH逐渐增大,而小菌对2-KLG的积累又会使pH降低。两菌对pH的正反调节作用使pH维持在一定范围,保证了小菌的正常繁殖及产酸。
由此可见,伴生菌通过为产酸菌提供营养物质和营造适宜的生存环境来刺激产酸菌生长和产酸,而产酸菌通过在胞外积累某些化学物质吸引伴生菌并促使其发生产孢等一系列有利于产酸菌的行为。伴生菌与产酸菌通过这种不断的交流来强化彼此间的合作,从而实现互利共生。
2 新菌种选育
人们往往认为只有芽胞杆菌才是伴生菌。根据文献报道,欧文氏菌属(Erwinia)、埃希氏菌属(Escherichia)、柠檬酸菌属(Citrobacter)、变形菌属(Proteus)、嗜麦芽黄单胞菌(Xanthomonasmaltophilia)和掷孢酵母(Sporobolomycesroseus)等均可作为伴生菌促进产酸菌生长和产酸,增加了混菌组合的选择范围。除了从自然界发掘新菌资源外,更多学者试图通过使用各种诱变选育、适应性进化和基因工程技术来改造目前发酵菌种。
2.1 诱变选育
诱变育种是人为地利用理化因素等诱变剂处理提高微生物的突变率,扩大变异幅度,再经筛选后获得具有优良特性的变异菌株。
常用的诱变剂有物理和化学诱变剂。卢育新等[29]采用微波结合吖啶橙复合诱变苏云金芽胞杆菌,筛选得到一株遗传性状稳定的高效伴生菌F328,其与K.vulgare混合发酵的糖酸转化率提高7.77%,2-KLG浓度达到90.2 mg/mL。
低能离子注入诱变育种技术是近年发展起来的一种新型育种技术。低能离子通过能量沉积、动量传递、离子注入及电荷交换等引起生物细胞内遗传物质发生非致死性的局部突变,突变率达10%~20%,而且回复突变率极低。赵世光等[30]运用低能离子注入技术对大菌和小菌进行了选育,L-山梨糖转化为2-KLG的转化效率由75%提高到94%,使用诱变获得的 GO29-BM279 组合体系发酵,2-KLG的转化率高达93.4%。
空间诱变育种技术是一种借助航空器的新型育种技术。该技术利用太空的特殊环境,如宇宙射线、微重力、高真空、微磁场等因素,对微生物或植物种子进行诱变,最终筛选获得目的性状显著提升的突变株。中科院沈阳应用生态研究所与东北制药集团股份有限公司维C团队于2008年在神州七号飞船上进行了搭载维C发酵菌株的太空诱变试验,从上万株菌中筛选获得高效突变组合菌,其发酵的糖酸转化率提高到了94.5%[31]。
大气压冷等离子体对微生物及哺乳动物DNA的损伤效应,使其具有应用于细胞诱变的潜力。常压室温等离子体(RF APGD)可以在室温下产生稳定均匀的等离子体,采用射流方式与待处理样品作用,使其对微生物细胞的致死作用降低。RF APGD还可以产生高浓度的多种中性活性粒子,可导致细胞内遗传及代谢物质改变,具有活性粒子种类多、诱变速度快、安全等特点,是一种高效改造菌种的新方法。若将该技术用于维C菌种筛选,相信能获得大量高活性的伴生菌与产酸菌。
2.2 适应性进化选育
在微生物进化过程中,选择压力可以使微生物通过随机变异实现定向淘汰,而与环境相适应的基因型得以保存。在选育过程中,通过人工施加定向选择压力,使微生物沿着所需的方向进化,从而获得目标性状菌种。在当前维C混菌发酵机制尚未阐明的情况下,通过适应性进化选育来强化两菌间的相互作用,使两菌在发酵过程中更好地协调,从而达到选育高效菌种、提高产酸效率的目的。
高赟[32]通过GC-TOFMS技术分别检测混菌在传代过程中大、小菌和关键营养物质的变化,发现前50代混菌发酵的糖酸转化率波动大,至150代时糖酸转化率明显提高,这揭示了两菌间的交流使得彼此互相影响,菌株的优良性状也得到强化。邹旸[33]通过对混菌体系进行为期150 d的适应性进化选育,使两菌关系转变为趋于完全互利共生的关系,且得到转化率提高16%的高产小菌菌株。另外,底物抑制效应也是限制发酵产量的因素。曾伟主等[34]应用基于微流控技术的全自动高通量微生物液滴培养系统,将出发菌株在不同浓度梯度的L-山梨糖培养基中培养、传代,获得能够耐受高浓度L-山梨糖的进化菌株2-F6。
2.3 基因工程菌
混菌发酵过程涉及两菌共生关系,影响因素较多,难以精确控制,不少学者尝试采用构建基因工程菌的方法以达到单菌发酵替代混菌发酵。Cai等[16]采用基因工程方法把L.lactisMG1363的叶酸合成基因簇在K.vulgareDSM 4025中进行过表达,使K.vulgareDSM 4025生长更好,2-KLG产量也提高。Zeng等[35]将山梨糖/山梨酮脱氢酶(SSDHs)在大肠埃希菌中过表达,通过全细胞催化筛选可合成2-KLG的重组大肠埃希菌。然后在重组大肠埃希菌表达SSDHs的辅酶PQQ并优化催化条件,使重组工程菌的2-KLG产量进一步提高,在5 L发酵罐中,2-KLG产量达72.4 g/L,转化率为71.2%。该工程菌虽然较之前有大幅度提高,但与当前工业发酵水平仍存在较大差距。
3 发酵新技术与新工艺
3.1 混菌发酵新技术/工艺
与已报道的莱氏法、串联发酵法相比,“两步发酵法”仍然是目前最理想的2-KLG生产方法。因此,如何优化混菌发酵过程依然是目前研究的重点,主要研究方向包括:①现有工艺参数的局部优化。基于现有发酵工艺,对培养基和培养条件(包括溶解氧、pH、温度等)进行调整和优化。如采用响应面法,对发酵培养基的组成及比例进行优化,提高了大小菌数量和发酵效率[36];通过额外添加碳源、氮源和辅助因子,如明胶、谷胱甘肽等促进小菌生长和产酸[12,37];根据大、小菌生长及小菌产酸在不同阶段对养分和环境因子的需求不同,多人提出了分阶段控制环境条件以提高发酵效率的新策略,均不同程度提高了发酵效率[38];通过发酵过程补料策略解除底物抑制效应[36,39]。②基于双伴生菌的“三菌混合发酵体系”。本团队在研究不同大菌对小菌生长和产酸影响时发现,不同大菌进入对数期早晚和对数期持续长短有显著差异,它们在发酵前期和后期对小菌的伴生作用明显不同,即一种大菌在发酵前期对小菌的伴生效果较好,而另一种大菌则在发酵后期伴生效果较好。根据这一特性,我们提出了在发酵体系中加入两种伴生菌,分别为小菌在发酵前期和发酵后期提供更优的伴生条件,从而提高发酵效率。通过小试和中试,三菌混合发酵模式有效缩短了发酵周期,提高了发酵效率[3]。③含三种菌的“一步混菌发酵”。元英进团队依据共生原理,将一步发酵和二步发酵的三种菌放在一个发酵系统,构建了G.oxydans、K.vulgare和Bacillus混菌体系,以期缩短发酵周期并简化工艺流程,发酵在30 h内完成,2-KLG产量为73.7 g/L[40-41]。
3.2 单菌发酵新技术/工艺
混菌发酵过程存在两种菌之间的营养和空间竞争,导致发酵稳定性差、转化率低,也造成了原料浪费和成本居高不下。多年来,很多学者试图通过构建单菌发酵体系来取代现有的混菌发酵体系,期望能彻底摆脱混菌发酵中存在的上述问题。
一般地,单菌发酵的研发思路是构建能直接利用D-葡萄糖或D-山梨醇产2-KLG的基因工程菌。①通过代谢工程改造小菌菌株实现单菌发酵。王彩云[42]通过重构K.robustumSPU-B003的XFP-PTA代谢途径,使该菌株胞内乙酰辅酶A含量提高2.4倍,生物量和2-KLG产量分别提高17.27%和21.09%。②在工程菌中过表达转化酶以实现单菌发酵。周景文团队构建了一株过表达SDH的大肠埃希菌工程菌2-F6,在5 L发酵罐中2-KLG的产量达5.70 g/L,底物转化率达74.5%,但该菌株的转化率和古龙酸产量仍较现有混菌生产方法有较大差距[34]。Zeng等[35]在大肠埃希菌中过表达SSDHs及其辅酶吡咯喹啉醌(PQQ),使重组工程菌的2-KLG产量达72.4 g/L,转化率达到71.2%,具有经进一步改造后达到当前工业发酵水平的潜力。
鉴于目前已研发出的基因工程菌尚难以达到混菌发酵的转化率水平,本团队从混菌生态学的角度研究发酵工艺及其调控,以期进一步提高发酵效率。一方面,从细胞和分子水平上研究了混菌关系及相互作用机制[43-44],研发出一种三级种液制备新技术,使发酵终点时三级种液中伴生菌浓度下降90%、产酸菌浓度提高3倍,形成了在三级种子罐中以伴生活性物质替代伴生菌、解除伴生菌依赖性的发酵新技术;另一方面,研究了关键酶——山梨糖脱氢酶和古龙酸还原酶的催化特征[38],优化酶催化过程,即增加山梨糖脱氢酶活性、降低古龙酸还原酶活性,建立了细胞生长-酶促催化的发酵双平台控制新工艺[45-46];把解除伴生菌依赖性技术与双平台调控技术相集成,从而创建了在300 m3发酵罐上实现单菌发酵的维C发酵新技术及其工艺,新技术显著提升了发酵效率(批次产量提高6.04%,发酵周期缩短17.7%,整体发酵效率提升了27%)。另外,新工艺使伴生菌数量显著降低,从而有效降低了超滤工段的废菌渣排放量(减少25%),加速了企业的绿色生产进程。该技术已应用于东北制药集团股份有限公司,产生了较好的经济和环境效益。
4 展 望
在维C混菌发酵过程及机理的研究中,伴生菌的伴生活性物质的挖掘和鉴定仍然是当前和未来研究的重点。历年来的多项研究证实,伴生活性物质包括一种或多种蛋白类物质,且不同伴生菌的伴生蛋白在许多特性上明显不同。然而,至今未能鉴定出任何一个蛋白类伴生物质,阻碍了人们对伴生机制的深入认识以及进一步基于伴生机制研发发酵效率提升技术。若将蛋白质组学技术与稳定性同位素技术相结合,如采用SILAC技术等,可望有效缩小伴生蛋白的筛选范围,并最终确认出具有伴生活性的蛋白质。
高效菌种的选育一直是维C新技术研发与生产应用中一项十分重要的工作。但是,由于第二步混菌发酵是两种菌的混合发酵,因此在筛选高效菌种时,不仅需要分别单独筛选高效伴生菌和产酸菌,更需要在混菌模式下进行混合发酵的复筛。所以,采用新型诱变技术、开发高效筛选模型,将能大幅度提高高效菌种的筛选效率,达到事半功倍的效果。尽管已有的基因工程菌的转化率尚难以达到生产应用的程度,但毫无疑问,构建高效基因工程菌是未来实现单菌发酵的一条重要途径。在深入研究山梨糖/酮脱氢酶特性的基础上,构建以大肠埃希菌为载体的单菌转化体系,有望最终实现基因工程菌对山梨糖的高效转化(底物浓度>10%,发酵转化率>90%)。但如果把基因工程菌应用于工业化生产,还需进行一系列安全性评估并通过国内外相关食品/药品生产质量管理体系的认证。
维C生产原料消耗大、废渣液排放多。维C生产中排放的两种大宗废弃物废菌渣和废古龙酸母液,其COD值高、处理难度大,给企业带来巨大环保压力。科研人员应针对这两种大宗废弃物,开发其资源化利用新技术,如提取、挖掘、转化和利用其有效成分,最终实现变废为宝。这是促进维C产业绿色、可持续发展的一个重要的研究方向。
