短小芽孢杆菌HR10产孢培养基及发酵条件优化
2021-07-01王朝恩刘婉慧陆蓝翔付欢欢石慧敏史纪武叶建仁
王朝恩, 刘婉慧, 陆蓝翔, 付欢欢, 石慧敏, 史纪武, 叶建仁
(南京林业大学 南方现代林业协同创新中心 林学院,江苏 南京 210037)
随着我国森林绿化面积地不断扩大,人工林栽植面积逐年增加[1],在人工林的培育过程中,简单追求高产出,长时间过度使用化学肥料,造成土壤板结,破坏土壤结构,引起土壤养分失衡,进而引发树木生长不良,病害问题突出[2-4]。寻找有效提高土壤肥力、促进林木生长的方法,成为近年来研究的热点。陈延熙根据微生态学理论(Microecology)提出了“植物微生态学”的概念,即任何植物个体都是其组织细胞与其体内微生物组成的复合体[5],其原理是利用菌株抢占生态位[6],调节植物喜好的酸碱环境[7],建立生物屏障阻止有害微生物入侵,并刺激植物或者自身产生有益物质促进植物生长[8],提高植物抗病能力[6-9]。近些年微生物菌剂的研究逐渐深入,大量有益微生物得到推广和应用并取得了良好效果,如唐旭[10]在一年生黑松、马尾松和湿地松上施用解淀粉芽孢杆菌(Bacillusamyloliquefaciens) JK-AH7,促生效果明显。果树作为特种经济林具有较高的经济价值,常年单一树种种植,管理不当可能导致病原菌积累,在不利的环境下可能引起病害导致果树树势衰弱,果品质量下降,带来严重的生态危害和经济损失[11-12],如由葡萄座腔菌(Botryosphaeriadothidea)引起的苹果轮纹病、叶斑病[13],蓝莓的枯死病和溃疡病等[14]。杨星[15]在美国薄壳山核桃上施用多种有益微生物,表明合适的微生物菌剂可以有效提高植物光合作用,促进果树生长,增强树势。窦承阳等[16]在梨树上施用水拉恩氏菌(Rahnellaaquatilis) JZ-GX1显著增加了梨树的地径,提升了叶片生理指标,增加了土壤有效磷含量,平衡了土壤养分,提升了果实品质。大量研究结果表明有益微生物可以有效促进植物生长,提高植物抗病能力。传统的有益微生物的施用形式多为液体[10,15-16],存在运输成本高、储存时间短、存活率低等缺点,而固体菌剂因其体积小、货期长、活性高等优点受到了广泛关注。固体菌剂在制备过程中过低的存活率一直是研究的一大难点,芽孢(endospore)因其含水量极低,抗逆性强,能经受高温、紫外线、电离辐射以及多种化学物质灭杀等特性[17-18],在制备固体菌剂的研究中成为重要的一环[19]。已经有大量学者使用优化的培养基提高产孢率,如吴海霞等[20]对海洋解淀粉芽孢杆菌(Bacillusamyloliquefaciens)GM-1-1产孢培养基进行优化,细菌总数和芽孢率分别达7.40×109cfu/mL和89.42%,芽孢率的提高可以有效提升益生菌的生存能力及产品的稳定性,为其工业化生产提供广阔的前景。短小芽孢杆菌(Bacilluspumilus)HR10是本重点实验室在黑松-黄色须腹菌(Rhizopogenluteous, Rl)菌根根际土壤中分离得到的一株菌根辅助细菌(Mycorrhiza helper bacteria, MHB),属于芽孢杆菌属,革兰阳性,是一类严格需氧或者兼性厌氧、能够形成内生孢子的芽孢杆菌[21]。盛江梅等[22]对其离体互作试验结果表明,菌株HR10的菌体及胞外代谢产物均可有效提高Rl菌丝的生长,其菌体对Rl菌丝生长的增长率达到13.1%。盆栽试验表明,HR10菌株与Rl双接种黑松幼苗后,对松苗生长有显著地促进作用,还有效提高了根系的菌根侵染率。单接种HR10实验表明对黑松也有良好地促生效果。侯亮亮等[23]在将菌株HR10与苗木猝倒病病原丝核菌(Rhizoctoniasp.)离体平板对抗培养中发现其对病原菌有较为明显地抑制作用,抑菌率达85.58%。松苗活体实验中菌株HR10的发病率和病死率显著低于对照组,说明该菌株是一株优良的生防菌,应用潜力巨大。本研究通过对菌株HR10进行碳源、氮源、无机盐的筛选并研究其最佳的培养条件,以达到提高芽孢率,增加产品活性,降低成本的目的,为其日后的工业化提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 短小芽胞杆菌(Bacilluspumilus)HR10菌株由南京林业大学森林病理实验室提供,该菌株同时也保存于中国典型培养物保藏中心(CCTCC,NO. M2010143)。
1.1.2 培养基(g/L) ①细菌活化培养基(NA):牛肉膏3,NaCl 5,蛋白胨10,琼脂18,蒸馏水定容至1 L,pH 7.2。②细菌种子液培养基(液体LB):酵母膏5,胰蛋白胨10,NaCl 10,蒸馏水定容至1 L,pH 7.2。③计数培养基(固体LB):酵母膏5,胰蛋白胨10,NaCl 10,琼脂18,蒸馏水定容至1 L,pH 7.2。
1.1.3 主要仪器与设备 光照恒温摇床(TS-211GZ,上海仪纯实业有限公司);超净工作台(SW-CJ-2D,上海旌派仪器有限公司);pH计(JB/T 7815,梅特勒-托利多仪器有限公司);水浴锅(JK-WB-20B,上海精学科学仪器有限公司);高压灭菌锅(HVE-50,南京博惠科学仪器有限公司)。
1.2 方法
1.2.1 菌种的活化 取出保存于-80 ℃的菌种HR10,使用接种环采用平板划线法将原种液接种在LB固体平板上,28 ℃培养24 h。然后挑取单菌落接种在装液量为50/250 mL的NA培养基中,28 ℃,200 r/min培养18 h[24]。
1.2.2 种子液的制备 取活化后的菌液以1%(体积分数)的接种量接种于LB液体培养基中,LB培养基装液量50/250 mL,28 ℃,200 r/min培养18 h后备用。
1.2.3 活菌与芽孢的计数 采用稀释涂布平板计数法测定活菌量。取待测发酵液按稀释10-1~10-8梯度,最后分别吸取10-6、10-7、10-8稀释液200 μL于已静置24~48 h的LB固体培养基上,用无菌刮铲将稀释菌液涂抹均匀,为防止在培养过程中被污染,将培养皿用封口膜密封后,28 ℃培养24~48 h,计数各培养皿菌落数。芽孢计数时,先将待测菌液80 ℃水浴10 min,只保留存活的芽孢,然后进行芽孢计数,其计数方法与活菌计数方法相同,芽孢率(%)=芽孢数/活菌数×100%[25]。
1.2.4 发酵液中不同培养时期芽孢率变化曲线的测定 使用初始LB液体培养基,在发酵培养的0、8、16、28、40、52、64、76、88、100 h分别测定发酵液中的活菌数和芽孢数。发酵培养液的接菌量为2%(体积分数),装液量50/250 mL,培养条件为28 ℃,200 r/min。
1.2.5 培养基优化 ①单因素筛选:a.最佳碳源及浓度的筛选:用葡萄糖、糖蜜、玉米粉、麦芽糖、淀粉、蔗糖等相等质量分别代替LB培养基中的碳源,250 mL三角瓶装液量40%(体积分数),接种量2%(体积分数),200 r/min,28 ℃摇床培养64 h计数。测定每毫升活菌数和芽孢数并计算芽孢率。并将糖蜜和葡萄糖分别以0.3%、0.5%、0.8%、1%、2%、3%、4%、5%、8%、10%(质量分数)混合配制培养基,其他成分及培养条件不变,确定碳源浓度添加范围。b.最佳氮源及浓度的筛选:生豆粉、豆粕粉、豆饼粉、鱼粉、大豆蛋白胨、尿素含有氨基酸、酰胺和胺等可以被细菌转化吸收合成蛋白质,核酸及含氮的代谢产物等可以作为有机氮源,硫酸铵、硝酸铵中的铵盐可以直接被利用作为无机氮源[26]。将上述氮源等质量代替LB培养基中的氮源,确定最佳氮源,并将确定的氮源分别设置为0.3%、0.5%、0.8%、1%、2%、3%、4%、5%(质量分数),其他成分不变,培养条件同①a,确定氮源浓度范围。c.最佳无机盐及浓度的筛选:林司曦等[24]研究结果表明,KCl对菌种HR10生长具有明显促进作用,选用KCl作为其中一种确定的无机盐并探索其最佳浓度,再分别添加0.1%(质量分数)的K2HPO4·3H2O、MnSO4、NaCl、FeSO4·7H2O、CaCO3、KH2PO4、FePO4·4H2O、ZnSO4、MgSO4·7H2O等无机盐,培养条件同①a,确定最佳无机盐种类,并将确定的无机盐分别设置为0.3%、0.5%、0.8%、1%、2%、3%、4%、5%(质量分数),添加①a、①b筛选出的最佳碳氮源,培养条件同①a,确定无机盐浓度添加范围。以上每个处理均进行3次生物学重复。②培养基优化的正交试验:根据单因素试验筛选出的培养基最佳碳源组合、氮源和无机盐的种类和浓度(质量分数),设计正交试验L9(33)(表1)配制不同培养基进行菌株HR10摇床培养试验,培养条件同①a,每个处理3次生物学重复。
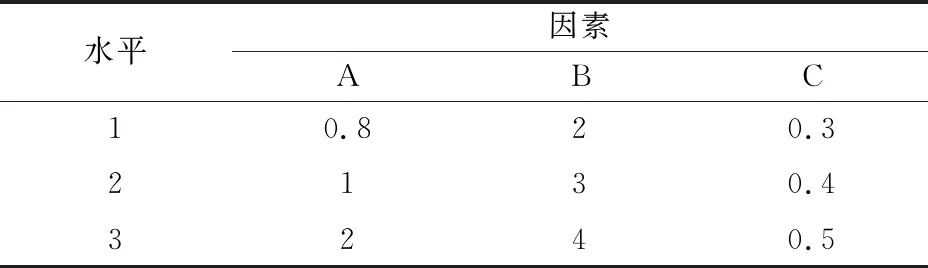
表1 碳源、氮源和无机盐优化的正交试验因素与水平Table 1 Orthogonal test factors and levels for optimization of carbon source,nitrogen source and salt inorganic salt
1.2.6 培养条件优化 选择正交试验优化的培养基,对温度、初始pH值、接种量、装液量、转速5个因素依次进行单因素试验,确定最佳发酵条件。每个处理均进行3次生物学重复。
2 结果与分析
2.1 芽孢生长曲线的绘制
图1为在最佳培养基和最佳发酵条件确定之前进行的发酵试验数据,从图1可以看出,菌株 HR10活菌数总体都不高,且呈现先升高再下降的趋势,可能因为营养物质逐步被消耗,活菌数在发酵28 h时,达到最大值为3.9×109cfu/mL,最高芽孢率出现在76 h,但是,最高芽孢数量则出现在64 h,为3.9×108cfu/mL,说明营养体达到最大值后随时间推移逐步减少,而芽孢则逐渐增多。因此,选取芽孢数量最大的时刻即64 h作为后续试验的芽孢量测定时间点。
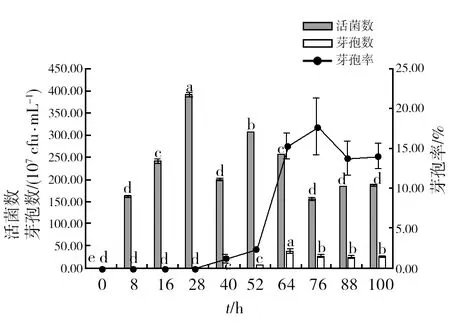
图1 不同时间的活菌数、芽孢数和芽孢率Fig.1 The number of bacteria, spores and spore formation rate at different times柱形图小写字母表示数据之间存在显著性差异,下图同Lowercase letters in the column chart indicate significant differences between the data, the same as in the figure below
2.2 培养基单因素筛选结果
2.2.1 最佳碳源筛选 由图2可知,在不同的碳源培养基中,添加葡萄糖和糖蜜的培养基所获得的活菌数和芽孢数均显著高于其他碳源培养基,活菌数分别达9.39×109cfu/mL和9.26×109cfu/mL,芽孢数分别为6.01×109cfu/mL和61.3×109cfu/mL。虽然蔗糖培养基的芽孢率最高,但因为其活菌数和芽孢数均较少,所以不宜作为目标碳源。玉米粉芽孢率低,也不作为目标碳源。葡萄糖和糖蜜两者差异不明显,且均具有较高的芽孢率。综合考虑,本研究将葡萄糖和糖蜜按质量比1∶1添加,作为组合碳源。
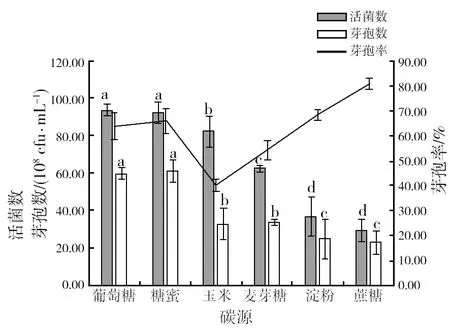
图2 不同碳源对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.2 The number of living bacterium, spores and spore formation rate of HR10 strains with different carbon source
2.2.2 最佳氮源筛选 由图3可知,在不同氮源培养基中,添加无机氮源的培养基中活菌数和芽孢数显著低于添加有机氮源的培养基,说明菌株HR10不能有效地利用无机氮源。添加豆制氮源的培养基明显好于其他种类氮源的培养基,其中添加豆饼粉的培养基中活菌数和芽孢数最高,分别为5.06×109cfu/mL和4.05×109cfu/mL,芽孢率可达70.94%。因此,选择豆饼粉作为最佳氮源。
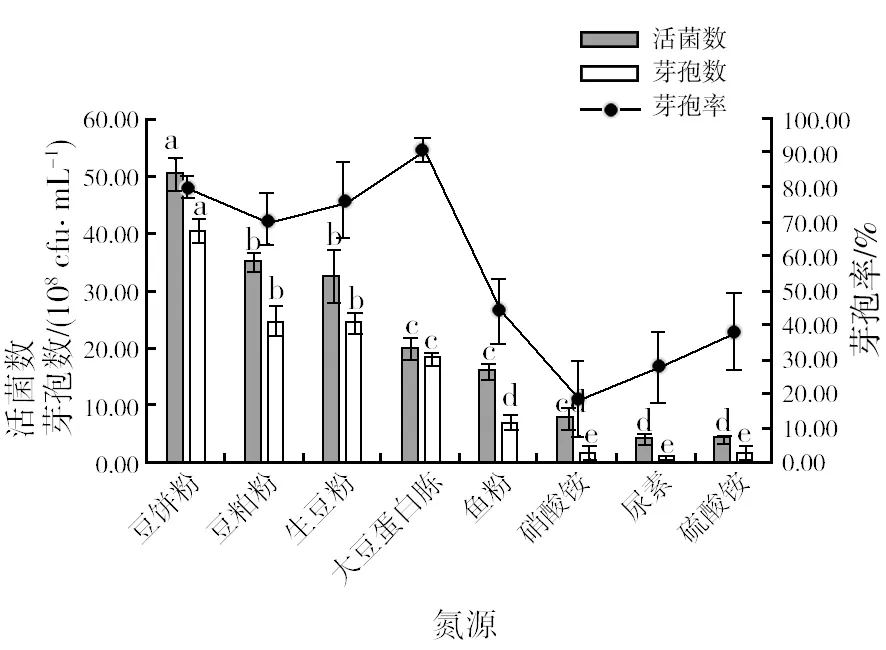
图3 不同氮源对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.3 Different nitrogen source medium HR10 strain number of living bacterium, the rate of spore number and spore
2.2.3 最佳碳源浓度筛选 由图4可知,在不同浓度糖蜜和葡萄糖培养基中,浓度1%时的活菌数和芽孢数最高,分别达到9.89×109cfu/mL和7.68×109cfu/mL,但芽孢率则是在浓度为0.8%时达到最大,且随浓度增加呈现逐步递减的趋势。因此,选取组合碳源浓度0.80%、1.00%、2.00%做三个水平的正交试验。
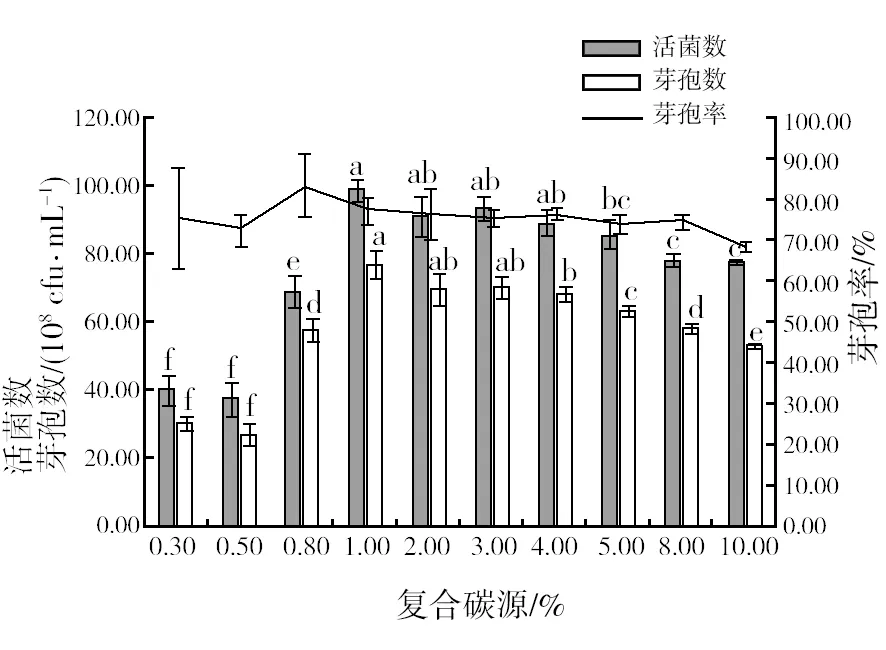
图4 不同浓度碳源对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.4 Viable bacterial count, spore count and spore rate of HR10 strains in different carbon source concentrations
2.2.4 最佳氮源浓度筛选 由图5可知,菌株 HR10的活菌数和芽孢数随着培养基中豆饼粉浓度的增加逐渐增大,当豆饼粉浓度3.00%时最高,分别为1.12×1010cfu/mL和9.48×109cfu/mL,随后逐渐下降。芽孢率变化不大,均在80%左右。因此,选取2.00%、3.00%、4.00%作为正交试验的三个水平。
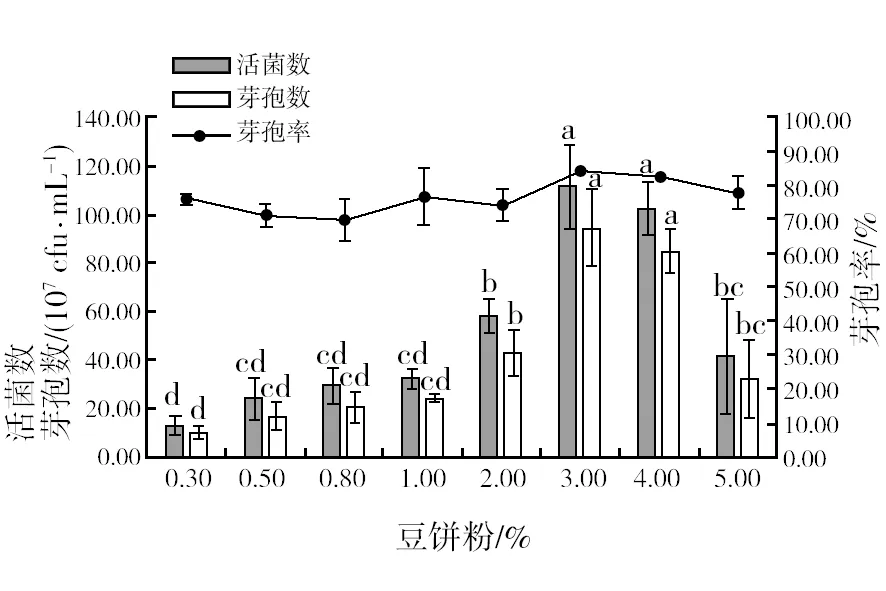
图5 不同浓度氮源对菌株HR10活菌数、芽孢数和芽孢率的影响
2.2.5 最佳KCl浓度筛选 由图6可知,芽孢率随着KCl浓度升高而逐渐升高,当浓度为0.3%时,活菌数和芽孢数达到最大为1.31×1010cfu/mL和1.05×1010cfu/mL,随后活菌数和芽孢数逐步下降,因此,选择浓度为0.3%的KCl作为一种固定无机盐进行添加。
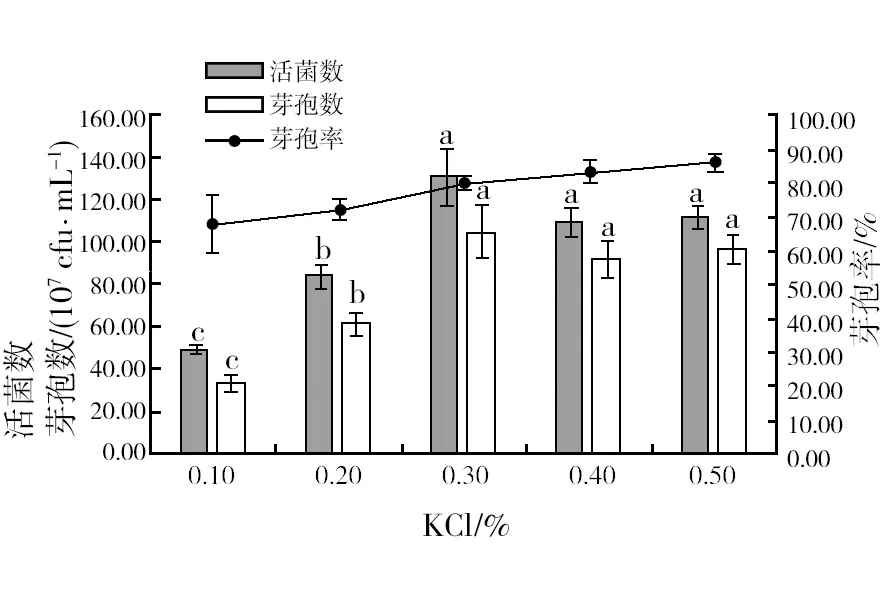
图6 不同浓度KCl对菌株HR10活菌数、芽孢数和芽孢率的影响
2.2.6 最佳无机盐种类的筛选 由图7可知,菌株HR10在聚乙烯醇培养基中的芽孢率仅为37.55%,显著低于添加其他无机盐的培养基。在添加了不同种类无机盐的培养基中,以MnSO4的培养基所产生的活菌数、芽孢数和芽孢率均最大,分别为2.71×1010cfu/mL、2.47×1010cfu/mL和91.50%。在添加了K2HPO4·3H2O 的培养基中,虽然其活菌数量最大,但因其芽孢率较低,仅为4.01%,故不作为备选无机盐。综合分析,选择MnSO4作为 菌株HR10的发酵培养基的无机盐。
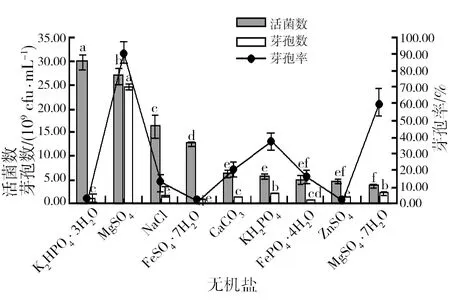
图7 不同无机盐种类及聚乙烯醇对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.7 Different types of inorganic salt and polyvinyl alcohol medium HR10 strain number of living bacterium, the spore number and the rate of spore
2.2.7 最佳无机盐浓度的筛选 由图8可知,当MnSO4浓度0.2%~0.5%时,菌株HR10的芽孢数差异不显著,但0.4%时,活菌数最大,为1.40×1010cfu/mL,所以选择MnSO4浓度为0.3%、0.4%、0.5%作为后续正交试验的三个水平。

图8 不同浓度MnSO4对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.8 The viable count, spore count and spore rate of HR10 strain in different MnSO4 concentration media
2.3 发酵培养基基质组成的正交试验结果
由正交试验结果(表2)可知,对菌株HR10芽孢产量影响最大的是葡萄糖和糖蜜等质量混合添加的组合碳源,其次是MnSO4,最后为豆饼粉,对应的最佳浓度组合为A2B1C2,即葡萄糖1%,糖蜜1%,豆饼粉2%,无机盐MnSO40.4%,芽孢数可达1.78×1010cfu/mL。
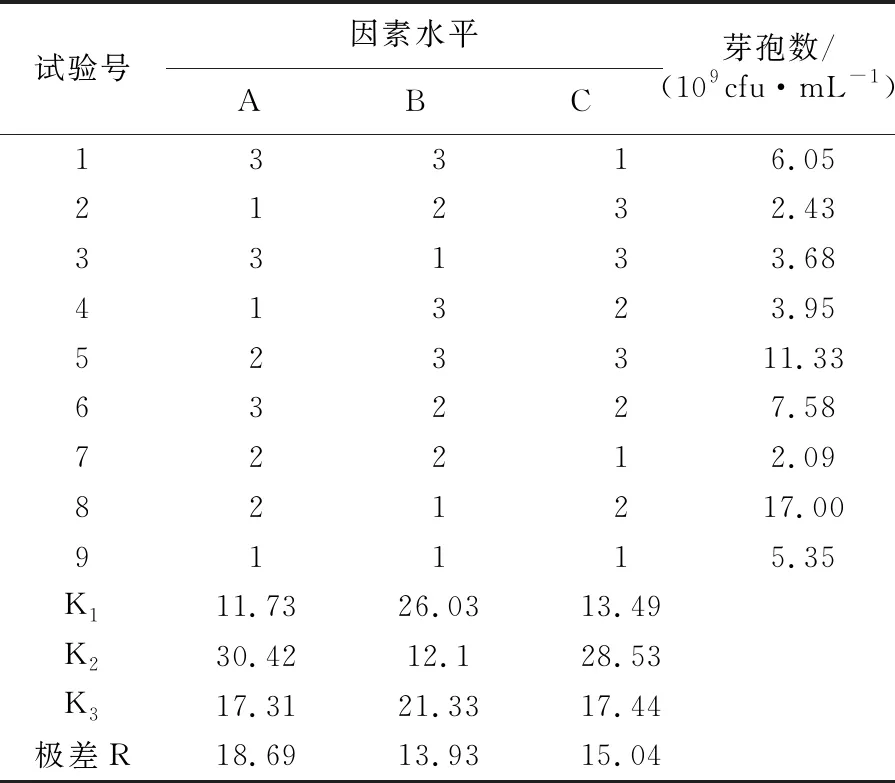
表2 碳源、氮源和无机盐优化的L9(33)正交试验结果Table 2 L9(33)orthogonal test results optimized for carbon source,nitrogen source and inorganic salt
2.4 培养条件单因素优化结果
2.4.1 最佳培养温度筛选 由图9可知,随着温度的升高,活菌数和芽孢数呈现先减少后增多的趋势。温度为37 ℃时,活菌数和芽孢数均达到最大,分别为1.48×1010cfu/mL和1.43×1010cfu/mL。因此,选择37 ℃作为菌株HR10摇瓶培养的最佳发酵温度。
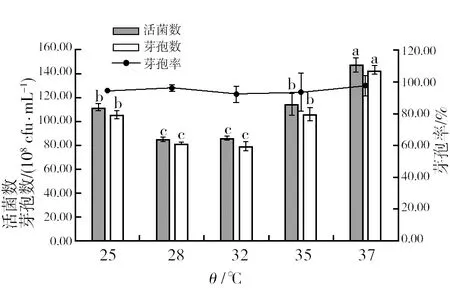
图9 不同温度对菌株HR10活菌数、芽孢数和芽孢率的影响
2.4.2 最佳pH的筛选 由图10可知,在不同的pH培养基中,菌株HR10产生的菌数和芽孢数明显有不同,pH 7时,活菌数和芽孢数最高,分别为1.74×1010cfu/mL和1.64×1010cfu/mL,芽孢率达到94.22%。说明菌株HR10在中性的环境下更适合生长。因此,选用pH 7作为菌株HR10摇瓶培养的最佳pH。
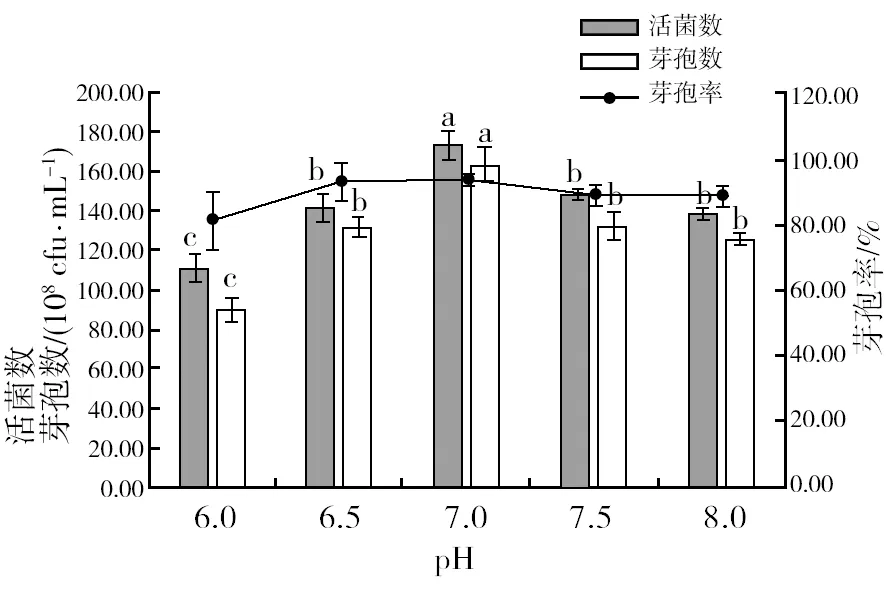
图10 不同pH对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.10 Viable bacterial count, spore count and spore rate of HR10 strain in different pH media
2.4.3 发酵容器最佳装液量筛选 由图11可知,发酵容器不同的相对装液量对菌株HR10的活菌数有较大的影响,30%装液量时,活菌数达到最大,为3.79×1010cfu/mL,50%装液量时,芽孢率和芽孢数分别达到89.59%和 1.74×1010cfu/mL,说明50%装液量时的氧气浓度更有利于芽孢形成。因此,选择菌株HR10摇瓶培养的最佳装液量为50%。
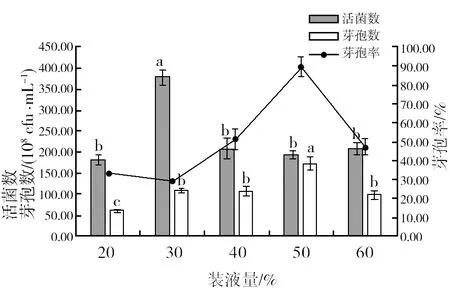
图11 培养基不同装液量对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.11 Viable bacterial count, spore count and spore rate of HR10 strains in different media with different liquid volume
2.4.4 最佳接种量筛选 由图12可知,接种量5%时,芽孢数最高,为1.99×1010cfu/mL,但接种量超过5%时,芽孢数显著下降,活菌数随接种量增加而逐渐增高,接种量15%时,达到最高为3.59×1010cfu/mL。因为芽孢数是发酵产品的最重要指标,所以确定菌株HR10摇瓶培养的最佳接种量为5%。
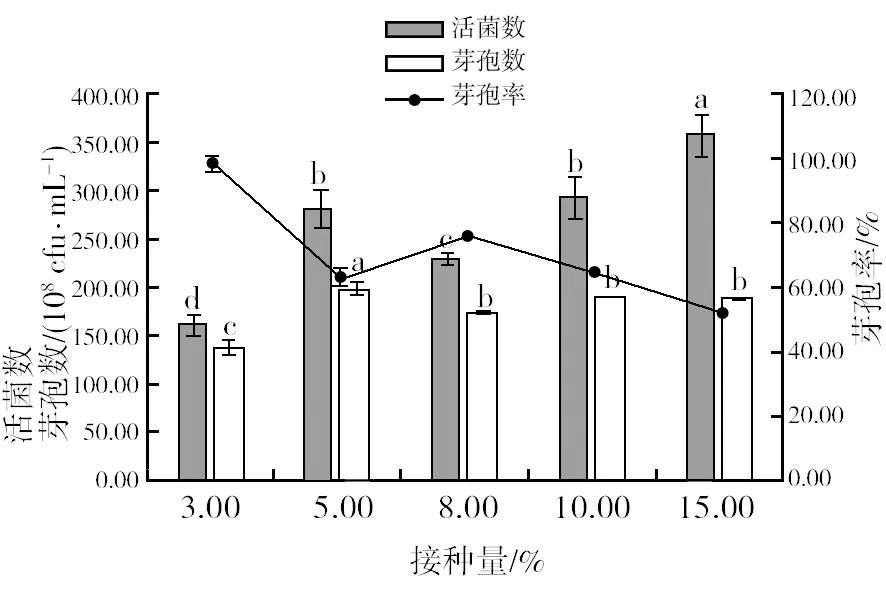
图12 不同接种量对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.12 Viable bacterial count, sporecount and spore rate of HR10 strains in different inoculum media
2.4.5 最佳培养转速筛选 由图13可知,随着转速的增加,菌株HR10的活菌数、芽孢数和芽孢率均逐渐升高,当转速为220 r/min时,达到最大,分别为2.47×1010cfu/mL、2.35×1010cfu/mL和94.70%,超过220 r/min,则呈现下降趋势,说明转速比较高时,菌体可能发生细胞自溶现象。因此,选取220 r/min作为菌株HR10液体发酵的最佳转速。
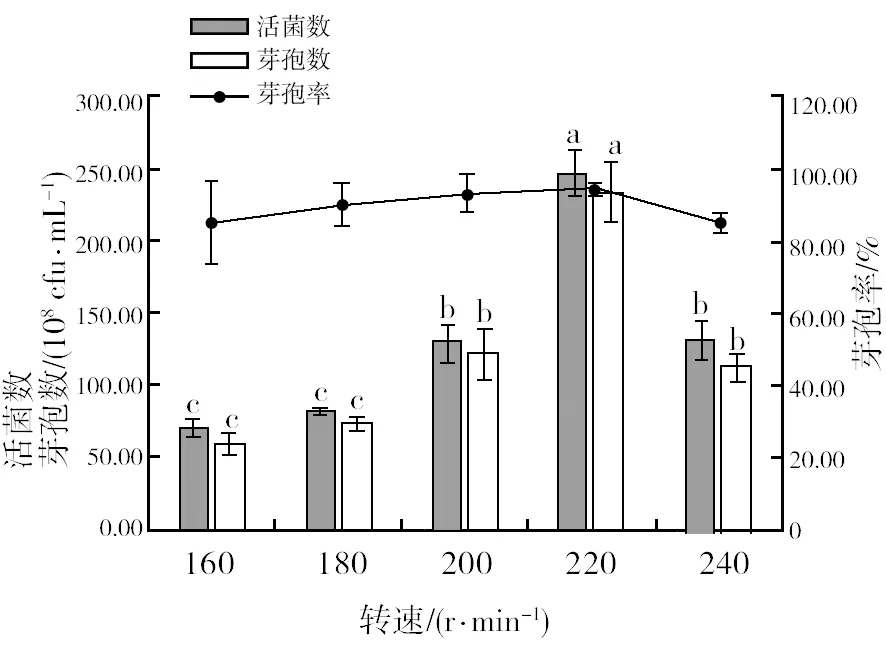
图13 不同转速对菌株HR10活菌数、芽孢数和芽孢率的影响Fig.13 Viable bacterial count, spore number and spore rate of HR10 strain in different speed culture media
2.4.6 最佳发酵时间筛选 由图14可知,发酵液在培养24 h时,活菌数达到最大值,为2.60×1010cfu/mL,随后出现急剧下降,在40 h时又开始增加,最后在52 h达到顶峰,之后缓慢下降。芽孢数随着时间推移逐步增加,在52 h时达到最大,为2.37×1010cfu/mL,之后开始下降,芽孢率在52 h达到最大,为94.46%,所以选择最佳培养时间为52 h。
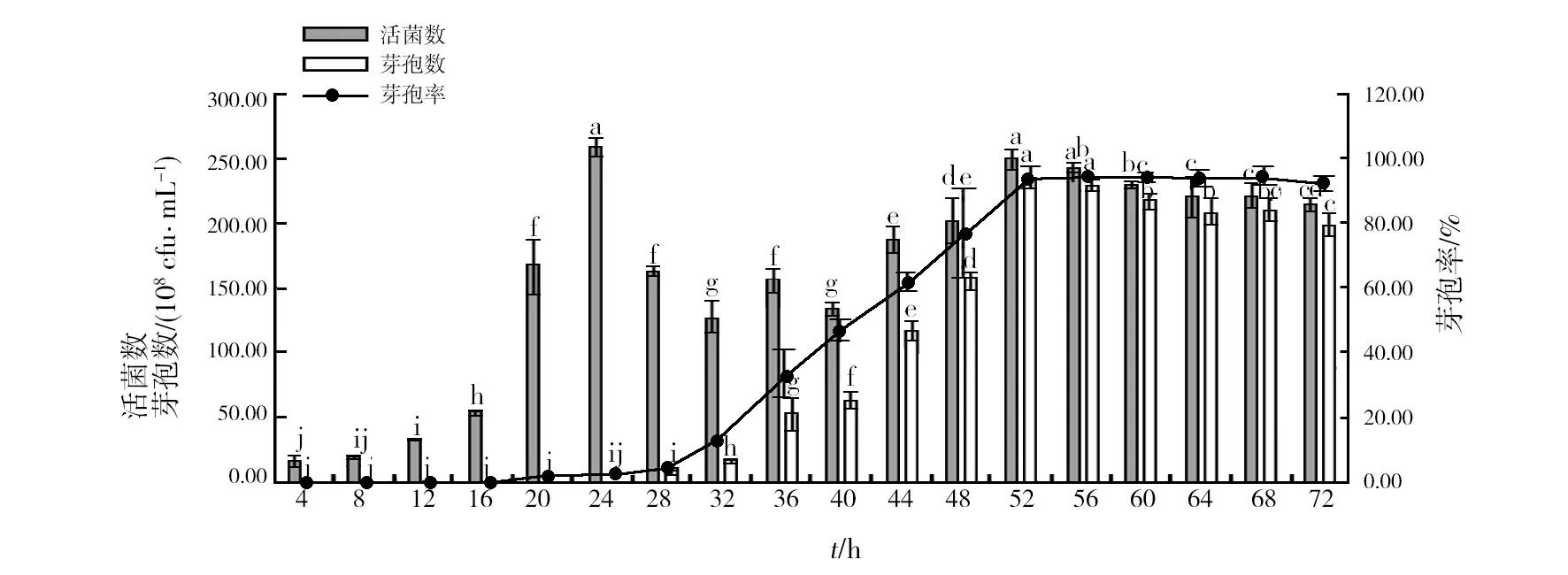
图14 最适培养基和培养条件下不同时间菌株HR10的活菌数、芽孢数和芽孢率Fig.14 The number of viable bacteria, spore number and spore rate of HR10 strain at different time under the optimal medium and culture conditions
3 讨 论
本研究表明,短小芽孢杆菌HR10菌株的培养基最佳成分为葡萄糖1%、糖蜜1%、豆饼粉2%、KCl 0.3%、 MnSO40.4%。最佳发酵条件:温度37 ℃、pH 7、250 mL三角瓶装液量50%、接种量5%、转速220 r/min、培养时间52 h。芽孢因其特殊结构具有极强的抗逆性,在活菌制剂工业中表现出极高的应用价值[27]。芽孢的形成主要是菌体遇到了恶劣的生存环境,如营养条件、环境因素等。在培养过程中合理的碳氮用量可以有效地促进芽孢形成,缩短芽孢产生的时间。刘春红等[28]对枯草芽胞杆菌(Bacillussubtilis)B201菌株的产孢培养基进行优化,确定了最佳培养基成分(g/L):米粉3、糖蜜10、豆粕粉10、鱼粉10、K2HPO42、Na2HPO42、MgSO40.5、MnSO40.5,大幅缩短了产孢培养时间,从而节省了能源,降低了成本。所以对有益微生物快速产孢培养基的研究以及微生物制剂的生产和应用都显得至关重要。
本研究通过对短小芽孢杆菌(Bacilluspumilus)HR10菌株的最佳产孢和发酵培养基进行研究表明,葡萄糖和糖蜜组合碳源可以有效提高菌株HR10的产孢率,葡萄糖作为速效碳源可以使菌体快速生长,缩短发酵时间,糖蜜可以使菌体维持较高的芽孢率并且作为工业副产品价格低廉,适合作为培养基成分。不同氮源的筛选结果表明,无机氮源不利于HR10菌体生长及产孢,这与王继雯等[29]的研究结果相同。相对于生豆粉和豆粕粉而言,豆饼粉对菌体产孢促进效果最好,可能与发酵过程中生豆粉产生大量气泡从而使环境改变有关,而在豆粕粉作为氮源的培养基中,菌株HR10的活菌数和芽孢数低很可能是营养物质含量低所致。研究表明在培养基中添加适当的无机盐离子可以有效促进芽孢形成[30],如Mn2+、Ca2+、Mg2+、Fe2+和一些磷酸盐类等,这主要与芽孢中含有的特殊成分吡啶二羧酸有关,其可以整合不同的二价阳离子形成螯合物使芽孢核心高度矿化脱水,使其具有抵抗高温的能力[31]。本研究表明,Mn2+对菌株HR10产芽孢具有非常显著的促进作用,Mn2+是多种酶的辅助因子[24],Mn2+可以增加芽孢的产率,使其更加稳定,进一步改善芽孢的皮层结构,增加耐热性,在制备微生态制剂过程中可以有效提高产品的质量,延长保存时间。同时,因本实验结果选用的碳氮源多是工业副产品,使用成本得以大幅降低,有利于菌株HR10的工业化生产。
发酵条件也对细菌芽孢的产生具有一定的影响[32-33],本研究在进行温度单因素试验时发现,25 ℃相对于28 ℃和32 ℃,可使菌株HR10具有更高的活菌数和芽孢数,这可能是因为B.pumilusHR10是一种植物根际促生细菌,相对的低温更加有利于其生长。35~37 ℃时又增高,37 ℃达到最大,说明温度对芽孢数和活菌数有一定的影响。初始pH在细菌培养的初始阶段则显得更加重要,合适的pH值可以使菌体在指数期更加快速的生长,活菌数量的峰值更高,如杜冰等[34]研究发酵培养芽孢乳酸杆菌(Lactobacillussporogenes)D-1表明,pH 7比pH 2时最终活菌数高出了6个数量级。过高的转速使自溶酶(autolysin)释放,溶解细菌胞壁质,造成细胞内容物释放,发生细胞的自溶现象,pH、温度也对细胞自溶有一定的影响[27]。
固体菌剂常用的干燥方法有喷雾干燥、流化床干燥、真空干燥、真空冷冻干燥、喷雾冷冻干燥法等。由于冷冻干燥的高成本和能量消耗,使喷雾干燥制备固体菌剂的研究更为广泛[35]。由于培养物在干燥期间存活率低,贮存期间稳定性低等缺点[36-38],而芽孢因其极强的抗逆性,因此,提高培养物芽孢数量和芽孢率在固体菌剂的制备和储存过程中有极其重要的作用,对生防菌大面积推广具有深远意义。
