红色诺卡菌固体培养基配方的优化
2021-07-01章朦玥薛金艳张怡轩
王 琳, 章朦玥, 薛金艳, 南 宁, 王 丹, 张怡轩*
(1.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;2.辽宁格瑞仕特生物制药有限公司,辽宁 本溪 117004)
宫颈癌是全球女性中第四大最常见的癌症[1],也是全球女性癌症相关死亡的主要原因[2]。全世界每年被诊断患有宫颈癌的妇女约有50万人,死亡率为9%,且在发展中国家宫颈癌的发病率和死亡率仍居高不下[3]。我国每年新增宫颈鳞状细胞癌13万例,占全球新诊断病例的28%[4]。哈拉尔德·楚尔·豪森1972年提出人乳头瘤病毒(HPV)导致宫颈癌,由此获得2008年医学诺贝尔奖[5]。临床研究表明,宫颈炎、宫颈癌前病变以及宫颈癌患者发病多与HPV的感染有关[6],机体对HPV感染以局部免疫应答为主,其持续感染与免疫应答异常密切相关[7],在免疫应答过程中,以γ-干扰素(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-21(IL-21)为代表的细胞因子在细胞免疫、体液免疫和免疫调节中发挥着重要作用[8]。外用红色诺卡氏菌细胞壁骨架(Nocardiarubracell wall skeleton, Nr-CWS,国药准字S20030009)由红色诺卡菌经过固体扩增发酵收集、细胞破碎、精细提纯、灭菌后获得,再加入辅料冻干等一系列步骤制得成品。主要成分为胞壁酸、阿拉伯半乳聚糖、粘肽(肽聚糖PGN),可以有效清除HPV亚型感染,逆转低度宫颈细胞学异常[9], 并增加转化生长因子-β1(TGF-β1)的表达,促进血管生成,促进皮肤创面愈合[10],具有免疫活性强、副作用小的特点[11]。已有研究表明,当HPV持续感染时,巨噬细胞(Mø)及朗格汉斯细胞(LC)活性低,当外用红色诺卡氏菌细胞壁骨架介入后,通过模式识别,与Mø和LC的相应的表面表达结合,促进Mø和LC的活化增殖。同时在非特异性免疫及特异性免疫的作用下清除HPV感染[12]。培养基优化的常用方法有单因素和正交试验设计,单因素试验设计只考虑某一因素的影响,正交试验设计只能得到最佳因素水平的组合,都没有研究因子之间的相互作用[13];响应面优化设计法是基于正交试验的缺陷而产生[14],是一种处理复杂关系和优化多种因素的实用统计方法[15],它能拟合因素与响应间的全局函数关系,有助于快速建模,对函数的响应面和等高线进行分析,缩短优化时间和提高应用可信度[16-17],与传统优化方法比较,响应面优化设计法更有利[18]。本研究拟采用Plackett-Burman法,从原培养基组分中找出对影响红色诺卡菌细胞生物量的主要因素[19],再通过中心组合设计实验(CCD),拟合建立描述响应量与自变量关系的多项式回归模型,找到最优配方组合,以优化培养基配方,增加红色诺卡菌的细胞生物量,提高产能,并将其应用于工厂中进行验证评估。
1 材料与方法
1.1 材料
1.1.1 菌种来源 红色诺卡菌(Nocardiarubra) Nr-8206,由辽宁格瑞仕特生物制药有限公司提供。
1.1.2 培养基 ①甘油琼脂培养基(原固体发酵培养基):牛肉膏5 g,蛋白胨10 g,甘油10 mL,NaCl 5 g,Na2HPO4·12H2O 0.3 g,琼脂20 g,pH 7.2~7.5,蒸馏水1 000 mL,用于菌株活化和培养;②肉汤培养基:甘油琼脂培养基(原固体发酵培养基)不加琼脂,用于种子培养。以上培养基均121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂与仪器 牛肉膏、蛋白胨(北京奥博星生物技术有限责任公司);甘油、NaCl、Na2HPO4·12H2O、琼脂(国药集团化学试剂有限公司)。电子天平(上海海康电子仪器厂); LDZX-40SBI型自动电热压力蒸汽灭菌器(上海申安医疗器械厂);标准型PB-10全自动pH计(德国赛多利斯集团);SW-CJ-ZD型双人单面超净工作台(苏州净化设备有限公司);DGG-9070A型电热恒温鼓风干燥箱(上海森新试验仪器有限公司);恒温振荡器(北京凯慕生物技术有限公司);TGL-16B台式离心机(上海安亭科学仪器厂)。
1.2 方法
1.2.1 红色诺卡菌菌种活化 将菌种进行两代活化。将菌体均匀涂布在甘油琼脂培养基的试管斜面培养基表面,33 ℃培养4 d后用1 mL无菌水冲洗斜面上的菌体,吸出菌悬液转接至装有甘油琼脂培养基的克氏瓶培养基内,再用2 mL无菌水冲洗斜面上的残菌并转接至克氏瓶培养基内,L形棒涂布菌悬液于克氏瓶培养基表面,33 ℃培养4 d。
1.2.2 红色诺卡菌的种子液制备 克氏瓶培养结束后,用15 mL无菌水冲洗培养基表面的菌体,将菌体接种于肉汤培养基的三角瓶内,33 ℃、150 r/min培养4 d,培养结束后离心弃去培养基,加无菌水800 mL分散菌体,种子液制备完成,再将种子液轻轻晃动使菌体均匀分散,每个克氏瓶接种5 mL。
1.2.3 Plackett-Burman(PB)实验 选取基础培养基组分甘油、牛肉膏、蛋白胨、Na2HPO4·12H2O、NaCl 5个因素进行考察,每个因素取上限(+1)、下限(-1)两个水平(表1),以Nr-8206的细胞生物量为响应值,得到5因素12组实验组合(表2),33 ℃培养5 d后,将克氏瓶内培养基上的菌苔用无菌水洗下,分别离心弃去上清液,称量菌体重量,得出最终细胞生物量。通过分析实验结果找出影响细胞生物量的影响因素。

表1 Plackett-Burman试验变量的取值范围
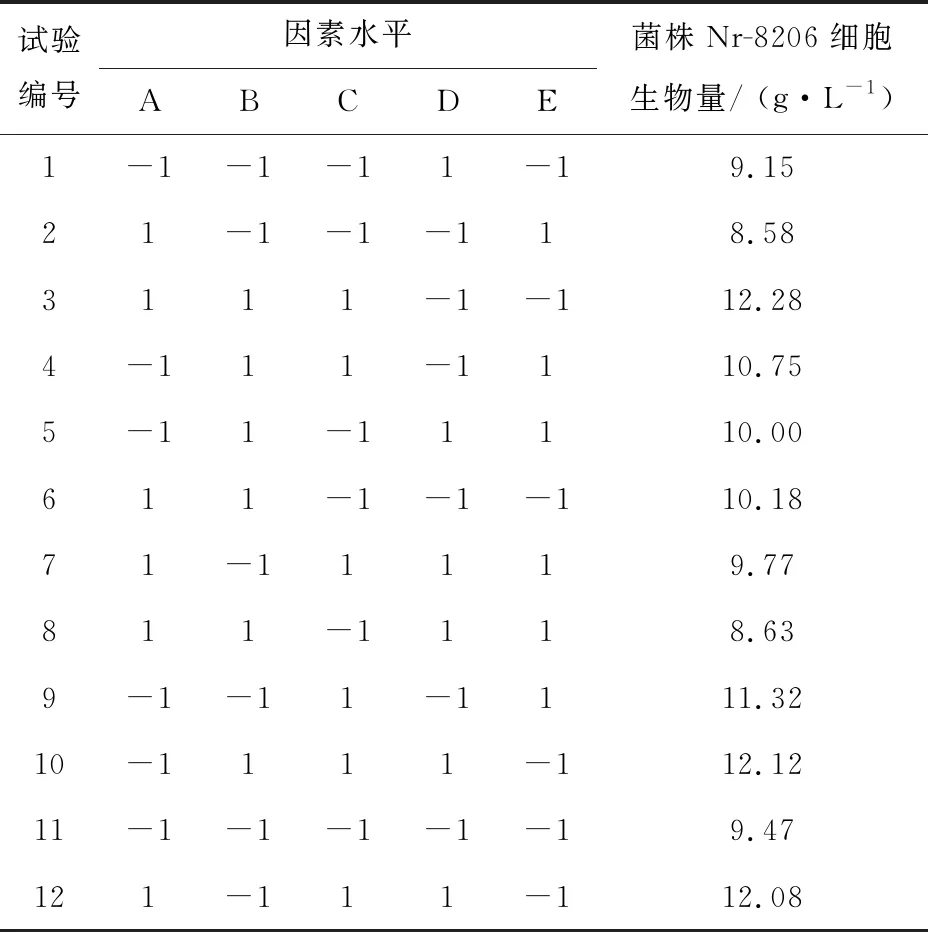
表2 Plackett-Burman实验设计及结果
1.2.4 最陡爬坡实验 将通过Plackett-Burman获得的重要因素,以实验值变化的梯度方向为爬坡方向,根据因素的效应值大小确定变化步长,逼近最大响应区域。
1.2.5 CCD试验设计和响应曲面分析 以菌株Nr-8206的细胞生物量为主要目标,根据最陡爬坡实验结果,进行CCD实验,设计3个因素及5个水平,分别以(-1.682、-1、0、1、1.682)编码,如表3所示,拟合建立描述响应量与自变量关系的多项式回归模型,找出重要因素的最佳配方水平。
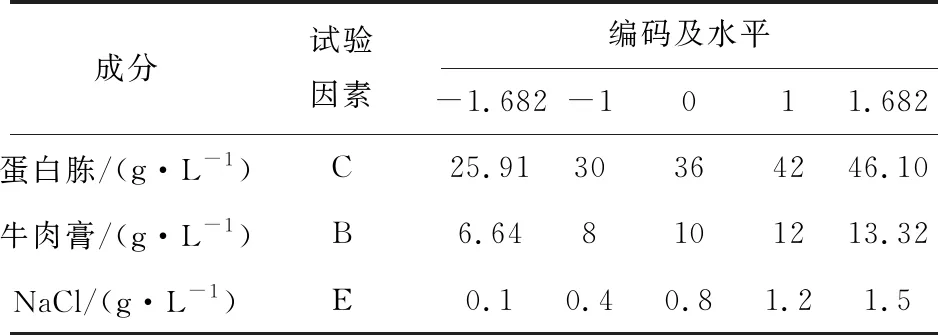
表3 CCD试验设计因素及水平
1.2.6 培养基优化结果验证 将优化后的培养基配方应用于工厂的生产发酵,进行生产放大实验验证。生产步骤和其后各工艺步骤不变,用以比较细胞生物量。
2 结果与分析
2.1 Plackett-Burman实验结果
根据Plackett-Burman(PB)实验组合的结果,方差分析见表4,多元回归方程:
细胞生物量(g/L)=10.36-0.107 5A+0.299 2B+1.03C-0.069 2D-0.519 2E
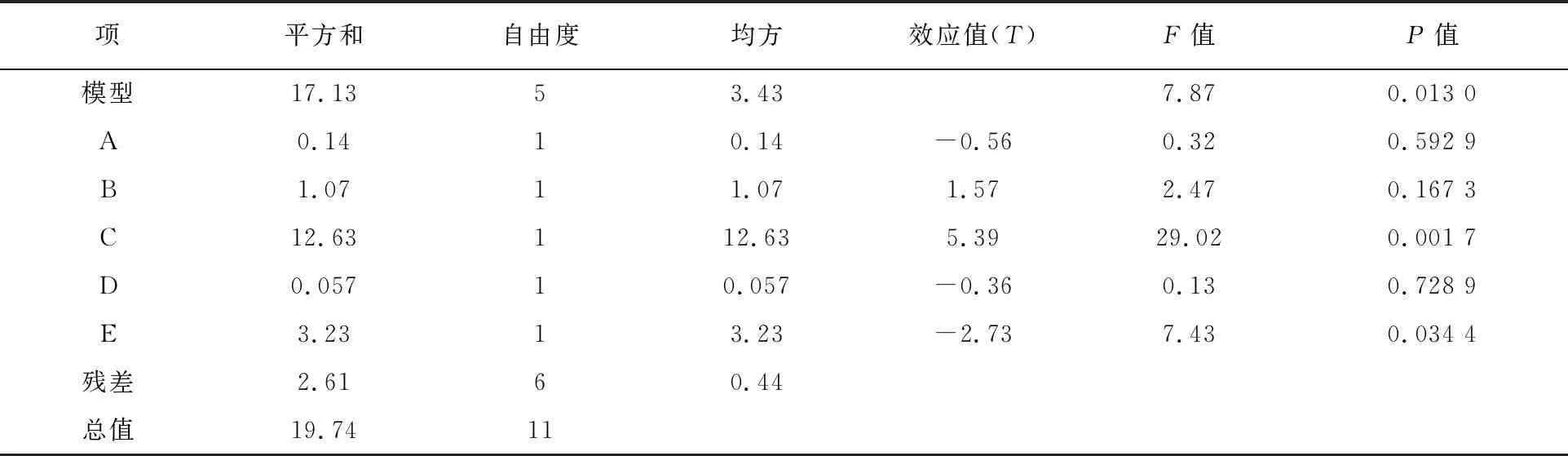
表4 Plackett-Burman实验设计方差分析
方程中A、B、C、D、E为编码值。模型的相关系数R2=0.867 7,说明回归有效, F=7.87,说明模型显著。模型中因素的P值越小说明影响越显著,即培养基配方对菌株细胞生物量影响大小排序为蛋白胨(P=0.001 7)>NaCl(P=0.034 4)>牛肉膏(P=0.167 3)>甘油(P=0.592 9)>Na2HPO4·12H2O(P=0.728 9)。后续实验选择蛋白胨、NaCl、牛肉膏作为显著性影响因素。
方差分析模型的P=0.013 0,证明回归方程是显著的,即模型回归区域拟合较好,模型相关系数R2=0.867 7,说明相关性较好。调整后R2=0.757 5,说明75.75%实验数据的变异性可用此回归模型来解释。通常变异系数(C.V.)越低,则实验的可信度和精确度越高,该PB实验的变化系数值=6.37%,说明可信度和精确度较好。
2.2 CCD设计及实验结果
2.2.1 最陡爬坡实验结果 将PB实验得到的重要因素(蛋白胨、牛肉膏、NaCl)的浓度进行最陡爬坡实验。设蛋白胨变化步长为△X1=4,NaCl变化步长为△X2=0.8,牛肉膏变化步长为△X3=1,依据T值(表4)蛋白胨和牛肉膏为正效应,浓度依次增加;NaCl为负效应,浓度依次减少逼近最大响应区域,实验设计及结果见表5。菌株Nr-8206的细胞生物量在第5组(蛋白胨、NaCl、牛肉膏的质量浓度分别为24、0.8、8 g/L)水平附近最高,以该组配方值为CCD实验起始值进行后续优化。
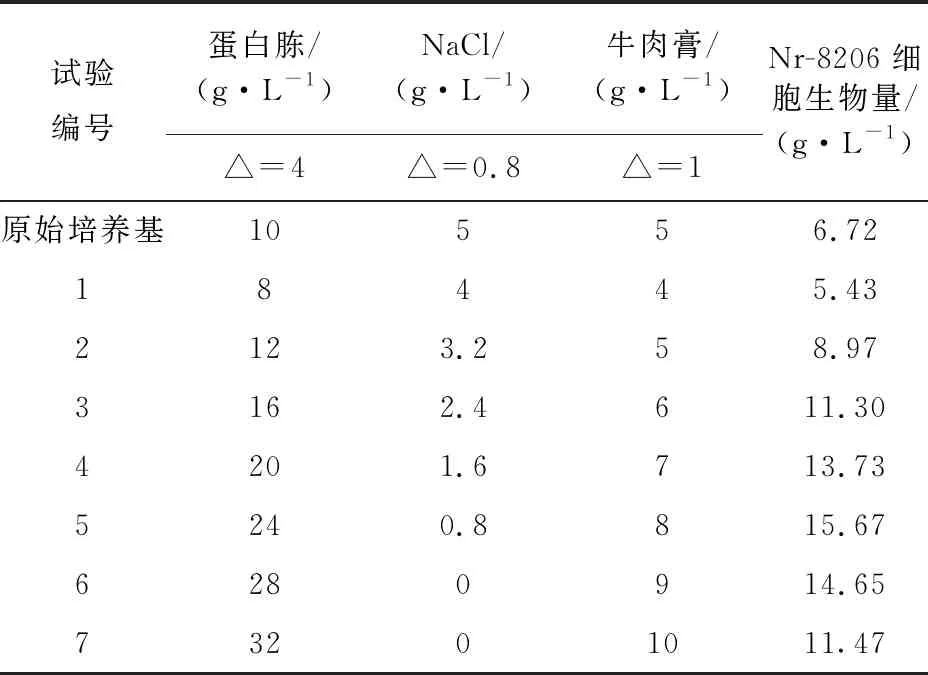
表5 最陡爬坡试验设计及试验结果
2.2.2 CCD实验 根据Design-Expert软件计算设计20组配方组成,实验组及结果见表6,其中第1、4、6、11、14、18组为重复,依据实验结果拟合建立响应量与自变量的多项式回归模型,应用Design-Expert软件对实验数据进行回归拟合,得到的回归方程:
菌株Nr-8206细胞生物量(g/L)=14.110+0.439C+0.416B-0.513E-0.525CB+0.269CE-0.150BE-0.322C2+0.081B2+0.421E2+0.006CBE-0.085C2B+0.575C2E+0.549CB2
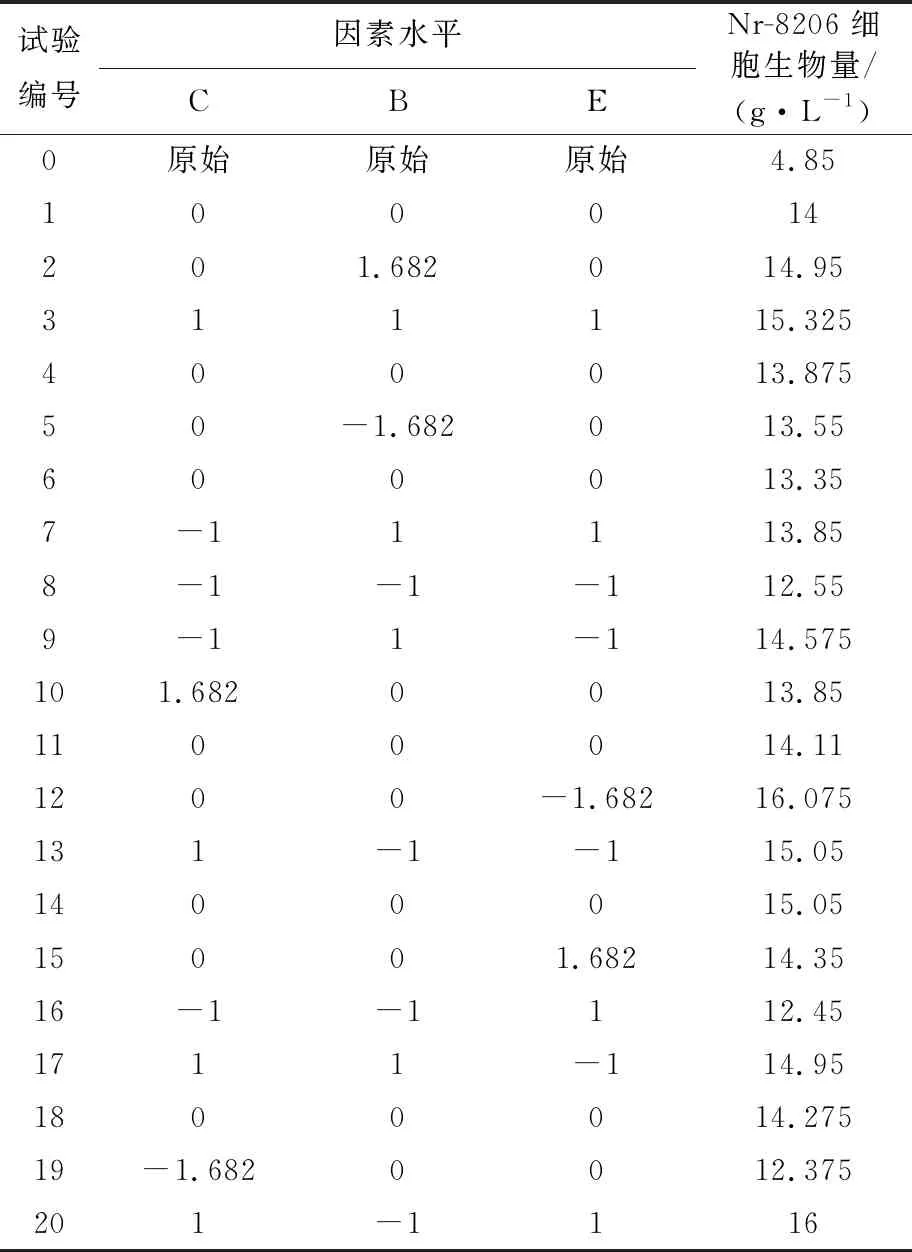
表6 CCD响应面试验及结果
方差分析中(表7),模型的P=0.022 0,说明该模型显著。失拟项的P=0.657 2,模型失拟不显著,所以模型正确,且多元相关系数R2=0.924 1,说明模型拟合较好。变异系数(C.V.)为3.66%,说明模型方程可信度、精确度较好。
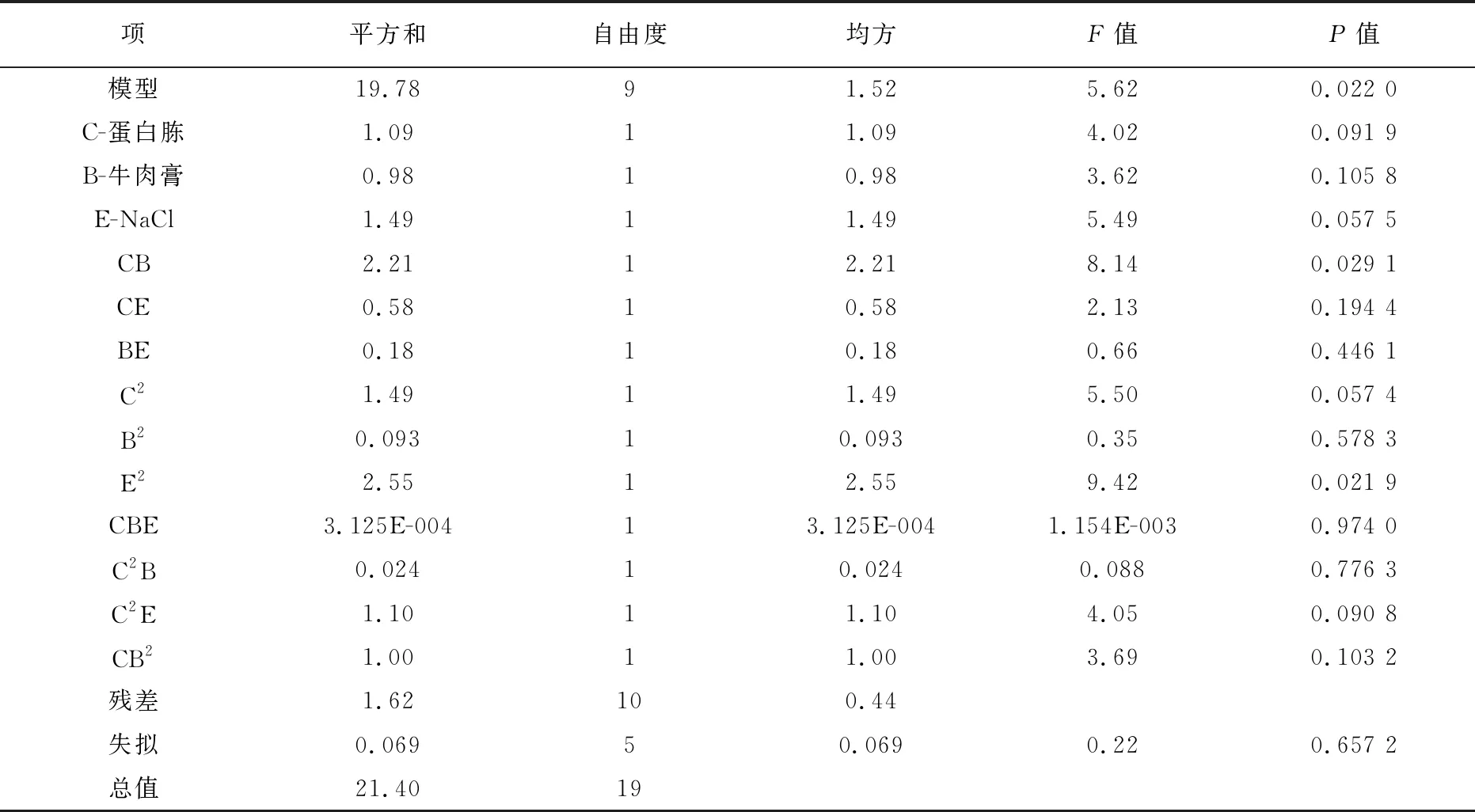
表7 CCD实验设计方差分析表
经Design-Expert软件分析,依据回归方程绘制相应的响应面分析图见图1~3,因素NaCl、牛肉膏、蛋白胨和牛肉膏立体分析图走势较陡,表明NaCl和牛肉膏交互作用、蛋白胨和牛肉膏交互作用对菌株Nr-8206细胞生物量影响显著。
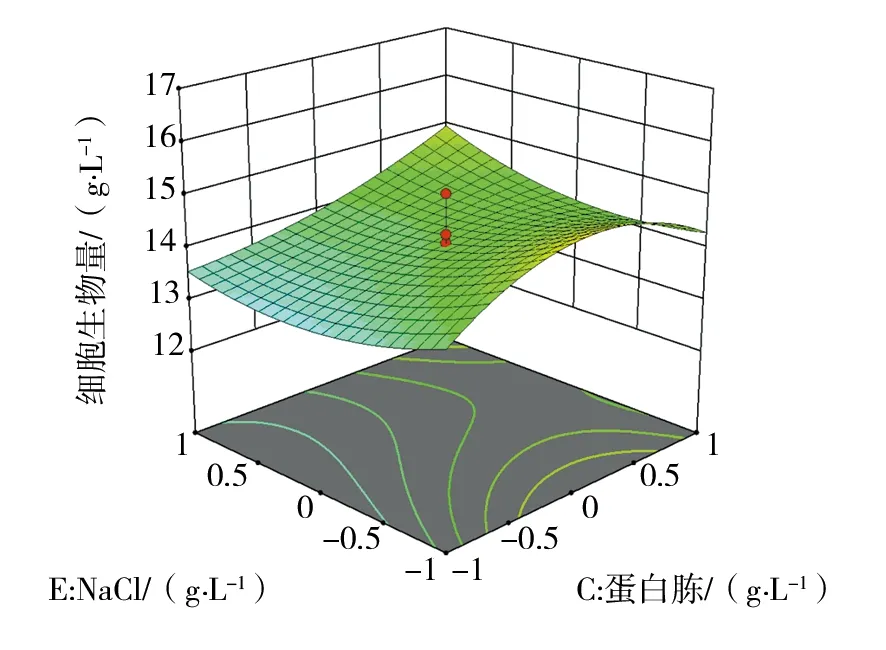
图1 蛋白胨和NaCl对细胞生物量影响的立体分析图Fig.1 Response surface plot of the effects of peptone and sodium chloride on cells biomass
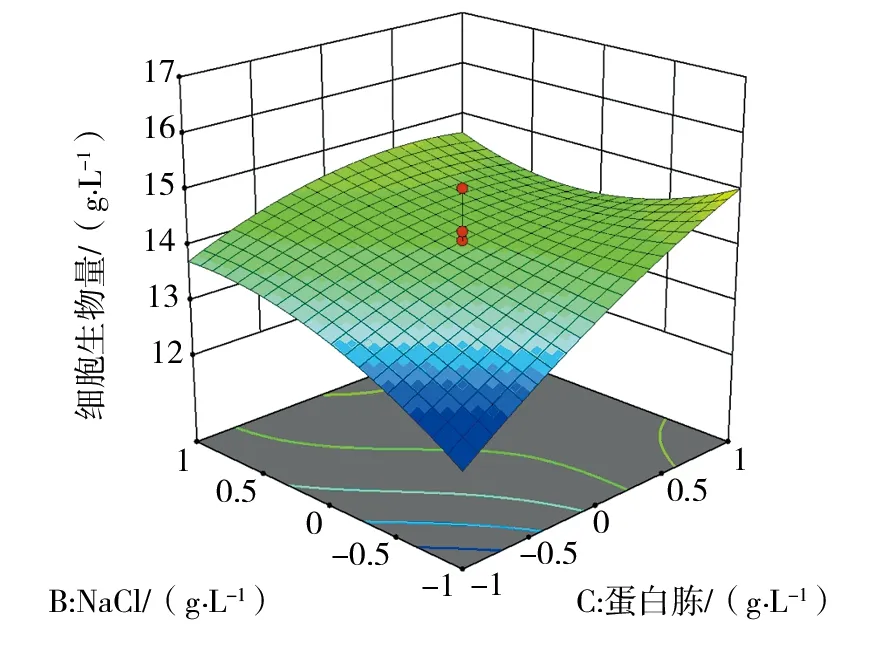
图2 蛋白胨和牛肉膏对细胞生物量影响的立体分析图Fig.2 Response surface plot of the effects of peptone and beef extract on cells biomass
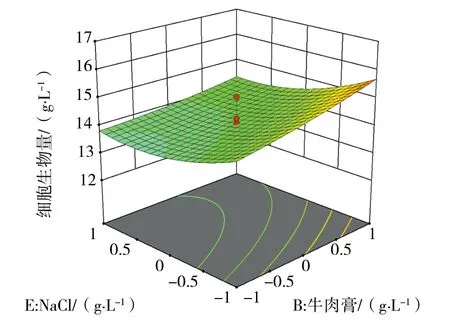
图3 牛肉膏和氯化钠对细胞生物量影响的立体分析图Fig.3 Response surface plot of the effects of beef extract and sodium chloride on cells biomass
理论极值编码水平(1,-1,1)的响应值为15.941 g/L,通过实验验证(见表6,CCD设计实验编号第20组),理论极值编码水平的实际细胞生物量为16.0 g/L,不是此次设计组中最高细胞生物量组(见表6,第12组细胞生物量为16.075 g/L),故结合预测配方和实验结果进行优化,编码水平中E(NaCl)的编码定为-1=0.8 g/L,即最陡爬坡试验的最佳组合(见表4,第5组)的NaCl取值,得出新配方(1,-1,0)带入拟合方程:
预测最高值点(Z1,Z2,Z3)=(1.000,-1.000, 1.000)
优化后配方:蛋白胨42 g/L,牛肉膏8 g/L,NaCL 1.2 g/L,Na2HPO4·12H2O 0.3 g/L,甘油 10 mL/L,pH 7.2~7.5。再次进行发酵,发现此次优化配方的细胞生物量比原始配方的生物量高231%。
2.2.3 最佳培养基配方的验证 为了确定实验结果的可靠性,按最佳优化配方进行企业验证。实验证明,原发酵培养基配方获得的细胞生物量平均为141.21 g/批次;优化后的配方获得的细胞生物量平均为287.8 g/批次提高了104%。
3 讨 论
对红色诺卡菌培养基配方进行了优化试验,在原培养基组分中,影响细胞生物量的主要因素为蛋白胨、NaCl,其次为牛肉膏,甘油和Na2HPO4·12H2O影响微弱。通过响应面优化设计法获得的最佳固体培养基配方为蛋白胨42 g/L、牛肉膏8 g/L、NaCl 1.2 g/L、甘油10 mL/L、Na2HPO4·12H2O 0.3 g/L、琼脂20 g/L;经过CCD实验,优化配方的细胞生物量为16.075 g/L,原始配方的细胞生物量为4.85 g/L,优化配方的细胞生物量比原始配方的细胞生物量高231%。在工厂验证中,采用优化配方培养菌株Nr-8206的平均细胞生物量达287.8 g/批次,比原配方的平均细胞生物量(141.21 g/批次)高104%。企业生产的外用红色诺卡氏菌细胞壁骨架为HPV感染的真正的对症治疗药品,其固体发酵周期长、工作量大。优化后的配方使红色诺卡菌固体发酵的细胞生物量提高了104%,解决了目前固体发酵产能低的短板,提高企业的经济效益和减少员工的工作强度作用明显。经过固体培养基配方的优化实验,证明响应面优化设计应用在提高红色诺卡菌固体发酵培养基优化方面是可行的,为红色诺卡菌培养条件的优化、液体发酵的优化研究提供依据。
