普通小麦溶剂保持力全基因组关联分析
2021-06-30刘巧方正武张晓胡文静李曼江伟高德荣
刘巧 方正武 张晓 胡文静 李曼 江伟 高德荣


摘要: 为了发掘更多与小麦溶剂保持力(Solvent retention capacity,SRC)显著相关的位点,以171个小麦品种(系)组成的自然群体为材料,于2017-2018和2018-2019年度分别在扬州、高邮种植,收获后测定5%乳酸SRC、5%碳酸钠SRC、50%蔗糖SRC和水SRC,结合群体90K SNP芯片基因型资料对小麦溶剂保持力进行全基因组关联分析(Genome-wide association study,GWAS)。在2年2点共4个环境下检测到12个稳定的显著性关联位点,分别位于1B、2A、4D染色体上,单个位点的表型解释率为6.93%~14.83%。在1B染色体上检测到同时控制水SRC、乳酸SRC和碳酸钠SRC的位点,可解释6.93%~14.83%表型变异率;在4D染色体上检测到同时控制水SRC、碳酸钠SRC的位点,可解释表型变异率7.04%~9.76%。发掘到的与小麦溶剂保持力显著相关的位点及其SNP可用于软质或弱筋小麦品质育种。
关键词: 普通小麦;溶剂保持力;关联分析;弱筋小麦品质育种
中图分类号: S512.1 文献标识码: A 文章编号: 1000-4440(2021)02-0273-07
Abstract: Natural population of wheats composed of 171 varieties (strains) planted in Yangzhou and Gaoyou in 2017-2018 and 2018-2019 respectively were used as the materials to explore more sites significantly related to solvent retention capacity (SRC) of wheats. After harvest, 5% lactic acid SRC, 5% sodium carbonate SRC, 50% sucrose SRC and water SRC were determined, and genome-wide association study (GWAS) was conducted to study the solvent retention capacity of wheat based on the genotype data of 90K SNP microarray. A total of 12 stable and significant associated loci were detected in four environments at two points of two years, which were located on chromosomes 1B, 2A and 4D, respectively. The phenotypic explanation ratio of single locus was 6.93%-14.83%. The locus associated with simultaneous control of water SRC, lactic acid SRC and sodium carbonate SRC was detected in 1B chromosome, which could explain 6.93%-14.83% of the phenotypic variations. The locus associated with simultaneous control of water SRC and sodium carbonate SRC was detected in 4D chromosome, which could explain 7.04%-9.76% of the phenotypic variations. The loci and SNPs significantly related to the solvent retention capacity of wheat found in this study can be applied in the breeding of wheat with soft or weak-gluten qualities.
Key words: common wheat;solvent retention capacity;association analysis;breeding of weak gluten wheat
近年来,中国弱筋小麦生产发展迅速,品质评价逐渐完善。溶剂保持力(Solvent retention capacity, SRC)由反映蛋白质、淀粉和面筋含量等不同特性的4种指标(水SRC、碳酸钠SRC、蔗糖SRC和乳酸SRC) [1-3]构成,SRC测定是目前评价软质或弱筋小麦品质的主导方法[4]。有研究结果表明,水SRC、碳酸钠SRC与籽粒硬度显著相关[5-6]。SRC(乳酸SRC除外)与蛋白质含量、小麦揉混特性和湿面筋含量显著相关[7-10] ,可以利用SRC值对面粉蛋白质质量进行评价。Guttier等[11]发现乳酸SRC与沉降值正相关,碳酸钠SRC与硬度负相关。罗勤贵等[12]和张岐军等[13]发现4种SRC都与曲奇饼干直径大小呈极显著负相关关系。由此可见, SRC值与小麦蛋白质含量、硬度、饼干品质等指标高度相关,是评价小麦品质的重要指标。
中国长江中下游麦区适宜种植弱筋小麦,该麦区已经成为中国弱筋小麦生产的优势产业带[14-16]。以往弱筋小麦评价指标以蛋白质含量、面筋含量和面团稳定时间为主,这些参数易受环境等多个因素影响,需结合多个测定指标科学综合反映弱筋小麦的品质[17-21]。溶剂保持力测定是近年发展起来的评价软质或弱筋小麦品質的方法[22-23],能较好地预测面粉烘焙品质和较全面地反映终端食品品质,可以代替用粉量大且操作复杂的加工品质试验[3,24]。李学军等[25]对不同世代的SRC进行了研究,认为在系谱法的第5代使用微量乳酸SRC测定较为稳定可靠。夏云祥等[26-27]通过分析比较小麦品种的SRC特性和4种SRC之间的相关性,发现中国推广的小麦品种的乳酸SRC和蔗糖SRC较低,品种间的水SRC、碳酸钠SRC和乳酸SRC差异皆不显著,并初步筛选了一批低SRC值的小麦种质材料。张勇等[28-29]通过对195 份小麦品种的SRC分析,发掘了一批低SRC 值(乳酸SRC除外)的弱筋种质。姚金保等[30]利用微量SRC法对55份高世代小麦品系和2个弱筋品种进行检测,发现不同品种(系)的SRC值差异极显著,其中有6个品系的4种SRC值均低于优质弱筋品种宁麦9号,可作为低SRC值的中间材料在优质弱筋小麦新品种选育中加以利用。虽然SRC在小麦品质评价中逐渐被重视,但因为实际操作中对小麦粉或面粉的检测需要一定的用种量,在育种中无法对低世代少量的籽粒进行检测。Souza等[31]发现SRC的遗传率较高,主要受基因型影响,因此挖掘与小麦SRC值显著相关的分子标记并且开发利用,可为弱筋小麦品质改良提供早世代选择的可能。
关联分析用自然群体为材料,利用基因型的连锁不平衡,发掘与目标性状显著关联的位点[32],被广泛应用到多种作物的农艺性状改良研究中[33-36]。Smith等[37]对187份小麦自然群体的SRC进行关联分析,在2B上分别定位了与3种SRC(除水SRC)显著相关的位点。马庆[10]利用8个SSR标记和486个AFLP标记分析RIL群体的SRC,在5D上定位了与水SRC显著相关的位点,在4D上定位了与碳酸钠SRC相关的位点,在5A和5D上定位了与蔗糖SRC显著相关的位点。张勇等[38]用36对SSR标记对171份小麦品种的SRC进行关联分析,共检测到8个显著性位点。 这些研究大多用SSR标记和AFLP标记等。与传统的分子标记相比,SNP标记多态性高,与目标性状连锁,有的位点可能与功能基因有关,可进一步开发功能标记[39]。本研究以171份小麦品种(系)组成的自然群体为材料,结合群体小麦90K SNP芯片基因型分析资料,对小麦SRC值进行全基因组关联分析,以发掘与小麦溶剂保持力显著关联的SNP位点,为弱筋小麦品质分子标记辅助育种提供理论依据。
1 材料与方法
1.1 试验材料
试验材料包括国内外171份小麦品种(系),其中3个分别来自意大利、墨西哥和日本,其余168个分别来自中国陕西、河北、北京、山西、山东、河南、安徽、江苏、湖北、湖南、四川和广州17个省市[40],由江苏里下河地区农业科学研究所搜集。2017-2018和2018-2019年度,供试材料种植于江苏里下河地区农业科学研究所万福基地和江苏省高邮市小麦研究基地(试验分别简称为2018YZ、2018GY、2019YZ、2019GY)。采用随机区组设计,2次重复,3行区,每行70粒。行长1.35 m,行距0.23 m。按常规方式进行田间管理。
1.2 溶剂保持力测定
参照AACC56-11方法[1-3], 测定溶剂保持力(SRC),粉样为全麦粉,用量为5 g。
1.3 表型数据处理
取每个品种(系)各个性状2次重复的均值作为表型数据,采用SPSS22.0和Microsoft Excel2019对表型数据进行处理和统计分析。
1.4 基因型鉴定
应用小麦90K SNP芯片对171份小麦品种(系)进行基因分型[32],剔除数据缺失率>10%和最小等位基因频率(MAF)<0.05的SNP标记,保留高质量的SNP标记进行关联分析。
1.5 群体结构分析
参考Hu等[40]分析结果,应用平均分布于21条染色体上的1 676个标记(r2<0.2)进行群体结构分析(Structure 2.3.4)。
1.6 全基因组关联分析
利用Tassel v5.0 軟件对自然群体进行分析,用混合线性模型(Mixed linear model,MLM)的方法,进行性状与标记之间的关联分析。当单个标记的-lg(P)≥3,即P≤0.001时认为标记与性状存在显著关联。将连锁标记或者基因的序列与中国春参考基因组序列进行比对(http://plants.ensembl.org/),获得标记或者基因的参考物理位置。
2 结果与分析
2.1 小麦群体溶剂保持力的统计分析
2018YZ、2018GY、2019YZ、2019GY试验中171份供试材料的水SRC均值分别为100.04%、96.07%、91.66%、92.93%,变异系数为5.27%~7.46%;蔗糖SRC均值分别为121.77%、126.55%、123.84%、124.44%,变异系数为6.39%~7.31%;乳酸SRC均值分别为114.27%、115.84%、107.02%、106.45%,变异系数为6.47%~7.17%;碳酸钠SRC均值分别为121.09%、118.94%、115.71%、117.15%,变异系数为6.14%~8.17%(表1)。
对供试材料的溶剂保持力进行相关分析,发现小麦4种SRC值之间呈一定的相关性。分析结果表明,水SRC与蔗糖SRC、乳酸SRC和碳酸钠SRC呈极显著正相关关系,蔗糖SRC与乳酸SRC呈极显著正相关关系,蔗糖SRC与碳酸钠SRC呈显著正相关关系,乳酸SRC与碳酸钠SRC呈极显著正相关关系。其中水SRC与乳酸SRC和碳酸钠SRC相关系数较高,分别为0.808和0.823;乳酸SRC与碳酸钠SRC相关系数也较高,为0.809(表2)。
2.2 小麦溶剂保持力全基因组关联分析
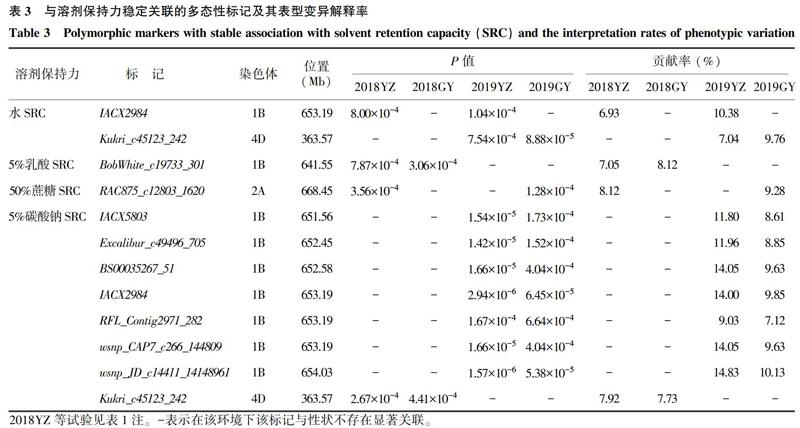
对4个环境下4个SRC性状进行全基因组关联分析,在P<0.001水平,在2个或2个以上的环境中检测到12个标记/性状关联(Marker-trait association, MTA)的稳定单核苷酸多态性(SNP),分别位于1B、2A和4D染色体上,单个位点的表型变异解释率为6.93%~14.83%。其中2个位点与水SRC显著关联,分别为1B染色体的IACX2984(653.19 Mb)和4D 上的Kukri_c45123_242 (363.57 Mb),最高可解释10.38%的表型变异率。1个位点与乳酸SRC显著关联,位于1B染色体的BobWhite_c19733_301(641.55 Mb)上,最高可解释8.12%的表型变异率。1个位点与蔗糖SRC显著关联,位于2A染色体的RAC875_c12803_1620(668.45 Mb)上,最高可解释9.28%的表型变异率。2个位点与碳酸钠SRC显著关联,分别位于1B和4D染色体上,其中1B染色体上651.56~654.03 Mb处包含7个显著性标记(IACX5803、Excalibur_c49496_705、 BS00035267_51、IACX2984、RFL_Contig2971_282、wsnp_CAP7_c266_144809、wsnp_JD_c14411_14148961),最高可解释14.83%的表型变异率;位于4D染色体上的显著性标记Kukri_c45123_242(363.57 Mb),最高可解释7.92%的表型变异率(表3)。
本研究在控制小麦溶剂保持力的关联位点中发现了11个SNP标记同时与2个或多个性状相关联。其中位于1B染色体上的标记IACX5803(651.56 Mb)和Excalibur_c49496_705(652.45 Mb)与5%乳酸SRC和5%碳酸钠SRC 2个性状显著相关,表型变异解释率为 7.51%~11.96%。 位于1B染色体上的标记IACX2984(653.19 Mb)与水SRC、5%乳酸SRC和5%碳酸钠SRC 3个性状显著相关,表型变异解释率为6.93 %~14.00%。位于1B染色体上的标记wsnp_JD_c14411_14148961(654.03 Mb)与水SRC、5%乳酸SRC和5%碳酸钠SRC 3个性状显著相关,表型变异解释率为7.09%~14.83%。位于3B染色体上的标记Excalibur_c51706_263(109.95 Mb)和位于4B染色体上的标记BS00110765_51(652.29 Mb)、wsnp_CAP12_c4769_2174195 (652.29 Mb)、RAC875_c51375_238(652.37 Mb)都是与水SRC和5%碳酸钠SRC 2个性状显著相关,表型变异解释率为 7.01%~10.91%。位于4D染色体上的标记Kukri_c45123_242(363.57 Mb)与水SRC和5%碳酸钠SRC 2个性状显著相关,表型变异解释率为7.04%~9.76%。位于5A染色体上的标记BS00067096_51(34.53 Mb)与水SRC、5%乳酸SRC和5%碳酸钠SRC 3个性状显著相关,表型变异解释率为8.65%~10.35%。位于7B染色體上的标记RAC875_c906_657(746.53)与5%乳酸SRC和5%碳酸钠SRC 2个性状显著相关,表型变异解释率为7.18%~9.47%。
3 讨论
以往研究结果表明小麦4种SRC值之间具有显著相关性[41-42],与本研究结果一致。本研究在1B染色体上同时检测到控制3种SRC(除蔗糖SRC)的位点,物理位置接近;在4D上检测到控制水SRC、碳酸钠SRC的位点位于同一位置,说明这些SNP位点可同时影响多个SRC性状。SNP标记分布广、稳定性高、经济、便利、高通量,在小麦遗传育种中能构建高密度的遗传图谱,可用于分子标记辅助选择育种、全基因组关联分析、大规模筛选定位优异基因和标记开发等 [43-45]。
有研究结果表明,1B染色体上存在多个控制小麦品质性状的位点。Huang等[46]利用DH群体,检测到控制沉降值的位点位于1B染色体上。安玉玲[47]用自然群体在1B染色体上检测到控制峰值高度、8 min带高(宽)、曲线尾高(宽)、右斜率和积分面积的位点。王俊[48]用DH群体在1B染色体上检测到控制沉淀值、8 min带宽和峰高带宽的位点。吴云鹏[49]用PH82-2/内乡188杂交后代40个F5∶6株系,在1B染色体上检测到控制Zeleny沉降值、8 min带宽、稀澥值、和面时间和峰值黏度的位点。李君[50]利用2个RIL群体在1B染色体上定位到与面团稳定时间关联的位点。本研究在1B染色体的相近位置(641.55~654.03 Mb)同时定位到与3种SRC(除蔗糖SRC外)显著相关位点,推测属于同一位点,与常柳[51]在1B染色体上定位到的乳酸SRC相关QTL位点位置接近,下一步可开发相应KASP标记,对这一位点进行深入研究,应用于小麦弱筋品质遗传育种。本研究分别在2A和4D染色体上定位到的与蔗糖SRC和碳酸钠SRC显著相关的位点,以前均未见报道,推测是检测到的控制相关SRC性状的新位点。因小麦种植期间的气候原因和人为因素,不同年度和地点以及试验期间的田间种植管理、病虫害、灌浆期温度等均会存在差异,对供试小麦品种溶剂保持力会有显著影响,从而造成定位结果的不稳定性。本研究在3B、4B、5A和7B染色体上均定位到单环境下的与SRC显著关联的SNP,下一步将增加环境重复,验证这些位点的准确性和可靠性。
4 结论
本研究利用90K SNP基因芯片对171份小麦品种(系)材料在2017-2018和2018-2019年度扬州和高邮4个环境下的溶剂保持力进行全基因组关联分析,检测到12个稳定的显著性关联标记,分别位于1B、2A和4D染色体上,单个位点可解释6.93%~14.83%的变异率。与水SRC关联的位点有2个,位于1B和4D染色体上;与乳酸SRC关联的位点有1个,位于1B染色体上;与蔗糖SRC关联的位点有1个,位于 2A染色体上;与碳酸钠SRC关联的位点有2个,位于1B和4D染色体上。在1B染色体上同时检测到控制3种SRC(除蔗糖SRC)的位点,物理位置接近,可解释表型变异率6.93%~14.83%;在4D染色体上检测到控制水SRC、碳酸钠SRC的位点位于同一位置,可解释表型变异率7.04%~9.76%。这些SNP位点可为小麦软质或者弱筋品质育种提供理论依据和材料来源。
参考文献:
[1] 张 晓,李 曼,江 伟,等. 小麦三个品质性状微量检测方法的应用与评价[J]. 麦类作物学报, 2014, 34(12): 1651-1655.
[2] 周淼平,吴宏亚,余桂红,等. 小麦溶剂保持力微量测定方法的建立[J]. 江苏农业学报, 2007, 23(4): 270-275.
[3] KWEON M, SLADE L, LEVINE H, et al. Solvent retention capacity (SRC) testing of wheat flour: principles and value in predicting flour functionality in different wheat-based food processes and in wheat breeding: a review[J]. Cereal Chem, 2011, 88: 537-552.
[4] HAYNES L C, BETTGE A D, SLADE L, et al. Soft wheat and flour products methods review: Solvent retention capacity equation correction[J]. Cereal Foods World, 2009, 54(4): 174-175.
[5] 钱森和,张 艳,王德森,等. 小麦品种戊聚糖和溶剂保持力遗传变异及其与品质性状关系的研究[J]. 作物学报, 2005, 31(7): 902-907.
[6] 陈 锋,钱森和,张 艳,等. 中国冬小麦puroindoline类型分布及其对溶剂保持力的影响[J]. 中国农业科学, 2005, 38 (1): 217-218.
[7] 倪芳妍,张国权,李 劲,等. 优质强筋小麦粉乳酸溶剂保持能力的影响因素分析[J]. 粮食与饲料工业, 2006(3): 10-13.
[8] 王晓曦,曹维让,李丰蓉. SRC法测定面粉品质与其他方法比较研究初探[J]. 粮食与饲料工业, 2003(9): 4-5.
[9] 周淼平,吴宏亚,余桂红,等. 软质小麦品种的辅助选择[J]. 麦类作物学报, 2007, 27(3): 445-450.
[10]马 庆. 小麦溶剂保持力的QTL定位及其与加工品质的关系[D]. 扬州:扬州大学, 2009.
[11]GUTTIER M J, MCLEAN R, LANNING S P, et al. Assessing environmental influences on solvent retention capacities of two soft white spring wheat cultivars[J]. Cereal Chem, 2002, 79: 880-884.
[12]罗勤贵,张 娜,张国权. 弱筋小麦SRC与饼干品质关系的研究[J]. 粮食加工, 2007, 32(6): 20-24.
[13]张岐军,何中虎,闫 俊,等. 溶剂保持力在软质小麦品质评价中的应用[J]. 麦类作物学报, 2004, 24(4): 140-142.
[14]何中虎,林作揖,王龙俊,等. 中国小麦品质区划的研究[J]. 中国农业科学, 2002, 35(4): 359-364.
[15]姚金保,马鸿翔,张平平,等. 中国弱筋小麦品质研究进展[J]. 江苏农业学报, 2009, 25(4): 919-924.
[16]张平平,姚金保,王化敦,等. 江苏省优质软麦品种品质特性与饼干加工品质的关系[J]. 作物学报, 2020, 46(4): 491-502.
[17]金 艳,郭慧娟,崔党群. 环境因素对小麦蛋白质含量和品质的影响研究进展[J]. 中国农学通报, 2009,25(17):250-254.
[18]李会珍.生态环境与栽培因素对小麦品种蛋白质含量的影响[D].晋中:山西农业大学,2001.
[19]王 博.气候因子对小麦品质的影响及贵州小麦品质区划[D].贵阳:贵州大学,2011.
[20]张伯桥,郑 义,张平平,等. 长江流域小麦品种(系 )的品质状况分析[J]. 江苏农业学报, 2009, 25(3):478-483.
[21]张伯桥,张 晓,高德荣,等. 吹泡仪参数作为弱筋小麦品质育种选择指标的评价[J]. 麦类作物学报, 2010,30(1):29-33.
[22]王晓阳,肖小洪,王凤成.优质弱筋小麦专用粉品质指标要求[J]. 现代面粉工业, 2010, 24(3): 46-47.
[23]杭雅文,武 威,张莀茜,等. 弱筋小麦品质指标的相关性分析及筛选[J]. 麦类作物学报,2020,40(3):320-327.
[24]张岐军,张 艳,何中虎,等. 软质小麦品质性状与酥性饼干品质参数的关系研究[J].作物学报,2005,31(3):1125-1131.
[25]李学军,王 培,张 艳, 等.微量面粉乳酸溶剂保持力在小麦育种后代选择中的应用[J].麦类作物学报,2011,31(4): 660-665.
[26]夏云祥,马传喜,司红起. 中国小麦微核心种质溶剂保持力特性分析[J]. 安徽农业大学学报, 2008,35(3): 336-339.
[27]夏云祥,马传喜,司红起. 普通小麦溶剂保持力品种间差异及低溶剂保持力种质资源筛选[J]. 江苏农业学报, 2008, 24(6): 780-784.
[28]张 勇,金 艳,张伯桥,等. 我国不同麦区小麦品种的面粉溶剂保持力[J]. 作物学报, 2012, 38(11): 2131-2137.
[29]张 勇,金 艳,张伯桥,等.不同来源品种在长江下游麦区的溶剂保持力特性及相关分析[J].麦类作物学报,2012, 32 (4): 750-756.
[30]姚金保,SOUZA E,馬鸿翔,等.小麦品种(系)间溶剂保持力差异及软质小麦资源筛选[J].麦类作物学报,2010, 30(1): 46-49.
[31]SOUZA E, GUTTIERI M J. Sources of variation in the solvent retention capacity test of wheat flour[J]. Crop Sci, 2003, 43: 1628-1633.
[32]张国华,高明刚,张桂芝,等.黄淮麦区小麦品种(系)产量性状与分子标记的关联分析[J]. 作物学报, 2013, 39(7): 1187-1199.
[33]WEI T M, CHANG X P, MIN D H, et al. Analysis of genetic diversity and tapping elite alleles for plant height in drought-tolerant wheat varieties[J]. Acta Agronomica Sinica, 2010, 36(6): 895-904.
[34]BRYANT R, PROCTOR A, HAWKRIDGE M ,et al. Genetic variation and association mapping of silica concentration in rice hulls using a germplasm collection[J]. Genetica, 2011, 139: 1383-1398 .
[35]赖 勇,王鹏喜,范贵强,等.大麦SSR标记遗传多样性及其与农艺性状关联分析[J]. 中国农业科学, 2012, 46(2): 233-242.
[36]张焕欣,翁建峰,张晓聪,等.玉米穗行数全基因组关联分析[J]. 作物学报, 2014, 40(1): 1-6.
[37]SMITH N, SOUZA E, SNELLER C, et al. Association analysis of soft wheat quality traits in eastern US soft winter wheat[R]. Houston, TX: Joint Annual Meeting of ASA-CSSA-SSSA, 2008.
[38]张 勇,张 晓,郭 杰,等.软质小麦溶剂保持力关联分析[J]. 作物学报, 2015, 41(2): 251-258.
[39]ANDERSEN J R,LUBBERSTEDT T. Functional markers in plants[J]. Trends Plant Sci,2003(8):554-560.
[40]HU W J, GAO D R, WU H Y, et al. Genome-wide association mapping revealed syntenic loci QFhb-4AL and QFhb-5DL for Fusarium head blight resistance in common wheat (Triticum aestivum L.) [J]. BMC Plant Biology, 2020, 20: 29.
[41]GUTTIER M J, SOUZA E. Sources of variation in the solvent retention capacity test of wheat flour[J]. Crop Science, 2003, 43: 1628-1633.
[42]RAM S, DAWAR V, SINGH R P, et al. Application of solvent retention capacity tests for the prediction of mixing properties of wheat flour[J]. Journal of Cereal Science, 2005, 42: 261-266.
[43]李 磊,贡 豪,顾世梁,等.小麦中基于转录组测序SNP的dCAPS标记的高通量开发及验证[J]. 扬州大学学报(农业与生命科学版), 2018,39(4):86-90.
[44]吴 澎,刘 娟,田纪春. 单核苷酸多态性(SNP)分子标记在小麦遗传育种中的研究进展[J]. 农学学报, 2019,9(1):54-58.
[45]许陶瑜,唐朝晖,王长彪,等. SNP 标记在小麦遗传育种中的应用研究进展[J]. 山西农业科学, 2017,45(9):1549-1552.
[46]HUANG X, CLOUTIER S, LYCARL, et al. Molecular detection of QTLs for agronomic and quality traits in a doubled haploid population derived from two Canadian wheats (Triticum aestivum L.) [J]. Theoretical and Applied Genetics, 2006, 113(4): 753-766.
[47]安玉玲. 小麦揉混特性和溶剂保持力的全基因组关联分析[D]. 泰安:山东农业大学,2017.
[48]王 俊. 小麦光温敏型DH群体品质性状的QTL分析[D]. 呼和浩特:內蒙古农业大学,2009.
[49]吴云鹏. 小麦重要品质性状QTL定位[D]. 北京:中国农业科学院, 2007.
[50]李 君. 小麦遗传图谱的构建及主要品质性状的QTL定位[D]. 泰安:山东农业大学, 2011.
[51]常 柳. 小麦品质性状的相关分析及QTL定位[D].太原:山西大学,2012.
(责任编辑:张震林)
