荧光假单胞菌(Pseudomonas fluorescens)MF11对根结线虫病的防效评价
2021-06-30周冬梅何亮亮李伟山冯辉赵敏纠敏魏利辉
周冬梅 何亮亮 李伟山 冯辉 赵敏 纠敏 魏利辉
摘要: 在根结线虫危害严重的番茄田块采集健康植株的根际,从中分离并筛选对根结线虫病具有防治作用的生防菌株。采用稀释分离法以及离体试验获得16株能显著杀灭南方根结线虫二龄线虫(J2)的菌株,其中菌株MF11对J2的致死率最高。基于生理生化分析、gyrB 和16S rRNA基因碱基序列比对,确定菌株MF11为荧光假单胞菌(Pseudomonas fluorescens)。菌株MF11发酵液浸泡番茄幼苗24 h后,J2在番茄根尖的聚集数量显著减少,侵入番茄根尖的虫量下降80.65%,表明菌株MF11可降低J2对番茄的侵染力。温室试验结果表明, 菌株MF11发酵液处理可以显著降低番茄植株86.53%根结数,以及70.2%的卵块数。田间试验结果表明,菌株MF11发酵液处理降低了根结线虫病的病情指数,其平均防效达66.71%,与10%噻唑膦颗粒剂处理防效相当。综上所述,菌株MF11不仅对根结线虫具有毒杀作用,还能降低根结线虫的侵染、发育和繁殖能力,从而有效防治作物根结线虫病。
关键词: 南方根结线虫;生防菌;荧光假单胞菌;防治效果
中图分类号: S432.4+5 文献标识码: A 文章编号: 1000-4440(2021)02-0326-07
Abstract: Rhizosphere of healthy tomato plants in fields severely infected by root-knot nematode was collected to isolate and screen biocontrol strains with antagonistic effects on diseases caused by Meloidogyne incognita. 16 bacterial strains with significant nematocidal activity on the second-stage larvae (J2) of M. incognita were obtained by separation method of dilution and in vitro experiment. Among them, MF11 strain showed the highest lethality rate to J2. The MF11 strain was identified to be Pseudomonas fluorescens based on physiological, biochemical analysis and gene sequence alignment between gyrB and 16S rRNA. The number of J2 aggregated around the root tips of tomatoes decreased significantly 24 h after the tomato seedlings immersed in the fermentation broth of MF11 strain. The number of root-knot nematode invading the root tips of tomato reduced by 80.65%, indicating that MF11 strain could reduce the infecting effect of J2 to tomato. Experimental results in the greenhouse showed that, tomato plants treated with MF11 strain fermentation broth could decrease the number of root-knots by 86.53% and reduce the egg mass in MF11-treated tomato roots by 70.52% significantly. The results of field experiment showed that, the disease indexes of diseases caused by root-knot nematode in tomato plants treated with MF11 reduced compared with that of water control, with an average control efficacy of 66.71%, which was the same as the treatment by fosthiazate 10% granules. In summary, MF11 strain not only has toxic action on root-knot nematode, but can also decrease the infection, growth and fertility abilities of root-knot nematode to control the diseases caused by root-knot nematode in crops effectively.
Key words: Meloidogyne incognita;biocontrol bacteria;Pseudomonas fluorescens;control efficacy
根结线虫(Meloidogyne spp.)是世界性分布的威胁农业生产的主要土传病原物之一[1]。根结线虫侵染后可导致植物组织发生变化,致使寄主更易受到青枯、枯萎、根腐等病原菌的侵染,造成复合病害,加重这些土传性病害的发生严重度[2]。由于寄主广泛,不同生态环境下根结线虫的发生流行规律存在差异,从而导致作物根结线虫病的防控十分困难[3-4]。在中国对农作物以及蔬菜危害严重且造成重大经济损失的主要有南方根结线虫(M. incognita)、花生根結线虫(M. arenaria)、爪哇根结线虫(M. javanica)、北方根结线虫(M. hapla)以及象耳豆根结线虫(M. enterolobii) [5]。其中由南方根结线虫(M. incognita)引起的根结线虫病害在国内普遍发生,主要危害番茄、辣椒和黄瓜等蔬菜作物[6-8]。
对于根结线虫的防治,生产上以化学药剂为主[9]。由于化学杀线剂对环境污染严重,同时在使用过程中对人畜也不安全,而且导致土壤质地退化、生物多样性丧失等,因此,人们越来越多地从植物自身即抗性品种选育和生物防治的角度寻求新的防治方法[10-12]。
利用环境有益微生物来控制病害的发生以及诱导作物提高抗逆能力是近些年来研究的热点,尤其这些微生物对环境无污染,能克服化学药剂防治带来的缺陷。Kloepper & Schroth 提出植物根际促生细菌(PGPR)假说,这类细菌可以增强植物对养分的吸收,促进植物生长发育,诱导植株产生系统性抗性以抵抗不良环境条件或病原物的侵染[13]。PGPR(如Pseudomonas spp.和Bacillus spp.)已被证实含有裂解根结线虫细胞壁的酶类和具有引起植物抗性的能力,从而有效防治根结线虫病害[14-16]。例如,荧光假单胞菌UTPF5的粗提物对爪哇根结线虫二龄幼虫的致死率可达到100%,且不同浓度的UTPF5抽提物都能对二龄幼虫活性产生影响[17]。将水杨酸与荧光假单胞菌CHAO混合使用,可有效激起番茄体内PR1基因的表达,进而有效抵御爪哇根结线虫的侵染[18]。Wei等从苦瓜根际中筛选到1株枯草芽孢杆菌(Bacillus subtilis) ,该菌株的上清液能杀死二龄幼虫和抑制卵的孵化,温室盆栽和田间试验结果显示该菌株能有效防治根结线虫病害[19]。Choi等对2株芽胞杆菌B. thuringiensis KYC 和 B. velezensis CE的抗根结线虫能力进行了测定,发现这2株芽胞杆菌能有效抑制卵的孵化能力以及对二龄幼虫具有较强的致死作用;温室试验结果表明,这2株细菌能够显著降低根结数以及卵块数,显示出较高的抗线虫能力[20]。
本研究以分离自南京市六合区番茄大棚未受根结线虫侵染的健康植株根际中的一株具有拮抗作用的荧光假单胞菌MF11为研究靶标,通过对二龄幼虫致死能力检测以及对根结线虫吸引能力测定初步分析MF11对根结线虫病的生防机制,结合盆栽和田间试验评估MF11作为一种生防资源用于根结线虫病防治的应用前景。
1 材料与方法
1.1 生防菌的分离和鉴定
供试细菌分离自江苏省南京市六合区竹镇番茄大棚中未受根结线虫侵染的番茄根际。利用平板稀释法在R2A培养基上进行分离获得供试菌株MF11,并根据《常见细菌系统鉴定手册》对筛选细菌菌株进行生理生化性状分析[21]。利用细菌基因组试剂盒(康为公司)提取MF11菌株基因组 DNA,用16Sr RNA通用引物 27F/1492R 和gyrB引物UP-1S从基因组DNA 中分别扩增16S rRNA和gyrB基因序列[22]。PCR产物测序结果在NCBI数据库进行 BLAST 比对分析。采用MEGA 7 基于16S rRNA和gyrB基因碱基序列以Neibour-Joining 法构建系统发育树,确定分类地位。
1.2 菌株MF11发酵液的制备
用接种环挑取细菌单菌落于LB培养液中,28 ℃ 180 r/min振荡培养2 d,10 000 r/min离心15 min,收集上清液并通过0.22 μm滤器过滤菌体,获得MF11发酵液。发酵液用无菌水梯度稀释后备用。
1.3 根结线虫二龄幼虫的准备
供试根结线虫种群最早分离自发病番茄根组织,并在室内进行单卵块培养繁殖,经形态学和分子鉴定,确定为南方根结线虫1号生理小种。番茄根组织剪碎后,加入10%次氯酸钠剧烈振荡并通过500 目筛收集虫卵,并利用蔗糖密度法纯化虫卵;将收集的虫卵转移至线虫孵化器,25 ℃避光孵育,1~2 d后收集根结线虫二龄幼虫(J2)。
1.4 发酵液对二龄幼虫活性以及侵染能力的影响
在24孔细胞培养板中依次加入1 ml的发酵上清液和100头J2,并将细胞培养板置于25 ℃恒温培养箱中,分别在4 h、8 h、12 h、24 h后观察线虫活性,统计线虫死亡头数,以LB培养液和灭菌水处理作为对照,每个处理3次重复。
番茄种子(Moneymaker)用20% 次氯酸钠灭菌15 min,灭菌水清洗4~5 次,于灭菌平板保湿黑暗培养4~5 d,待番茄根长约 1.5 cm 时使用。将细菌发酵液加入无菌培养皿中,然后将番茄幼苗根部浸入发酵液中,于摇床上80 r/min、28 ℃培养30 min。然后将番茄苗置于0.8%的水琼脂培养基上,并在番茄根尖下方约2 mm处接种200头J2悬浮液,25 ℃培养箱中放置12 h。番茄苗经染色、脱色处理后,统计进入番茄根尖的线虫数量。每个处理20株苗,重复3次。
1.5 发酵液处理后番茄对线虫的吸引能力测定
番茄生长条件同方法1.4,将番茄幼苗根部分别浸入不同浓度的生防菌发酵液和LB培养液中,于摇床上80 r/min、28 ℃培养30 min。将番茄苗取出后置于含有1 500头 J2的Pluronic F-127凝胶的细胞培养皿中,每孔放2株苗,室温放置[23]。在体视显微镜下分别于1 h、4 h、12 h、18 h、24 h、48 h观察番茄根对南方根结线虫的吸引情况,并统计侵入番茄根尖的线虫数量。
1.6 温室盆栽试验
将表面消毒的番茄种子播种于灭菌土壤中,置于25 ℃、16 h光照/8 h黑暗条件下生长。14 d后移栽至含有灭菌基质中(沙∶营养基质=9∶1,質量比),移栽3 d后每株番茄苗灌根10 ml发酵液。生防菌发酵液处理7 d后,每株番茄苗接种500头J2悬浮液,在J2接种后21 d统计根结数,56 d后统计卵块数。每个处理24株苗,重复3次。
1.7 生防菌对根结线虫病的田间防效测定
于2019年4月在江苏省农业科学院六合示范基地根结线虫常发大棚进行防效测定。田间试验共设置3个处理:10%噻唑膦GR(拜耳)处理(30 kg/hm2)、清水对照、生防菌处理(每株100 ml生防菌发酵液)。每小区12 m2,每小区栽种60棵番茄苗。每处理3次重复,相邻小区之间设保护行,随机排列。40 d后,对所有小区番茄植株进行分级调查病情[24]:0级,根系无虫瘿,无发病;1级,根系有少量虫瘿;3级,2/3根系布满虫瘿;5级,根系布满小虫瘿并有次生虫瘿;7级,根系形成须根团。根据公式计算病情指数和相对防效[25]:病情指数=∑(各级病植株数×各级代表值)/(调查总植株数×最高级代表值)×100,防治效果=(對照病情指数-处理病情指数)/ 对照病情指数×100%。
2 结果与分析
2.1 菌株MF11对根结线虫的致死作用
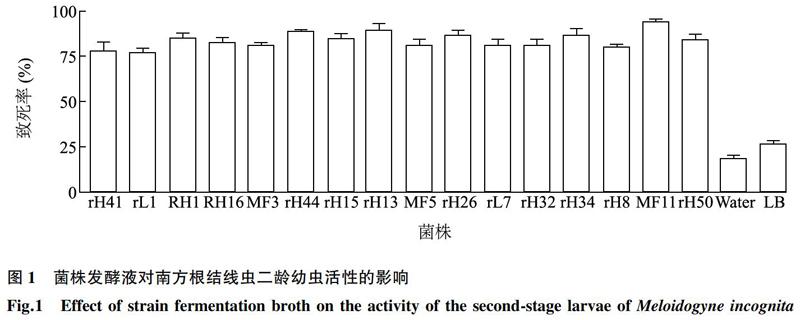
根据菌株发酵液在4 h、8 h、12 h、24 h时对南方根结线虫二龄幼虫的致死率,以12 h线虫死亡率达到80%及以上为指标共筛选出16株具有拮抗线虫效果较好的菌株,其中菌株rH15、rH13、rH26、MF11对线虫致死率较高,达90%以上,MF11的致死率最高为94%(图1)。后续试验以MF11为研究对象,研究其生防机制以及防病效果。
2.2 菌株MF11的鉴定结果
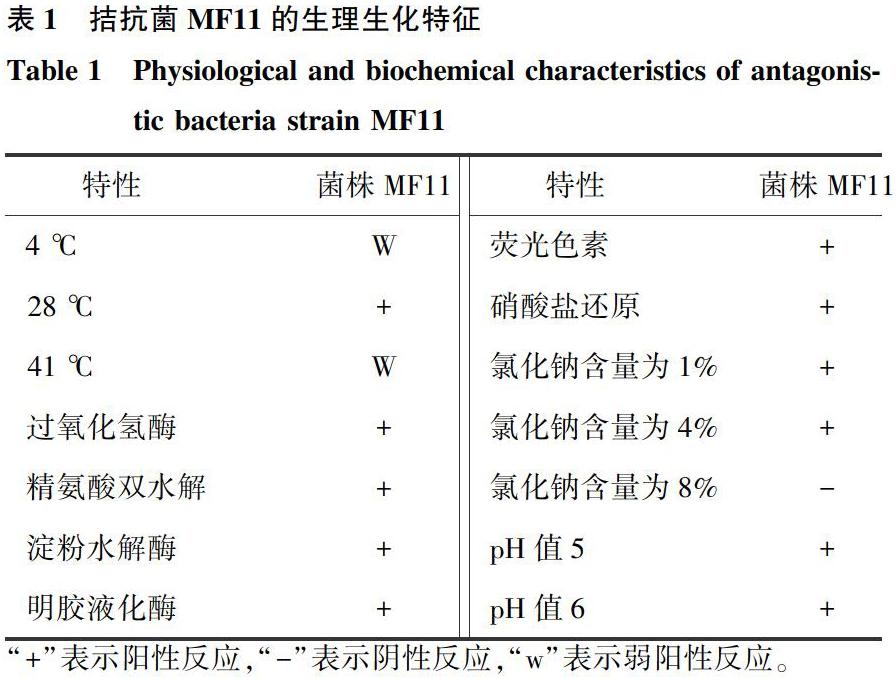
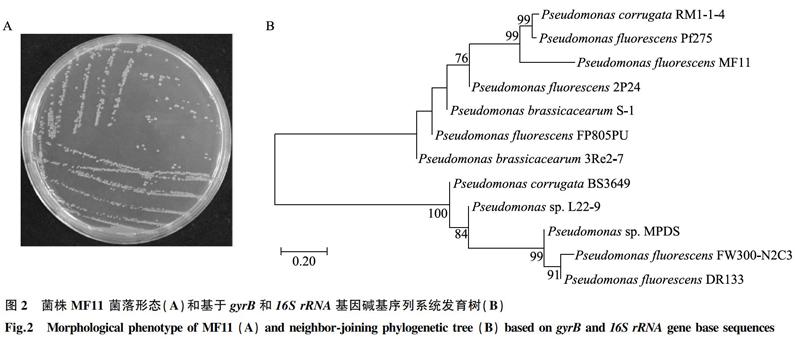
菌株MF11在LB平板上活化培养后的淡黄色透明菌落表面光滑,边缘整齐(图2A);革兰氏染色结果为革兰氏阴性菌。如表1所示,菌株MF11为需氧型细菌。氧化酶接触酶试验均呈阳性反应,明胶液化。在pH值为5或6的液体培养基中均可以正常生长。菌株还能够在含1% NaCl、4% NaCl的培养液中正常生长,而在8% NaCl的培养液中却无法生长。
经测序以及在NCBI数据库中进行Blast比对,结果显示,菌株MF11的16S rDNA部分碱基序列以及gyrB基因碱基序列与 Pseudomonas fluorescens碱基序列同源性高达99%。使用MEGA7.0软件,结合16S rRNA、gyrB基因碱基序列,以Neighbor-joining法构建系统发育树,发现MF11与荧光假单胞菌Pseudomonas fluroescens 位于系统发育树同一支,聚为一类(图2B)。结合生理生化鉴定结果,MF11为荧光假单胞菌(登录号MW493146)。
2.3 菌株MF11对南方根结线虫侵染的抑制作用
菌株MF11发酵液处理番茄幼苗30 min后,将幼苗放入含有1 500头 J2的Pluronic F-127凝胶中,观察线虫在根部的聚集及侵染情况。结果显示,1~4 h时处理组和对照组番茄根周围(1 mm内)有零星线虫聚集,未检测到线虫进入根内。8 h时,对照组距根尖1 mm以内的数量已增加到20至30头,处理组线虫数量低于20头。12~18 h时,对照组番茄对线虫吸引的数量逐渐增加,且有逐渐聚拢成团的趋势;而处理组线虫在根尖的聚集数量开始增加,至18 h时开始有聚团现象。24 h后,处理组和对照组线虫在根尖的聚团现象消失,线虫进入根内。
对不同时间点的线虫侵染数量统计结果表明:菌株MF11发酵液处理的番茄幼根中线虫数量明显低于对照(图3A)。12 h时发酵液处理的番茄根与对照相比,对线虫的侵染抑制效果最好,线虫侵染数量降低了80.65%,其他时间点发酵液处理与对照相比,均显著降低了线虫侵染数量(图3B)。表明,菌株MF11可降低番茄对根结线虫的吸引,进而影响线虫的侵染。
2.4 菌株MF11对南方根结线虫的温室盆栽防效
选取对线虫致死率最高的菌株MF11用于温室盆栽试验。试验结果表明:与对照相比,菌株MF11发酵液处理番茄植株21 d后,番茄根结数目降低,单位根质量的根结数目减少了86.53%(图4)。菌株MF11发酵液处理番茄56 d后,与对照相比,卵块数降低了70.52%,表明菌株MF11对南方根结线虫的繁殖能力具有一定的抑制效果(图4)。
2.5 菌株MF11对南方根结线虫的田间防效
田间防效测定结果显示:菌株MF11发酵液处理的番茄植株病情指数显著低于清水对照,与10%噻唑膦处理效果无显著差异(表2)。表明菌株MF11可用于根结线虫的田间防治。
3 讨论
利用根际微生物防治根结线虫是近些年的研究热点。由于微生物种群多样性与植物生长发育息息相关,从健康植物的根际中筛选到具有生防潜力的微生物的概率将大幅度提高[26]。Zhou等从健康茄子的根际中筛选到2株生防菌株Pseudomonas sp. B1 和 Bacillus sp.B32,温室盆栽试验结果显示B1和B32能够显著降低根结线虫的侵染[27]。本研究从健康番茄植株根际中分离到1株具有良好杀虫作用及田间防效较高的菌株MF11,经鉴定为荧光假单胞菌(Pseudomonas fluorescens)。
生防菌可产生具有毒杀线虫的活性酶、抗生素、挥发性物质和毒素等代谢物,通过毒杀作用、抑制卵孵化等方式来防治根结线虫病害。例如短小芽胞杆菌能够直接作用于根结线虫体表,在离体试验中对根结线虫起到显著防效[28];枯草芽胞杆菌可产生抗菌物质、杀线虫挥发物以及脂肽类化合物直接杀死二龄幼虫和卵[29-31]。菌株MF11发酵液具有较高杀线虫活性并且随着时间的延长杀虫作用明显,说明菌株MF11的代谢产物含有对南方根结线虫二龄幼虫具有毒杀作用的活性物质,代谢产物的活性成分尚有待探究。
植物根系分泌物是由植物根部分泌的各种化学物质,主要包括有机酸、糖类、酚类和各种氨基酸等,是植物根际微生物重要的营养物质,可作为植物和根际微生物间的信号物质参与根际微生物与寄主的识别[32-35]。研究结果表明根系分泌物对线虫卵的孵化、存活、线虫运动的方向性、线虫穿刺以及发育等有影响。生防菌可通过改变植物根系分泌物组成进而排斥线虫和影响线虫发育以及降低卵孵化效率等[36-38]。本研究发现荧光假单胞菌MF11处理番茄植株后,番茄根对南方根结线虫的吸引力显著下降,从而影响了线虫的侵染;盆栽试验中发现菌株MF11处理后,线虫产卵率显著下降,表明菌株MF11的定殖可能影响了植物根系分泌物的组成,进而影响了线虫与寄主的识别以及线虫的发育。菌株MF11影响根结线虫识别和导向寄主植株根部的具体机制仍不清楚,还需进一步研究。
生防制劑在田间的应用受到土壤温度、湿度、pH等外界因素的影响,防治效果不稳定[39]。本研究中,菌株MF11在田间的防治效果与目前广泛使用的化学药剂噻唑膦相当,达到66.71%。但由于化学杀线剂环境相容性差,危害大,使用成本高,所以荧光假单胞菌MF11可作为化学杀线剂替代品,具有良好的开发前景。后续要在其应用技术例如剂型开发、施用方法等方面进行研究,进一步提高其防治效果。
参考文献:
[1] ADAM M, WESTPHAL A, HALLMANN J, et al. Specific microbial attachment to root knot nematodes in suppressive soil [J]. Appl Environ Microbiol, 2014, 80(9): 2679-2686.
[2] PARK C S. Rapid detection of Pythium porphyrae in commercial samples of dried Porphyra yezoensis sheets by polymerase chain reaction [J]. J Appl Phycol, 2006, 18(2):203-207.
[3] CAKMAK I, EKMEN Z I, KARAGOZ M, et al. Development and reproduction of Sancassania polyphyllae (Acari: Acaridae) feeding on entomopathogenic nematodes and tissues of insect larvae [J]. Pedobiologia, 2010, 53(4):235-240.
[4] XU H, RUAN W B, GAO Y B, et al. Effects of root-knot nematodes on cucumber leaf N and P contents, soil pH, and soil enzyme activities [J]. Chinese J Appl Ecol, 2010, 21(8):2038-2044.
[5] 刘维志. 植物病原线虫学[M]. 北京:中国农业出版社,2000.
[6] FAN H, YAO M, WANG H, et al. Isolation and effect of Trichoderma citrinoviride Snef 1910 for the biological control of root-knot nematode, Meloidogyne incognita[J]. BMC Microbiol, 2020, 20(1):299.
[7] ZHANG S W, GAN Y T, LIU J, et al. Optimization of the fermentation media and parameters for the bio-control potential of Trichoderma longibrachiatum T6 against nematodes.[J]. Front Microbiol, 2020, 11(1): 574-601.
[8] D′ERRICO G, MORMILE P, MALINCONICO M, et al. Trichoderma ssp. and a carob (Ceratonia siliqua) galactomannan to control the root-knot nematode Meloidogyne incognita on tomato plants[J]. Can J Plant Pathol, 2020(3):1-8.
[9] SHARMA N, KHANNA K, MANHAS R K, et al. Insights into the role of Streptomyces hydrogenans as the plant growth promoter, photosynthetic pigment enhancer and biocontrol agent against Meloidogyne incognita in Solanum lycopersicum seedlings [J]. Plants Basel, 2020, 9(9):1-18.
[10]GHAHREMANI Z, ESCUDERO N, DANIEL B A, et al. Bacillus firmus strain I-1582, a nematode antagonist by itself and through the plant [J]. Front Plant Sci, 2020, 11. DOI:10.3389/fpls.2020.00796.
[11]NIMNOI P, RUANPANUN P. Suppression of root-knot disease and plant growth promotion of chili (Capsicum flutescens L.) using co-inoculation of Streptomyces spp. strains KPS-A032 and KPS-E004 [J]. Biol Contr, 2020,145. DOI: 10.1016/j.biocontrol.2020.104244.
[12]PORNTHIP R, PONGRAWEE N. Evaluation on the efficiency and persistence of Streptomyces jietaisiensis strain A034 in controlling root knot disease and promoting plant growth in the plant-parasitic nematode infested soils [J]. Biol Contr, 2020,144. DOI: 10.1016/j.biocontrol.2020.104221.
[13]ULLAH M A, HAFEEZ F Y. Plant growth--romoting rhizobacteria as zinc mobilizers: A promising approach for cereals biofortification[J]. Springer Berlin Heidelberg, 2014, 9:217-235.
[14]ALMAGHRABI O A, MASSOUD S I, ABDELMONEIM T S. Influence of inoculation with plant growth promoting rhizobacteria (PGPR) on tomato plant growth and nematode reproduction under greenhouse conditions [J]. Saudi J Biol Sci, 2013, 20(1):57-61.
[15]WEI X, PEI S Y, HAN Q W, et al. Antagonizing Aspergillus parasiticus and promoting peanut growth of Bacillus isolated from Peanut geocarposphere soil [J]. J Integrat Agri, 2014, 13(11):2445-2451.
[16]NI X, LAWRENCE K S , KLOEPPER J W, et al. Biological control of Heterodera glycines by spore-forming plant growth-promoting rhizobacteria (PGPR) on soybean[J]. PLoS One, 2017, 12(7):e0181201.
[17]BAGHERI N, AHMADZADEH M, HEYDARI R. Effects of Pseudomonas fluorescens strain UTPF5 on the mobility, mortality and hatching of root-knot nematode Meloidogyne javanica [J]. Archiv Phytopathol Plant Protect, 2014, 47(6):744-752.
[18]SEYEDEH Z D, MOHAMMAD A, HABIBALLAH C, et al. Combined of salicylic acid and Pseudomonas fluorescens CHA0 on the expression of PR1 gene and control of Meloidogyne javanica in tomato[J]. Biol Contr, 2020, 141. DOI: 10.1016/J.BIOCONTROL.2019.104134.
[19]WEI L H, SHAO Y, WAN J, et al. Isolation and characterization of a rhizobacterial antagonist of root-knot nematodes.[J]. PLoS One, 2014, 9(1):e85988.
[20]CHOI T G, MAUNG C E, LEE D R, et al. Role of bacterial antagonists of fungal pathogens, Bacillus thuringiensis KYC and Bacillus velezensis CE100 in control of root-knot nematode, Meloidogyne incognita and subsequent growth promotion of tomato[J]. Biocontr Sci Technol, 2020, 30(7):685-700.
[21]東秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[22]GALKIEWICZ J P, KELLOGG C A. Cross-kingdom amplification using bacteria-specific primers: complications for studies of coral microbial ecology [J]. Appl Environ Microbiol, 2008, 74(24):28-31.
[23]MORISHITA M, BARICHELLO J M, TAKAYAMA K, et al. Pluronic F-127 gels incorporating highly purified unsaturated fatty acids for buccal delivery of insulin[J]. Int J Pharm, 2001, 212(2):289-293.
[24]BRIDGE J, PAGE S. Estimation of root-knot nematode infestation levels on roots using a rating chart [J]. Tropic Pest Manag, 1980, 26(3):296-298.
[25]XUE Q Y, CHEN Y, LI S M, et al. Evaluation of the strains of Acinetobacter and Enterobacter as potential biocontrol agents against Ralstonia wilt of tomato [J]. Biol Contr, 2009, 48(3):252-258.
[26]BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health [J]. Trend Plant Sci, 2012, 17(8):478-486.
[27]ZHOU D M, FENG H, SCHUELKE T, et al. Rhizosphere microbiomes from root knot nematode non-infested plants suppress nematode infection [J]. Microb Ecol, 2019, 78(2):470-481.
[28]MOGHADDAM M R, MOGHADDAM E M, RAVARI S B, et al. The nematicidal potential of local Bacillus species against the root-knot nematode infecting greenhouse tomatoes [J]. Biocontr Sci Tech, 2014, 24(3):279-290.
[29]KILLANI A S, ABAIDOO R C, AKINTOKUN A K, et al. Rice husk extract is potentially effective as a phytopesticide against root-soil-borne fungal pathogens of cowpea[J]. Nat Sci, 2011, 9(3):72-79.
[30]HUANG Y, XU C K, MA L, et al. Characterisation of volatiles produced from Bacillus megaterium YFM3.25 and their nematicidal activity against Meloidogyne incognita [J]. Eur J Plant Pathol, 2010, 126(3):417-422.
[31]KAVITHA P G, JONATHAN E L, NAKKEERAN S. Effects of crude antibiotic of Bacillus subtilis on hatching of eggs and mortality of juveniles of Meloidogyne incognita [J]. Nematol Mediter, 2012, 40(2):203-206.
[32]羅丽芬,江冰冰,邓琳梅,等. 三七根系分泌物中几种成分对根腐病原菌生长的影响[J].南方农业学报,2020,51(12):2952-2961.
[33]黄鑫星,蒋家陆,罗 沛,等. 氨态氮浓度和收割频率对绿狐尾藻根系泌氧特性的影响[J].江苏农业学报,2020,36(5):1112-1118.
[34]张 坤,刁 明,景 博,等. 不同灌水量与灌水频率对加工番茄 根系生长和产量的影响[J].排灌机械工程学报,2020,38(1):83-89.
[35]高伟勤,刘春艳,吴强盛.钾胁迫对枳生长及根系激素和信号物质水平的影响[J].江苏农业科学,2020,48(8):139-141.
[36]YANG G, ZHOU B, ZHANG X, et al. Effects of tomato root exudates on Meloidogyne incognita [J]. PLoS One, 2016, 11(4):e0154675.
[37]李 霞. 蜡样芽孢杆菌调控番茄根系分泌物对南方根结线虫的作用[D].南京:南京师范大学,2019.
[38]BIRKETT M, DUTTA T K, POWERS S J, et al. Effect of small lipophilic molecules in tomato and rice root exudates on the behaviour of Meloidogyne incognita and M. graminicola [J]. Nematol, 2012, 14(3):309-320.
[39]OSMAN H A, MAHMOUD Y, ABD E M, et al. Effect of reniform nematode, Rotylenchulus reniformis as biotic inducer of resistance against root-knot nematode, Meloidogyne incognita in potato [J]. J Plant Protect Res, 2012, 52(3):333-336.
(责任编辑:张震林)
