基于网络药理学预测苦参治疗肝癌的分子机制
2021-06-30张元元李旭廖子君王玉珍
张元元 李旭 廖子君 王玉珍

摘要 目的:运用网络药理学的方法,探讨苦参治疗肝癌的作用机制。方法:通过中医药系统药理学数据库分析平台(TCMSP)筛选出苦参活性成分及作用靶点;在OMIM和Genecards中获取疾病靶点。通过R语言对基因进行匹配并绘制韦恩图;在String网站构建活性成分-蛋白质-蛋白质相互作用网络图;Cytoscape 3.6.1软件构建成分-靶点网络;通过R软件进行GO富集分析和KEGG通路富集分析。结果:共筛选出45个活性成分和176个潜在作用靶点;GO及KEGG功能富集显示苦参主要影响PI3K/Akt/mTOR通路及HIF-1a等信号通路。结论:苦参可能通过影响PI3K/Akt/mTOR通路及HIF-1a等信号通路,从而调控肝癌细胞侵袭及转移。
关键词 网络药理学;苦参;肝癌;机制;活性成分;靶点;富集分析;信号通路
Molecular Mechanism of Sophora Flavescens in the Treatment of Liver Cancer Based on Network Pharmacology
ZHANG Yuanyuan1,2,LI Xu2,LIAO Zijun2,WANG Yuzhen2
(1 Graduate Department,Xi′an Medical College,Xi′an 710068,China; 2 First Department
of Internal Medicine,Shaanxi Cancer Hospital,Xi′an 710061,China)
Abstract Objective:To explore the mechanism of Sophora flavescens in the treatment of liver cancer by means of network pharmacology.Methods:First,the active ingredients and targets of Sophora flavescens were screened through the TCMSP platform; then the disease targets were obtained from OMIM and Genecards.We matched genes through R language and draw a Venn diagram; then constructed an active ingredient-protein interaction network diagram on the String website; constructed a component-target network with Cytoscape 3.6.1 software; performed GO enrichment analysis and KEGG pathway enrichment analysis through R software.Results:A total of 45 active ingredients and 176 potential targets were screened; GO and KEGG function enrichment showed that Sophora flavescens mainly affected PI3K/Akt/mTOR pathway and HIF-1a signal pathways.Conclusion:Sophora flavescens may regulate the invasion and metastasis of liver cancer cells by affecting the PI3K/Akt/mTOR pathway and HIF-1a signaling pathways.
Keywords Network pharmacology; Sophora flavescens; Liver cancer; Mechanism; Active ingredients; Target; Enrichment analysis; Signal pathway
中圖分类号:R282;R735.7文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.05.013
肝癌发病率在所有恶性肿瘤中居于第6位,死亡率居第3位[1]。原发性肝癌属“积聚”范畴,对于本病的治疗侧重于补虚祛瘀、活血化瘀通络[2]。复方苦参注射液为临床常用辅助治疗肝癌药物。中医认为苦参主心腹结气,归肝胆经,而苦参具有软坚散结、止痛解郁、增强免疫功能等功效[3]。研究证实苦参成分中的苦参碱等活性成分具有抗肝癌细胞侵袭、迁移的作用[4]。本研究应用网络药理学的方法预测苦参治疗肝癌的多靶标及多通路的协同作用,进一步为肝癌的临床及相关基础研究提供参考。现报道如下。
1 资料与方法
1.1 参芪扶正注射液化学成分的收集及靶点预测 在中医药系统药理学数据库分析平台(Traditional Chinese Medicine Systems Pharmacology,TCMSP)中输入苦参进行成分与对应靶点的查询以及筛选每味中药可靠的成分信息。选择标准:口服利用度(Oral Bioavailability,OB)≥30%和类药性(Drug Likeness,DL)≥0.18。
1.2 活性化合物作用靶点的收集 利用TCMSP输入苦参进行检索并整理,获得活性化合物作用靶点。化合物-靶点网络的构建及拓扑学性质分析,利用Cytoscape 3.6.1软件(http://www.cytoscape.org/)将收集的中药化合物和靶点来构建化合物-靶点网络。在该网络中筛选自由度(Degree Centrality,DC)为0.9的节点和相应的介数(Closeness Centrality,CC)进行拓扑分析,以明确关键的化合物或者靶点。
1.3 交集靶点的获取 在genecard(https://genecard.org/)数据库、OMIM数据库(http://omim.org/)、GAD数据库(https://geneticassociationdb.nih.gov/),利用“liver cancer”和“Hepatocellular Carcinoma”作为关键词进行已知疾病靶点的检索及筛查,删除重复靶点以获得已知靶点。利用R语言绘制将药物活性成分相关的靶点和疾病靶点进行匹配映射,并绘制维恩(Venn)图获得苦参活性成分的潜在抗肝癌作用靶点。
1.4 构建苦参靶点蛋白质-蛋白质相互作用(PPI)网络 将活性成分所对应的靶点基因和肝癌相关的靶点基因进行匹配,获得二者的共同基因即为苦参抗肝癌的关键靶点。采用Cytoscape 3.6.1软件构建“药物-共活性成分-关键靶点基因”关系网络。网络外围节点代表疾病与药物活性成分的关键靶点基因;网络中显示的是药物的活性成分。整个网络展示药物-共活性成分-疾病靶点之间的联系,通过构建这一网络探析治疗肝癌的作用机制。
1.5 关键靶点蛋白质-蛋白质相互作用网络的构建 利用STRING数据库平台(https://string-db.org/Version 10.5)预测蛋白相互作用关系。将苦参作用关键靶点导入String数据库,将研究物种为选择为人类(Human Sapiens),获得蛋白质相互作用关系,将结果以TSV格式导出。其中浅蓝色的线代表从数据库中的来的蛋白间作用,紫色线代表经过实验验证的蛋白间作用。
1.6 基因本体(Gene Ontology,GO)富集分析与基因相互作用KEGG通路富集分析 利用R语言对获得的基因进行GO富集分析和KEGG通路分析。首先在R中进行安装包的安装Bioconductor软件包“org.Hs.eg.db”并运行,将苦参治疗肝癌的关键靶基因转换成entrezID以进行关键靶基因GO与KEGG功能富集分析(P<0.05,FDR<0.05),并将结果以条形图形式输出。
2 结果
2.1 苦参活性成分和靶基因 通过TCMSP数据库检索的苦参化学成分126个,通过口服利用度(OB)>30%和类比性(DL)>0.18进一步筛选得到苦参的潜在活性成分45个。见表1。
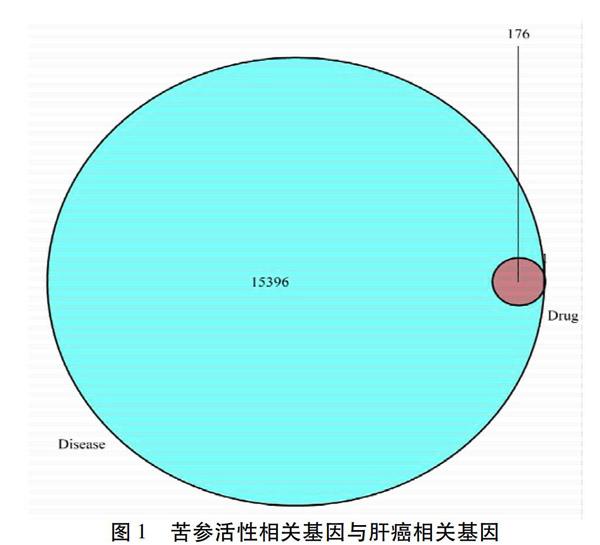
2.2 肝癌相关基因 在GeneCards数据库、OMIM数据库和GAD数据库,检索“Liver Cancer”“Hepatocellular Carcinoma”,共筛选出15 396个肝癌相关基因,然后分别与苦参对应的靶基因映射,得到176个苦参活性成分治疗肝癌的靶基因。见图1。
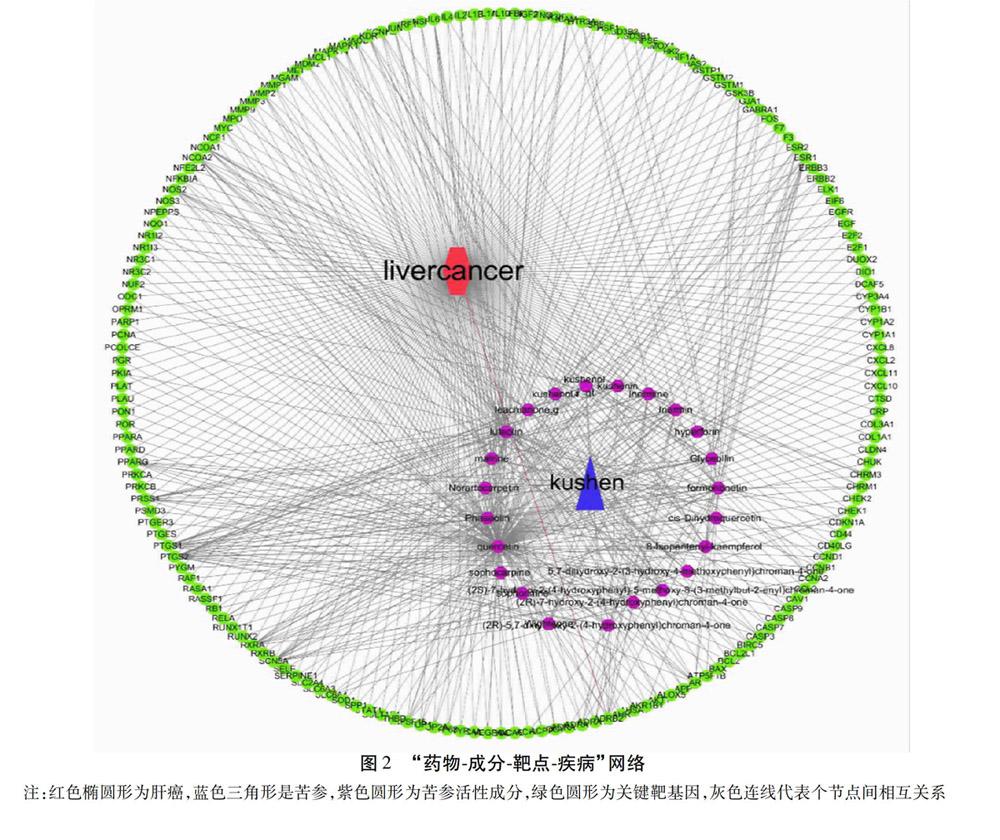
2.3 “药物-成分-靶点-疾病”网络构建与分析 苦参与肝癌作用靶点相关的药物的潜在活性成分有23个。将苦参与肝癌相关的关键靶点基因导入Cytoscape软件进行网络构建及可视化(图2)。结果表明,苦参中连接度为前5的潜在活性分子为槲皮素(Quercetin),大豆素(Daidzein),芒柄花素(Formononetin),8-Isopentenyl-kaempferol,(2S)-7-hydroxy-2-(4-hydroxyphenyl)-5-methoxy-8-(3-methylbut-2-enyl)chroman-4-one。以上成分对肝癌的治疗有着重要意义。
2.4 共表达网络的构建 将原发性肝癌治疗的潜在的关键靶点基因导入String数据库平台,选择物种为人类,获取蛋白质相互作用关系,利用该平台绘制蛋白关系网络(图3)。排除游离的(无相互作用蛋白),该网络图共包括45个节点,288个边。用节点的大小和颜色表示Degree值的大小,节点越大对应的Degree值越大,颜色由红变蓝对应的Degree值越大。用边的粗细表示Combine score值的大小,边越粗Combine score值越大。根据Degree≥10的节点制作出前7个关键蛋白质节点(图4)。关键节点为JUN、RELA、MAPK1、MAPK14、AKT1、ESRI、RB1这些靶点基因在治疗肝癌治疗中具有重要意义,可作为药对参芪扶正注射液有效成分作用的靶点基因。
2.5 GO功能富集分析 通过关键靶基因,根据校正后P值进行排序,选择前20个进行条形图展示。见图5。苦参主要参与核受体功能、转聚合酶Ⅱ近端启动子序列特录因子活性、类固醇激素受体活性、细胞因子受体结合、细胞因子活性脱氧核糖核酸(DNA)结合转录激活因子活性和核糖核酸(RNA)聚合酶Ⅱ特异性、RNA异性DNA结合、泛素样蛋白连接酶结合、RNA聚合酶Ⅱ转录因子结合、近端启动子DNA结合转录激活因子活性、激素结合、激酶调节活性、四吡咯结合、固醇类激素结合、核激素受体结合等。
2.6 KEGG通路富集分析 关键靶基因与KEGG通路进行映射,根据校正后P值进行排序,选择前20个进行条形图展示。见图6。苦参治疗肝癌的信号通路包括人巨细胞病毒感染、流体剪切应力与动脉粥样硬化、癌症中的蛋白多糖、糖尿病中的AGE-REGE信号通路、内分泌抵抗、白细胞介素-7(IL-7)、肿瘤坏死因子(TNF),P53,缺氧诱导因子-1a(HIF-1a)等信号通路,还包括非小细胞肺癌、小细胞肺癌、前列腺癌、膀胱癌等与癌症相关的信号通路。
3 讨论
苦参具有抗肿瘤、辅助放化疗增敏、提高免疫力、缓解癌性疼痛等功效[5]。本研究通过TCMSP数据库获得苦参活性成分并进一步分析获得其活性成分,通过GeneCards数据库、OMIM数据库和GAD数据库,获得肝癌相关基因,通过Cytoscape软件进行“药物-成分-靶点-疾病”网络构建与分析苦参中位于前5位的潜在活性分子,然后通過String数据库进行共表达网络构建获取关键靶基因,最后进行GO及KEGG功能富集分析分析其相关信号通路。马云青等[6]研究表明槲皮素能够抑制肿瘤细胞分裂增殖,诱导肿瘤细胞的凋亡,尤其对肝癌细胞具有很强的抑制能力。Tan等[7]发现槲皮素能使下调肝癌细胞组织中的凋亡抑制基因Survivin和Bcl-2蛋白的表达,同时上调P53蛋白的水平。张蕾等[8]对经过刺芒柄花素的67例老年晚期肺癌患者胸水及血清中血清基质金属蛋白酶(MMP-2)、E选择素(ES)、血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)等指标及肿瘤标志物进行分析,发现该药治疗后患者胸水及血清中上述指标明显降低。Ye等[9]研究表明,芒柄花素能够抑制前列腺癌LNCa P细胞和PC-3细胞增殖,同时也可使LNCa P细胞凋亡。目前对于(2S)-7-hydroxy-2-(4-hydroxyphenyl)-5-methoxy-8-(3-methylbut-2-enyl)
chroman-4-one的研究还尚未见报道,而本研究表明该活性成分是苦参发生作用的关键活性成分。因此这些活性成分的药理作用有必要深入研究,以便于进一步为临床提供指导。
本研究发现苦参对肝癌发挥治疗作用的7个关键靶点节点为JUN、RELA、MAPK1、MAPK14、AKT1、ESRI、RB1。Wang等[10]研究发现JNK/c-Jun/AP-1信号通路的激活能使mdr1的表达水平升高,从而介导了5-氟尿嘧啶耐药Bel-7402/FU人肝癌细胞的耐药。也有研究表明c-Jun能通过对β3GnT8的调控作用发挥对肝癌细胞侵袭、迁移调控的作用机制[11]。而本研究表明JUN基因是苦参对肝癌发挥治疗作用的一个关键靶点,但目前关于苦参通过调控JUN基因来调节肝癌细胞侵袭和迁移的作用机制尚未有研究报道,因此可做进一步研究。既往有研究表明MAPK的激活导致了肝癌的迁移、侵袭和转移等恶性生物学行为[12]。MAPK1磷酸化并作用于下游蛋白后会使细胞周期从G1期进入S期[13]。目前有研究报道苦参素可能通过对MAPK信号通路的调控发挥抑制肝癌细胞增殖的作用[14],进一步验证了本研究的正确性。本研究发现MAPK14也是苦参作用的关键靶点,但关于苦参通过调控MAPK14基因来抑制肝癌细胞增殖的研究目前还尚未见报道,有必要对其深入研究。有研究报道过表达HBx既能促进肝癌细胞增殖也能上调PI3K和AKT的表达[15],而AKT蛋白激活后会激活下游通路,促进底物水平的磷酸化,发挥抑制细胞凋亡的作用[16]。郭浩等[17]研究发现,苦参碱可能通过调控PI3K/Akt/mTOR通路从而促进肝癌细胞自噬,但具体机制尚不十分清楚。本研究证实AKT是苦参作用的关键靶点。ESR1属于雌激素受体,通过与其配体结合发挥作用。既往研究表明ESR1多态性导致肝癌发病风险的增加[18]。但目前关于苦参通过调控ESR1基因来影响肝癌发生发展的报道尚未见报道,因此可深入研究。本研究发现核心基因的GO功能富集主要集中在核受体功能、转录因子活性、类固醇激素受体活性、细胞因子受体结合、细胞因子活性脱氧核糖核酸(DNA)结合转录激活因子活性和核糖核酸(RNA)聚合酶Ⅱ特异性、RNA聚合酶Ⅱ近端启动子序列特异性DNA结合、泛素样蛋白连接酶结合、RNA聚合酶Ⅱ转录因子结合、近端启动子DNA结合转录激活因子活性、激素结合、激酶调节活性、四吡咯结合、固醇类激素结合、核激素受体结合等,这些基本生物学过程和功能体现在苦参活性成分调节对应靶基因和具体通路过程中。关于KEGG通路富集,主要包括人巨细胞病毒感染、流体剪切应力与动脉粥样硬化、糖尿病中的AGE-REGE信号通路、癌症中的蛋白多糖、内分泌抵抗、白细胞介素-17(IL-17)、肿瘤坏死因子(TNF),P53,缺氧诱导因子-1a(HIF-1a)等信号通路,还包括非小细胞肺癌、小细胞肺癌、前列腺癌、膀胱癌等其他肿瘤相关信号通路。分析其富集通路可知,苦参主要通过改变肿瘤微环境,抑制肿瘤细胞的转移及促进肿瘤细胞凋亡,发挥治疗肝癌的作用。有研究报道抑制MAPK信号通路后可以减低AML复发的风险[19]。而我们的研究也证实了MAPK是苦参作用的关键靶点,而巨细胞病毒感染也是肝癌发展的危险因素,但目前关于此的研究尚未见报道。研究表明低流体剪切应力与动脉粥样硬化存在正相关,同时低流体剪切力也可以促进上皮间质转化,并能进一步激活EGFR等转录调控因子[20]。但目前关于流体剪切应力与肿瘤关系的研究也鲜有报道,流体剪切应力导致肝癌发生发展的研究尚未见报道,而我们通过KEGG也富集出该通路,因此可做深入研究。研究报道AGE-RAGE通过激活PI3K/Akt通路调控RB的表达,进而促进前列腺癌细胞的增殖[21]。但目前关于该通路对肝癌影响的研究尚未见报道,因此值得进一步深入研究。谢如欣[22]研究表明多糖能通过影响PI3K/Akt、MAPK等信号通路发挥抑制抗肿瘤作用,但目前关于此研究较少。苦参作用靶点富集分析显示能够作用于肺、前列腺、膀胱等器官,通过上调或者下调疾病进展的相关基因来促进或者抑制肿瘤的发生及发展。
综上所述,通过网络药理学这种研究方法,通过构建“药物-成分-靶点-疾病”网络,对苦参多成分、多靶点、多通路进行分析,发现苦参抗肝癌的主要活性成分包括槲皮素(Quercetin),Glyceollin,芒柄花素(Formononetin),8-Isopentenyl-kaempferol和(2S)-7-hydroxy-2-(4-hydroxyphenyl)-5-methoxy-8-(3-methylbut-2-enyl)chroman-4-one。上述活性成分通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡发挥抗肿瘤作用。
参考文献
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424..
[2]Xi SY,Minuk GY.Role of traditional Chinese medicine in the management of patients with hepatocellular carcinoma[J].World J Hepatol,2018,10(11):799-806.
[3]郝春海,田立斌,何津.復方苦参注射液对原发性肝癌患者术后复发的预防作用及生存函数分析[J].中西医结合肝病杂志,2020,30(4):303-306.
[4]张明发,沈雅琴.苦参碱抗人肝癌HepG2细胞的药理作用及其机制的研究进展[J].药物评价研究,2020,43(2):349-355.
[5]姜宁,路平.浅谈使用复方苦参注射液治疗癌症的效果[J].当代医药论丛,2016,14(1):17-18.
[6]马云青,李晓梅,刘雪萍,等.槲皮素通过G4调控癌基因表达影响肿瘤细胞增殖与凋亡[J].中国细胞生物学学报,2019,41(12):2319-2331.
[7]Tan J,Wang B,Zhu L.Regulation of survivin and Bcl-2 in HepG2 cell apoptosis induced by quercetin[J].Chem Biodivers,2009,6(7):1101-1110.
[8]张蕾,任中海,薛永飞.刺芒柄花素对老年晚期肺癌患者胸水及血清中内皮抑素、VEGF、MMP-2、bFGF及肿瘤标志物的影响[J].中国生化药物杂志,2015,35(8):154-157.
[9]Ye Y,Hou R,Chen J,et al.Formononetin-induced apoptosis of human prostate cancer cells through ERK1/2 mitogen-activated protein kinase inactivation[J].Horm Metab Res,2012,44(4):263-267.
[10]Wang PP,Luan JJ,Xu WK,et al.Astragaloside Ⅳ downregulates the expression of MDR1 in Bel 7402/FU human hepatic cancer cells by inhibiting the JNK/c Jun/AP 1 signaling pathway[J].Mol Med Rep,2017,16(3):2761-2766.
[11]邱浩.转录因子c-Jun通过调控β3GnT8表达改变肝癌细胞侵袭、迁移机制研究[D].苏州:苏州大学,2016.
[12]Feng PC,Ke XF,Kuang HL,et al.BMP2 secretion from hepatocellular carcinoma cell HepG2 enhances angiogenesis and tumor growth in endothelial cells via activation of the MAPK/p38 signaling pathway[J].Stem Cell Res Ther,2019,10(1):237.
[13]侯东泽,代劲松,邓志波,等.MicroRNA-490-5p靶向CDK1通过ERK信号通路参与胃癌细胞周期调控[J].现代肿瘤医学,2017,25(16):2565-2572.
[14]邓志华,黄赞松,曹聪,等.苦参素对肝癌Bel-7404细胞的增殖、丝裂原活化蛋白激酶1及细胞周期蛋白D1表达的影响[J].广西医学,2019,41(17):2202-2205.
[15]张斌,丁慎华,徐春江,等.HBx过表达对肝癌HepG2细胞AKT、PI3K表达的影响[J].胃肠病学和肝病学杂志,2019,28(2):159-162.
[16]赵家义.PI3K-AKT-mTOR信号通路抑制剂与肿瘤免疫治疗[J].中国肿瘤生物治疗杂志,2017,24(12):1424-1430.
[17]郭浩,周淑妮,冉瑞智.苦参碱调控肝癌细胞HepG2自噬作用机制研究[J].中国药业,2019,28(6):14-17.
[18]Zhai Y,Zhou G,Deng G,et al.Estrogen receptor alpha polymorphisms associated with susceptibility to hepatocellular carcinoma in hepatitis B virus carriers[J].Gastroenterology,2006,130(7):2001-2009.
[19]Feng Y,Li L,Du Y,et al.E2F4 functions as a tumour suppressor in acute myeloid leukaemia via inhibition of the MAPK signalling pathway by binding to EZH2[J].J Cell Mol Med,2020,24(3):2157-2168.
[20]譚利兰,罗勇,肖晨,等.低剪切应力与动脉粥样硬化形成研究新进展[J].中国动脉硬化杂志,2019,27(5):432-438.
[21]包继明.AGE-RAGE激活PI3K/Akt通路调控视网膜母细胞瘤蛋白促进前列腺癌细胞增殖的机制研究[D].广州:南方医科大学,2014.
[22]谢如欣.多糖抗肿瘤免疫调节机制的研究进展[J].现代医药卫生,2019,35(24):3798-3801.
(2020-03-05收稿 责任编辑:杨觉雄)
基金项目:CSCO中医药肿瘤研究基金项目(Y-L2018-002)
作者简介:张元元(1992.04—),女,硕士研究生在读,研究方向:消化道肿瘤的临床诊治与基础研究,E-mail:1217192963@qq.com
通信作者:廖子君(1963.05—),男,博士,主任医师,研究方向:肿瘤内科临床诊治与基础研究,E-mail:liaozijun66@sina.com
