白皮杉醇对氧化应激断奶仔猪空肠抗氧化能力、黏膜形态和屏障功能的影响
2021-06-30贾沛璐陈亚楠季书立
贾沛璐,张 昊,陈亚楠,季书立,王 恬
(南京农业大学动物科技学院,南京 210095)
生物体在进行以氧气为基础的能量代谢过程中,涉及多种复杂的氧化还原反应,故不可避免地产生多种活性氧(reactive oxygen species, ROS)。若ROS未被及时清除,会攻击细胞脂质、DNA和蛋白质等大分子物质,引发过氧化损伤并产生氧化应激[1]。在正常动物体内,ROS的产生和清除处于一种动态平衡的状态,机体通过抗氧化系统,产生能够清除ROS的物质和酶,以保证机体不受ROS的影响[2]。然而,当动物外界环境发生变化或者机体抗氧化系统尚未发育完全的时候,机体不能够及时有效清除ROS,导致过量ROS积聚,从而发生氧化应激[3]。空肠作为机体从外界环境吸收营养物质、沟通内外环境的器官,易受内外环境的影响而产生氧化应激,从而出现形态结构异常、屏障功能损伤、消化吸收功能受损等现象[4]。因此,研究氧化应激对肠道的影响变得尤为重要。敌草快(DQ)是一种常用的氧化应激诱导剂,其能在动物体内迅速产生大量ROS并引发氧化应激[5-6],而断奶仔猪易发生断奶应激导致肠道损伤,进而加剧氧化应激程度。白皮杉醇(PIC)作为一种植物源天然抗氧化剂,因其显著的抗氧化生物活性而受到广泛关注。研究表明,PIC能够增强抗氧化酶活性,上调抗氧化基因的表达,从而缓解氧化应激损伤[7-8],Yang等[9]研究表明,PIC能降低由脂肪变性导致的氧化应激Hep-G2细胞内的ROS含量,Hao等[10]则发现,PIC通过促进Nrf2核移位增强人视网膜上皮色素细胞的抗氧化能力,而Zhu等[11]研究表明,PIC通过降低人角质形成细胞的氧化应激水平抑制了细胞的异常增殖。然而,目前关于PIC抗氧化活性的研究多集中于细胞水平,在动物机体水平的研究还鲜有报道。
本试验使用DQ诱导断奶仔猪发生氧化应激,建立氧化应激的肠道损伤模型,并通过灌喂PIC来探究其对断奶仔猪空肠抗氧化酶活性、抗氧化相关基因表达以及肠道形态结构和屏障功能的影响。
1 材料与方法
1.1 试验设计
试验选取体重相近的28日龄“杜×长×大”三元杂交断奶仔猪共54头,其平均体重为(8.13±0.41) kg,随机分为3个处理组(每组6个重复,每个重复3头猪):对照组(CON)灌喂0.5%的羧甲基纤维素钠溶液(Sigma-Aldrich, 美国)并在屠宰前24 h注射生理盐水,敌草快组(DQ-CON)灌喂0.5%的羧甲基纤维素钠溶液并在屠宰前24 h注射DQ(10 mg·kg-1,Sigma-Aldrich, 美国),敌草快+白皮杉醇组(DQ-PIC)灌喂含有PIC(80 mg·kg-1,杭州瑞树生物科技有限公司,杭州)的0.5%羧甲基纤维素钠溶液并在屠宰前24 h注射DQ。本试验中,10 mg·kg-1DQ的注射剂量参考Cao等[12]的方法。目前,尚无PIC在断奶仔猪上的研究报道,故本试验参考了PIC母体化合物——白藜芦醇的应用剂量,即80 mg·kg-1[13-15]。PIC是一种白藜芦醇衍生物,与白藜芦醇具有相似的化学结构和生物活性,且同属于植物源多酚活性物质[16]。因此认为,白藜芦醇在断奶仔猪上的最适剂量对于PIC而言具有重要的参考价值。所有组别的仔猪均饲喂基础日粮,自由采食,充足饮水。基础日粮组成及营养水平见表1。

表1 日粮的组成和营养水平

(续表1)
1.2 样本采集
在36日龄时,从每头仔猪的前腔静脉采集血液,并在4 ℃下以4 000 r·min-1离心10 min,收集血清。所有仔猪被电击致晕,然后采用颈动脉放血的方法进行处死后迅速剖开腹腔,分离出肠道,并从空肠中段部分截取长度约为1 cm的肠段,然后用无菌生理盐水冲洗,并立即放入4%多聚甲醛缓冲液中进行固定,以进行后续的形态分析。纵向切开相邻的肠段后,小心地刮下空肠黏膜并装入冷冻保存管,迅速放入-80 ℃的液氮中保存待进一步分析。
1.3 空肠的形态学分析
将空肠样品在4%多聚甲醛中固定24 h后,使用梯度浓度乙醇对其进行脱水,然后包埋在石蜡中。用切片机将包埋有样品的石蜡块切成5 μm厚的切片,并在42 ℃下烘烤8 h,然后用苏木精(hematoxylin)和伊红(eosin)进行染色。最后使用倒置显微镜(日本Nikon公司,型号为ECLIPSE 80i)对经过以上处理后的切片进行观察和分析。使用Image-Pro Plus软件(美国Media Cybernetics公司,版本为Windows 6.0)对切片的空肠绒毛高度(VH)和隐窝深度(CD)进行测量,每张切片随机选取至少10个视野。
1.4 空肠抗氧化能力测定
将大约300 mg的空肠黏膜冷冻样品与生理盐水按照1∶4(质量∶体积)的比例进行混合,然后使用高速匀浆机匀浆制成匀浆液。将匀浆液于4 ℃下4 000 r·min-1离心10 min后,提取上清液进行分析。上清液中总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)的活性,以及总抗氧化能力(T-AOC)和丙二醛(MDA)含量的测定均使用相应的商业试剂盒(南京建成生物科技研究所, 南京)按照对应的说明书进行测定。
1.5 空肠mRNA的提取和实时荧光定量聚合酶链式反应(qRT-PCR)
使用TRIzol试剂(Thermo Fisher Scientific, 美国)对空肠黏膜组织中的总mRNA进行提取,并对mRNA的浓度和纯度进行检测。使用PrimeScriptTMRT Master Mix(TaKaRa,大连)对总mRNA 进行反转录,然后使用SYBR Premix ExTaqⅡ试剂盒(TaKaRa,大连)和荧光定量聚合酶链反应仪(Applied Biosystems,美国)进行体系为20 μL的qRT-PCR反应:上、下游引物各0.4 μL、10 μL SYBR Premix Ex Taq、6.8 μL超纯水、2 μL cDNA模板和0.4 μL ROX Reference Dye。反应过程:95 ℃ 30 s;95 ℃ 5 s,40个循环;60 ℃ 30 s。以β-actin作为内参基因,2-△△Ct法计算目标基因的相对表达丰度,试验中使用的引物序列见表2。

表2 本试验中使用的引物序列
1.6 数据分析
使用Excel 2013对试验数据进行初步整理,并用“平均值±标准误(SE)”来表示。使用SPSS 20.0对数据进行单因素方差分析(one-way ANOVA),并使用Tukey 法进行组间比较以检验组间差异性,P<0.05表示差异显著。
2 结 果
2.1 PIC对氧化应激断奶仔猪空肠绒毛高度(VH)和隐窝深度(CD)的影响
由表3可知,DQ-CON组仔猪的空肠VH和VH/CD均显著低于CON组(P<0.05)。而DQ-PIC组仔猪空肠的VH/CD显著高于DQ-CON组(P<0.05)。各组之间的空肠CD均没有显著差异(P>0.05)。

表3 PIC对氧化应激断奶仔猪空肠屏障和形态结构的影响
与CON组仔猪相比,DQ-CON组仔猪血浆DAO含量显著升高(P<0.05),且空肠OCLN表达量显著下调(P<0.05);而DQ-PIC组仔猪的血浆DAO含量则显著低于DQ-CON组(P<0.05),同时其空肠OCLN表达量显著高于DQ-CON组(P<0.05)。
2.2 PIC对氧化应激断奶仔猪空肠黏膜抗氧化能力的影响
由表4可知,DQ-CON组的T-SOD活性、GPx活性和CAT活性均显著低于CON组(P<0.05),而DQ-PIC组中的上述酶活性均显著高于DQ-CON组(P<0.05)。同样地,DQ-CON组的T-AOC显著低于CON组(P<0.05),而DQ-PIC组的T-AOC则显著高于DQ-CON组(P<0.05)。DQ-CON组的MDA含量显著高于CON组(P<0.05),而DQ-PIC组显著低于DQ-CON组(P<0.05)。

表4 PIC对氧化应激断奶仔猪空肠黏膜的抗氧化酶活性的影响
为了进一步探究PIC对氧化应激断奶仔猪空肠抗氧化能力在RNA水平上的影响,本研究测定了空肠抗氧化相关基因的相对表达丰度,结果见表5。DQ-PIC组NQO1基因的相对表达丰度显著高于DQ-CON和CON组(P<0.05),而DQ-CON组与CON组之间则没有显著差异(P>0.05)。DQ-CON组SOD1基因的相对表达丰度显著低于CON组(P<0.05),而DQ-PIC组则显著高于DQ-CON组(P<0.05)。DQ-CON组HO1基因的相对表达丰度显著高于CON组(P<0.05),而 DQ-PIC组显著高于DQ-CON组(P<0.05)。DQ-CON组SOD2和GPx1基因的相对表达丰度显著低于CON组(P<0.05),而DQ-PIC组和DQ-CON组相比没有显著差异(P>0.05)。
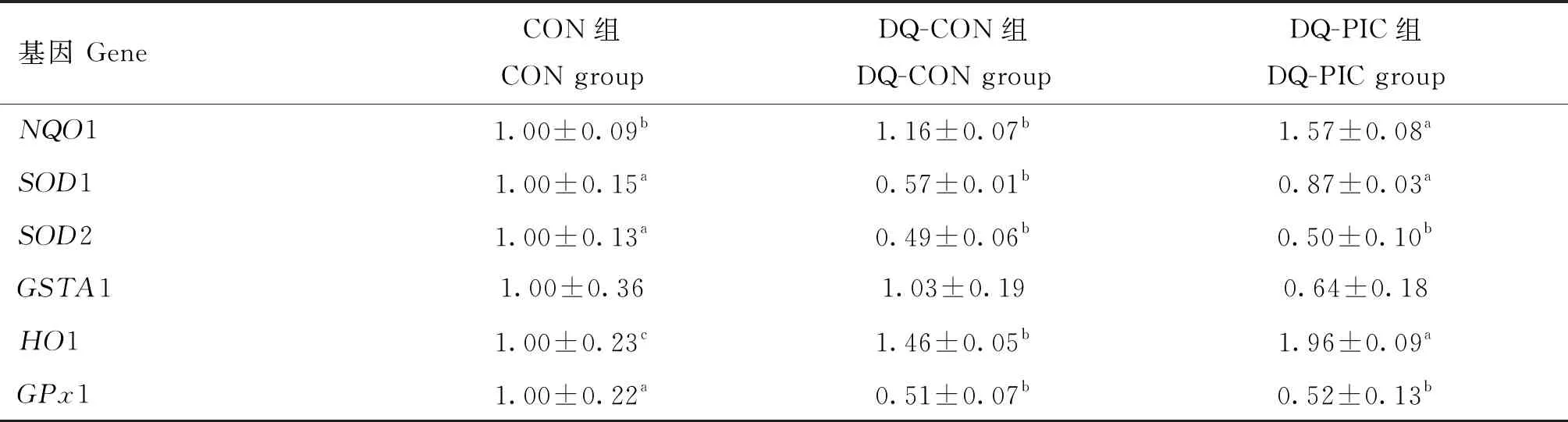
表5 PIC对氧化应激断奶仔猪空肠黏膜抗氧化相关基因相对丰度的影响
3 讨 论
植物多酚是一类广泛存在于植物体内的天然大分子化合物,因其丰富的来源和多样化的生物活性,近年来逐渐成为研究热点。PIC是一种具有良好抗氧化活性的天然植物多酚,存在于葡萄、甘蔗及大黄藓等多种植物中。PIC分子结构中的两个酚羟基和一个碳碳双键具有强还原性,可迅速清除细胞和组织中的ROS,降低氧化应激的发生风险[17-18]。DQ是一种常见的接触联吡啶基除草剂[19],能够利用分子氧产生超氧阴离子自由基,并与其他ROS共同诱导细胞线粒体损伤[20-22]。受损的线粒体会释放更多的ROS,继而引起机体氧化应激[23-25]。因此,DQ常用于建立啮齿动物与仔猪等动物氧化应激模型[26-28]。
在本试验中,DQ的注射引起了DQ-CON组断奶仔猪血清DAO含量显著升高,并且该组的空肠黏膜形态也受到了破坏,表现为绒毛高度和VH/CD的显著降低。小肠作为吸收营养物质的重要器官,其形态结构是动物机体进行正常生长发育的基础,而小肠绒毛高度,隐窝深度以及VH/CD则是衡量肠道形态结构的重要指标[29]。小肠绒毛上皮细胞负责吸收消化道内的氨基酸、无机盐、葡萄糖等营养物质,且绒毛高度与吸收能力成正相关,而VH/CD则综合反映了小肠形态结构的状态。同时,注射DQ后,DQ-CON组仔猪空肠黏膜中MDA含量显著升高,T-SOD、GPx和CAT等抗氧化酶的活性均受到了抑制。宋小珍等[30]研究发现,仔猪小肠上皮在氧化应激状态下产生大量的ROS,进而破坏体内抗氧化系统,导致抗氧化酶活的降低。王远孝等[31]研究则表明,氧化应激状态下仔猪小肠黏膜MDA含量上升,T-AOC下降。以上研究结果与本试验相似,而Maeda 等[32]研究也指出,肠道氧化应激会导致小肠细胞通透性增加以及形态结构受损,这表示,DQ使断奶仔猪空肠发生了氧化应激,降低了空肠抗氧化能力,从而导致了空肠黏膜形态结构受损,也表明了本试验中断奶仔猪氧化应激模型的成功建立。
PIC在本试验中显示出了促进肠道形态结构和屏障功能修复作用。本试验结果显示,PIC使氧化应激断奶仔猪空肠绒毛高度增加且VH/CD增加,这反映PIC促进了肠道形态结构的修复。屏障功能是小肠上皮细胞另一项重要功能,而紧密连接则是构成上皮细胞屏障功能的最主要结构,由OCLN等结构蛋白组成[33]。OCLN蛋白与细胞间通透性和移动性有关,其缺失会导致肠上皮细胞通透性增加,进而导致肠道屏障功能受损[34]。在本试验中,PIC促进了氧化应激仔猪空肠黏膜中OCLN蛋白的mRNA表达量,提示其促进了肠道屏障功能的恢复。而PIC对于空肠形态结构和屏障功能的修复作用可能是通过缓解肠道氧化应激来实现的。
PIC在本试验中显示出了缓解肠道氧化应激损伤的作用。作为天然的抗氧化剂,PIC能够有效地清除各种自由基。已有研究表明,PIC能高效地清除过氧化自由基[16,33],而李晓霞等[35]则报道,PIC具有较强的清除羟自由基的生物活性,这可能与PIC分子结构中的4个酚羟基有关。PIC也可以刺激动物机体抗氧化系统,提高抗氧化水平,从而降低氧化应激损伤。本试验结果显示,PIC使断奶仔猪空肠黏膜中T-SOD、GPx和CAT的酶活升高,并且上调了NQO1、SOD1和HO1的基因相对表达量,进而降低了MDA的含量,缓解了氧化应激损伤。SOD是一类重要的解毒酶,包括SOD1和SOD2,它们存在于所有能够进行氧化还原过程的生物中,以谷胱甘肽(GSH)作为反应底物,与GPx和CAT一起清除机体产生的ROS[36-37]。MDA是自由基直接进攻生物膜脂质部分而产生的一种脂质过氧化物,也是反应机体氧化应激程度的一项重要指标[38]。Zhang等[39]发现,PIC能显著降低老年大鼠海马皮质组织中的MDA含量,增加SOD和CAT的酶活。Lu等[8]的研究结果显示,PIC能够促进Nrf2的核移位,进而上调其下游HO1和NQO1抗氧化基因的表达,提高ARPE-19细胞的抗氧化能力。Jeong等[40]则发现,PIC发挥其抗氧化作用是通过促进HO1基因的表达来实现的,沉默HO1基因以后,PIC的抗氧化作用就消失了。以上研究结果均与本试验结果相似,PIC提高了抗氧化酶活,上调了抗氧化相关基因的表达,从而降低了MDA含量,缓解了氧化应激损伤。据此推测,PIC在生物体内的抗氧化作用一方面通过直接清除自由基来完成,另一方面则是借助Nrf2/HO1抗氧化信号通路刺激细胞或生物体的抗氧化系统来完成,但其具体机制还有待进一步探究。
4 结 论
本研究中,腹腔注射10 mg·kg-1DQ成功引起了断奶仔猪空肠氧化损伤,进而影响了空肠黏膜形态和屏障功能。而断奶仔猪灌喂80 mg·kg-1PIC能够有效缓解敌草快诱导的空肠氧化损伤,改善黏膜形态,促进屏障功能的恢复。
