羊蜱蝇携带巴尔通体和斑点热群立克次体PCR检测及遗传关系分析
2021-06-30袁东波阳爱国郝力力
向 阳,袁东波,侯 巍,莫 茜,尹 杰,阳爱国,郝力力*
(1. 西南民族大学畜牧兽医学院,成都 610041; 2. 四川省动物疫病预防控制中心,成都 610041)
羊蜱蝇(Melophagusovinus),属昆虫纲(Insecta)、双翅目(Diptera)、虱蝇科(Hippoboscidae)、蜱蝇属(Melophagus)[1]。羊蜱蝇是一种以吸食宿主血液为生的体外寄生虫,除热带地区外,广泛分布于世界各地。羊蜱蝇通常寄生在绵羊体表,有报道称羊蜱蝇的宿主范围有扩大趋势,可寄生于人类以及更广泛的家畜(绵羊、藏绵羊、山羊和犬),野生动物(欧洲野牛、藏羚羊、野兔和红狐)[2-3]。藏绵羊感染羊蜱蝇后,一方面,降低生产性能;另一方面,作为传播媒介可储存或传播巴尔通体、立克次体、蓝舌病病毒、绵羊无浆体、锥虫等病原[4]。近年来国内仅在甘肃、新疆、辽宁、青海和西藏部分地区有少量报道[5]。
巴尔通体(Bartonella)是一类兼性胞内寄生的多形态革兰阴性菌,可感染人、牛、羊、鼠等多种哺乳动物,世界各地均有分布。巴尔通体病作为新发人畜共患病,已被列入国家新发传染病目录。巴尔通体主要寄生于动物的上皮细胞和红细胞中,可经跳蚤、蜱虫、白蛉、羊蜱蝇等吸血昆虫传播[6]。斑点热群立克次体(spotted fever group rickettsiae,SFGR)是一类专性胞内寄生的多形态革兰阴性菌,可经蜱虫、螨虫、跳蚤等吸血昆虫传播,世界各地均有分布[7]。目前,已证实自然界存在15种以上的巴尔通体和16种以上的斑点热群立克次体对人有致病性,包括Bartonellamelophagi、B.henselae、B.elizabethae和B.rochalima[6],Rickettsiaraoultii、R.slovaca、R.felis、R.aeschlimannii和R.massiliae[8]等,这些病原具有重要的公共卫生学意义。本教研室前期曾就石渠县牦牛源蜱感染巴尔通体和斑点热群立克次体开展分子流行病学调查,但未对石渠县羊蜱蝇是否也携带这2类病原进行调查[9-10]。因此,本研究以石渠县藏绵羊体表寄生的羊蜱蝇为研究对象开展调查,以期进一步掌握巴尔通体和斑点热群立克次体感染情况,为当地人兽共患病的防控提供数据支持。
1 材料与方法
1.1 材料
1.1.1 羊蜱蝇采集 2018年6—8月,分别在四川省石渠县阿日扎镇、呷衣乡、新荣乡和长沙贡马乡4个乡镇的96只藏绵羊体表采集羊蜱蝇,样本采集点见图1。分别从21、25、25、25只藏绵羊体表采集到羊蜱蝇96、87、121、103只,共计407只,按照地点分别装入收集管,塞入潮湿脱脂棉。将虫体送至西南民族大学畜牧兽医学院动物寄生虫教研室,浸于75%乙醇溶液后置4 ℃冰箱内保存待用。
图1 石渠县样本采集点位置
1.1.2 主要试剂 组织基因组DNA提取试剂盒(EasyPure Genomic DNA Kit)、1 (TAE溶液、2 (Easy Taq PCR SuperMix、核酸染色剂、琼脂糖和DNA Marker均购自北京全式金生物技术有限公司;巴尔通体阳性对照(B.melophagi)和斑点热群立克次体阳性对照(R.slovaca)由西南民族大学畜牧兽医学院动物寄生虫教研室保存,引物合成及测序均由生工生物工程(成都)有限公司完成。
1.1.3 主要仪器 体视显微镜(Leica S9D),多功能生物样品均质器(Bertin Precellys 24),台式高速离心机(Eppendorf 5402型),Bio-Rad伯乐梯度PCR扩增仪(RTC240型),电泳仪(DYY-6C型),全自动数码凝胶图像分析系统(Tanon-5200 Multi)。
1.2 方法
1.2.1 形态学观察 根据《中国经济昆虫志》(第三十九册)[11]及《中国畜禽寄生虫形态分类图谱》[12],在体视显微镜下观察羊蜱蝇形态学特征并拍照。
1.2.2 DNA提取 将羊蜱蝇从75%乙醇溶液中取出,无菌水冲洗3次。无菌滤纸吸干,沿纵向中轴线对剖,分别装入EP管。取半只加入500 μL无菌水,置于Bertin Precellys 24研磨器进行充分研磨,参数设置如下:每管加入陶瓷珠(直径0.5 mm的20珠、直径2 mm的5珠),5 500 g研磨2次;4 000 g 研磨1次。取研磨液200 μL,根据组织基因组DNA提取试剂盒(EasyPure Genomic DNA Kit)使用说明书提取DNA,-20 ℃保存备用。另外半只置-80 ℃冰箱冻存。
1.2.3 PCR扩增 巴尔通体和斑点热群立克次体的分子鉴定分别采用Norman[13]、Paziewska[14]、Oteo[15]、Fernndez[16]等报道的方法,引物信息见表1。4对引物扩增的总体系均为25 μL:模板1 μL(2~3 ng), 上下游引物各1 μL(10 μmol·L-1),PCR Supermix 12.5 μL,ddH2O 9.5 μL。每个PCR反应均设置1个阳性对照(B.melophagi或R.slovaca)和1个阴性对照(ddH2O)。PCR的反应程序:92 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,40个循环;72 ℃最后延伸7 min。 取2 μL PCR扩增产物于1.2%琼脂糖凝胶中100 V电泳30 min,所得PCR阳性产物送至生工生物工程(成都)有限公司进行测序。

表1 巴尔通体和立克次体PCR引物信息
1.2.4 序列分析及统计分析 将所得序列用DNA Star V.7.1.0进行拼接与分析,在NCBI中使用BLAST对序列进行比对,再应用MEGA 6. 0软件以邻接法(bootstrap值为1 000)构建系统进化树,并以Kimura 2-parameter模型计算序列间的遗传距离。采用SPSS 20. 0(皮尔森卡方检验)比较不同采样地点巴尔通体和立克次体感染率的差异,P≤0.05为差异显著。
2 结 果
2.1 羊蜱蝇采集数量及形态观察
在阿日扎镇,86只藏绵羊中有21只感染了羊蜱蝇;在呷衣乡,60只藏绵羊中有25只被感染;在新荣乡,98只藏绵羊中有25只被感染;在长沙贡马乡,137只藏绵羊中有25只被感染。在4个采样点96只藏绵羊体表共采集到羊蜱蝇成虫407只,未采集到羊蜱蝇蛹及幼虫。羊蜱蝇的形态特征如图2所示。

A. 雌性羊蜱蝇背面;B. 雌性羊蜱蝇腹面;C. 雄性羊蜱蝇背面;D. 雄性羊蜱蝇腹面
2.2 巴尔通体gltA、rpoB基因的PCR扩增
以“1.2.2”中提取的羊蜱蝇组织DNA为模板,分别扩增巴尔通体gltA、rpoB基因片段,长沙贡马乡部分样本电泳如图3所示,片段大小分别约356、379 bp,与预期相符。
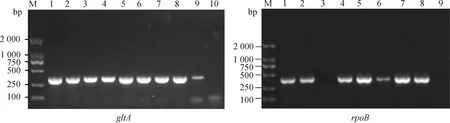
M. DL2000 DNA相对分子质量标准;1. 阳性对照;2~9(左图)、2~8(右图). 羊蜱蝇样本;10(左图)、9(右图). 阴性对照
2.3 巴尔通体gltA、rpoB基因的遗传进化分析
所有的巴尔通体阳性产物均进行了测序,使用DNA STAR软件将所得巴尔通体gltA基因和rpoB基因序列进行拼接、两两比对后得到1条gltA和5条rpoB的unique序列,分别上传GenBank,得到对应序列号(gltA:MN644897;rpoB:MN644898~MN644902)。分别选取不同种的巴尔通体和BLAST比对后相似性最高的gltA基因和rpoB基因序列等作为参考序列,构建进化树。如图4所示,从羊蜱蝇中检测到的MN644897与美国内华达州分离到的B.melophagi(AY724768)聚为1支,亲缘关系最近,相似性为100.0%。从羊蜱蝇中检测出的5条unique序列(MN644898~MN644902)与分离自美国西南部的B.melophagi(EF605288)聚为1支,相似性为98.8%~100.0%。参照La Scola等[17]建立的巴尔通体判定标准(gltA≥ 96.0%、rpoB≥ 95.4%),本研究仅检出了B.melophagi。见表2。

图4 基于gltA (A)、rpoB (B) 基因巴尔通体系统进化树
2.4 立克次体OmpA、OmpB基因的PCR扩增
以“1.2.2”中提取的羊蜱蝇组织DNA为模板,分别扩增立克次体OmpA、OmpB基因片段,长沙贡马乡部分样本电泳如图5所示,片段大小分别约530、618 bp,与预期相符。
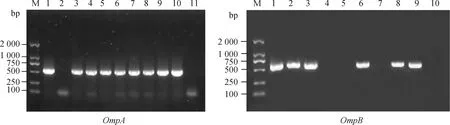
M. DL2000 DNA相对分子质量标准;1. 阳性对照;2~10(左图)、2~9(右图). 羊蜱蝇样本;11(左图)、10(右图). 阴性对照
2.5 立克次体OmpA、OmpB基因的遗传进化分析
所有的立克次体阳性产物均进行了测序,使用DNA STAR软件将所得立克次体OmpA基因和OmpB基因序列进行拼接、两两比对后得到4条OmpA和4条OmpB的unique序列,分别上传GenBank,得到对应序列号(OmpA:MN644903~MN644906;OmpB:MN644907~MN644910)。分别选取不同种的立克次体和BLAST比对后相似性最高的OmpA基因和OmpB基因序列等作为参考序列,构建进化树。如图6所示,OmpA基因序列分析表明序列MN644904~MN644906与R.raoultii(JQ792162和JQ792137)亲缘关系最近,相似性为99.8%~100.0%。MN644903与从韩国分离到的CandidatusR.longicornii(MG906676)以及从青海分离到的unculturedRickettsiasp.(MG228270)序列相似性分别为98.2%、100.0%。OmpB基因序列分析表明序列(MN644907~MN644908)与R.raoultii(DQ365798)序列相似性为99.3%~99.5%;序列(MN644909~MN644910)与从韩国分离的CandidatusR.longicornii(MG906675)具有99.5%~100.0%的相似性。

图6 基于OmpA (A)、OmpB (B) 基因立克次体系统进化树
2.6 巴尔通体、斑点热群立克次体的PCR检测
本试验中,首先使用gltA基因对羊蜱蝇携带的巴尔通体进行初筛,然后使用rpoB基因筛选gltA基因阳性样本。在407只羊蜱蝇中,有57只检出了巴尔通体,感染率为14.0%(57/407)。在本次调查的4个乡(镇)中,长沙贡马乡感染率最高,达16.5%,其余依次为新荣乡15.7%、阿日扎镇12.5%、呷衣乡10.3%。经χ2检验,不同乡(镇)之间羊蜱蝇携带巴尔通体的感染率差异不显著(P>0.05),见表2。
OmpA是斑点热群立克次体的特异性蛋白基因,参照Fournier等[18]建立的斑点热群立克次体判定标准,若检出OmpA即可直接判定为斑点热群立克次体,若未检出则需符合以下4项标准中的2项:OmpB相似性>85.8%、gltA相似性>92.7%、geneD相似性>82.2%、16S rRNA相似性>98.8%。该判定标准是本研究将OmpA、OmpB基因作为靶基因检测斑点热群立克次体的依据。调查结果显示本研究中R.raoultii的感染率为11.1%(45/407),见表2。在调查的4个乡镇中,在阿日扎镇、呷衣乡和长沙贡马乡均检出了R.raoultii,感染率分别为6.3%、16.1%和24.3%。结果显示,长沙贡马乡羊蜱蝇携带R.raoultii的感染率(表2中以“*”标记)显著高于阿日扎镇和呷衣乡羊蜱蝇携带R.raoultii的感染率(P<0.05)。Rickettsiasp.与CandidatusRickettsialongicornii亲缘关系密切,并仅在新荣乡的样本中检出,感染率为6.6%(8/121)。在本研究中,没有观察到B.melophagi、R.raoultii和Rickettsia.sp.混合感染。

表2 石渠县羊蜱蝇携带巴尔通体及斑点热群立克次体的感染率
3 讨 论
在本研究中使用rpoB和gltA基因对羊蜱蝇携带的巴尔通体进行了鉴定,首次在分子水平上证实了石渠县藏绵羊源羊蜱蝇存在B.melophagi感染。龙露等[19]对中国巴尔通体属系统发育多样性的分析结果显示中国至少存在包含B.melophagi在内的11个巴尔通体可感染人类。2007年,Bemis等[20]从美国商品化脱纤维羊血中检出了B.melophagi。2009年,Maggi等[21]从2名有动物接触史的病人的血液中分离出B.melophagi。近年来,在美国[22]、欧洲中部[23]和埃塞俄比亚[24]等国家和地区相继报道了从羊蜱蝇中检出B.melophagi。截至目前,尚未见石渠县有关B.melophagi在羊蜱蝇中的报道。本研究从石渠县的407个羊蜱蝇样本中共检出57例巴尔通体,阳性率为14.0%,经鉴定均为B.melophagi。本研究的检测结果低于周赛赛等[25]报道的西藏绵羊体表羊蜱蝇中B.melophagi的感染率(48.0%)、何波[26]报道的新疆及甘肃部分地区绵羊体表羊蜱蝇中B.melophagi的感染率(95.0%)和Liu等[5]报道的在南疆地区绵羊体表羊蜱蝇中B.melophagi的感染率(88.6%)。
巴尔通体具有不完全的宿主特异性,如B.elizabethae、B.vinsoniisubsp.Arupensis仅在啮齿类动物中被检出,B.vinsoniisubsp.Berkhoffii仅在犬科动物中被检出,B.alsatic仅在兔中被检出[27-29]。本研究从藏绵羊源羊蜱蝇中检出的巴尔通体经鉴定均为B.melophagi,未检出其他种的巴尔通体。2019年唐天才等[10]在石渠县牦牛源西藏革蜱和青海血蜱中也仅检出了B.melophagi;2019年赫秀甜等[30]在四川省松潘县牦牛源青海血蜱中同样也仅检出了B.melophagi,但在当地的高原鼠兔中检出了B.queenslandens、B.grahamii和Bartonellasp. 3种巴尔通体,未检出B.melophagi。这表明羊蜱蝇和蜱等吸血节肢动物可能是B.melophagi的最适宜宿主,而高原鼠兔等啮齿类动物可能并非是B.melophagi的最适宜宿主。
本研究首次在分子层面上证实了藏绵羊源羊蜱蝇携带R.raoultii。R.raoultii于1999年首次报道于前苏联,随后在蒙古国、德国、意大利等地相继报道[31],在中国,R.raoutlii-like bacteria首次被报道于西藏[32]。R.raoutlii已被证实可感染人:2002年,8名法国人感染R.raoutlii[7];2012年,在中国牡丹江从2名被蜱虫叮咬的患者的血液中检出了R.raoutlii[33];2015—2016年,内蒙古、河南和山东报道了26例人感染R.raoutlii的病例[34]。目前,R.raoultii主要是在蜱中被检出,常见于蜱虫中的钝眼蜱属、血蜱属、硬蜱属、革蜱属、扇头蜱属[35]。在本研究中,有3个乡的样本中检出了R.raoultii,感染率为6.3%~24.3%,显著低于本教研室报道的石渠县麻甲乡、德荣玛乡、阿日扎镇及长须干玛乡4个乡镇牦牛源蜱(西藏革蜱和青海血蜱)中R.raoutlii的感染率(42.8%~58.3%)[9]。这可能是因为相对羊蜱蝇而言,R.raoutlii更适合在蜱内生存。此外,本次调查的立克次体阳性样本中存在6.6%(8/121)的未定种立克次体,后期本教研室拟将对其进行培养,分离纯化后应用多位点序列分型(multilocus sequence typing,MLST)等方法,基于立克次体多个基因(17 kDa、rrs、OspA和groEL)在种的水平上做进一步鉴定。
在石渠县,羊蜱蝇可能在藏绵羊间B.melophagi和R.raoultii的传播过程中扮演了重要的角色。饲养方式粗放、牧民防护意识淡薄以及兽医专业人员缺乏等因素都可能是造成当地羊蜱蝇B.melophagi和R.raoultii高感染率的原因。因此,接下来拟开展进一步的研究,一是扩大调查范围和样本数量,二是密切关注当地牧民是否有发病的报道,以确定羊蜱蝇和藏绵羊在石渠县B.melophagi和R.raoultii传播中的确切作用。
3 结 论
石渠县4个乡镇共采集到羊蜱蝇成虫407只。4个乡镇的样品均检出了Bartonellamelophagi,(总感染率为14.0%);阿日扎镇、呷衣乡和长沙贡马乡检出了Rickettsiaraoultii(总感染率为11.1%);新荣乡检出了Rickettsiasp. (感染率为6.6%)。未发现混合感染。
