前列腺素D2与F2α对绵羊黄体退化的影响及其机理研究
2021-06-30邵焱焱赵宗胜朱梦婷王明远方晨辉谢梦婷江白慧
杨 恒,邵焱焱,赵宗胜*,朱梦婷, 3,南 颖,王明远,方晨辉,吴 培,谢梦婷,江白慧
(1. 西南大学动物医学院,重庆 402460; 2. 石河子大学动物科技学院,石河子 832000;3.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子 832000)
黄体(corpus luteum,CL)是母畜卵巢在生殖生理过程中的一个内分泌腺体,是建立和维持妊娠必需的内分泌器官[1]。在正常繁殖周期内,如果卵子受精,CL将分泌孕酮等来参与调节受精卵着床、胚胎发育及妊娠维持[2]。如果卵子未受精或处于妊娠末期(或分娩后),CL将会正常退化成为启动下一个生殖周期的前提[3]。因此,CL退化在哺乳动物的生殖周期中起着重要的“关卡”作用,对于重启母畜生殖功能的周期性变化具有重要的意义。
前列腺素(prostaglandins,PGs)是一组内源性的酸性脂质,广泛分布于哺乳动物体内,涉及大量的生殖过程[4-5]。大多数内源性PGs由花生四烯酸代谢衍生而来,当花生四烯酸通过磷脂酶A2从质膜释放时,环氧合酶(COX或PTGS)1和2会将花生四烯酸转化为PGH2;在特定酶的作用下,PGH2被选择性转化为相应的PGs,包括PGF2α、PGE2、PGD2、PGI2和TXA2[6-7]。其中,PGF2α被认为是母畜CL退化的主效溶解素,而PGE2则被认为是CL维持的重要保护介质[4,8]。通常在妊娠期间PGE2分泌水平较高,能够竞争性抑制PGH2向PGF2α的合成转化,从而降低PGF2α浓度,利于CL维持和胎儿发育;但在分娩启动后,随着胎儿保护机制的消失,CL维持则转而退化,PGE2合成下降,PGH2向PGF2α合成增加,从而促使产后或者空怀母体完成功能性(主要表现为P4下降)及结构性(主要表现为内皮细胞失去紧密的连接,黄体体积减少、完整性被破坏)的CL退化进程[9-10],继而开启新的生殖周期。但是,与PGs家族其他成员(如PGF2α、PGE1和PGE2)不同的是,PGD2在繁殖方面的相关调控作用并未引起人们足够的重视,其有关研究更是鲜有报道。
目前,大量研究证实,前列腺素家族的作用机制并不是某一种单一PGs成员的效应,而是多个PGs家族成员通过其相应受体的结合而共同发挥作用[11-12],因此,在子宫或卵巢黄体组织中不同的PGs成员之间可能会发生不同程度的协同作用或竞争性地拮抗效应。本研究选取哈萨克母羊为研究对象,探究PGD2与PGF2α在母体CL退化过程中可能存在的作用机制,为进一步优化母畜高效繁育技术、保障畜牧业的连续繁育生产提供新的理论依据。
1 材料与方法
1.1 试验动物及饲养管理
2020年5月份选择购置同一个养殖场16只健康的哈萨克母羊(年龄3~4岁,体重47 kg左右,无繁殖疾病且发情周期正常),将试验羊群饲养于石河子大学动物科技学院试验站。栏内散养,每天早上和下午饲喂,自主采食苜蓿干草,配置舔砖(防应激),自由饮水、自然光照,保证羊栏里干净无杂物、管理及环境条件一致。待其饲养14 d适应圈舍环境后,再进行试验。
1.2 主要试剂
PGD2与PGF2α兔源多克隆抗体,山羊抗兔IgG二抗均购自Abcam公司;PGF2α购自Macklin公司;绵羊孕酮(PROG)、雌激素(E2)、前列腺素F2α(PGF2α)和D2(PGD2)ELISA Kit均购自晶美生物工程有限公司;HE染色试剂盒、总RNA提取试剂盒、总蛋白提取试剂盒、SCA蛋白定量试剂盒、SDS-PAGE 试剂盒均购自Solarbio公司;HiFiScript cDNA Synthesis Kit购自北京康为世纪有限公司;TB Green Premix ExTaqⅡ(Tli RNaseH Plus)购自TaKaRa公司;蛋白Marker购自博奥森生物公司;PVDF膜购自ThermoFisher Scientific公司;ECL显色剂购自上海信裕生物科技有限公司。
1.3 试验方法
1.3.1 子宫肌内注射处理 采用阴道埋孕酮栓和肌内注射氯前列腺烯醇法使母羊同期发情。为消除同期发情对试验的影响,待其同期发情处理第2个发情周期的黄体期(前期课题组已对同一批40只哈萨克母羊进行了2个发情周期的观察,发现哈萨克母羊群体中发情行为呈现较为明显的周期性变化,其发情周期为18 d左右,发情持续时间为24~48 h,为本试验选择黄体期中期即发情周期第11天进行子宫肌内注射处理提供了保障)进行试验分组处理,采用微创手术在有中期黄体的一侧子宫小弯处进行肌内注射药物,并将试验分为4组,即分别为PGD2组(1 mg·mL-1,0.2 mL)、PGF2α组(1 mg·mL-1,0.2 mL)、 PGD2+PGF2α组(1 mg·mL-1,各0.2 mL)及生理盐水(0.2 mL,对照组),每组4个重复。
1.3.2 HE染色 子宫肌内注射48 h后(避免此时黄体组织发生生理性周期性退化)进行屠宰,立即采集子宫、卵巢(黄体)组织于-80 ℃保存、备用。采集的黄体用4%多聚甲醛直接固定,待包埋切片后,利用苏木素-伊红(HE)染色,直接观察黄体组织形态。
1.3.3 血液采集、处理与激素测定 子宫肌内注射处理到屠宰间隔48 h,每隔6 h(0、6、12、18、24、30、36、42和48 h)采集一次静脉血,每次5 mL,4 000 r·min-1离心10 min,分离血清后,做好标记保存于-20 ℃备用。利用酶联免疫测定(ELISA)试剂盒检测血清中的P4、E2、PGD2及PGF2α浓度,分析不同处理组中上述激素在体内的浓度变化。
1.3.4 qRT-PCR测定 参照总RNA提取试剂盒说明书提取子宫、黄体组织中总RNA,使用Nanodrop2000检测RNA的纯度及浓度。按照HiFiScript cDNA Synthesis Kit试剂盒说明书反转录成cDNA,使用Nanodrop2000检测cDNA的纯度及浓度,保存于-20 ℃。qRT-PCR检测7个引物(表1),由Sangon Biotech公司合成。按照TB Green Premix ExTaqⅡ(Tli RNaseH Plus)试剂盒说明书操作实施qRT-PCR检测:TB Green Premix ExTaqⅡ(Tli RNaseH Plus)(2×)10 μL,PCR Forward Primer(10 μmol·L-1)0.8 μL,PCR Reverse Primer(10 μmol·L-1)0.8 μL,ROX Reference Dye(50×)0.4 μL,DNA模板2 μL,灭菌水6 μL。PCR扩增程序为:95 ℃预变性30 s;2. 55个循环:95 ℃ 5 s,56 ℃ 30~34 s。

表1 引物序列信息
1.3.5 Western blot测定 不同组别的子宫、卵巢(黄体)组织置于液氮中研磨后,将碾碎的组织放入蛋白裂解液中裂解,离心后,提取总蛋白,并利用SCA蛋白浓度测定试剂盒检测蛋白浓度;各组提取等量蛋白后,加入5×蛋白上样缓冲液,高温变性;再制备12%分离胶和5%浓缩胶,加入样品和蛋白Marker进行SDS-PAGE,并将目的蛋白切胶转移至 PVDF 膜上,置于摇床室温清洗封闭,取出PVDF膜加入一抗,4 ℃摇床、孵育过夜;最后,PBST摇床洗涤,加入二抗,室温摇床孵育,再添加ECL显色剂对蛋白条带进行照相分析。
1.4 统计分析
实时荧光定量数据以2-ΔΔCt法处理,Western blot蛋白结果使用Image J软件分析灰度值,使用SPSS Statistics 19软件ANOVA比较基因、蛋白表达量差异,P<0.05被认为具有统计学意义。
2 结 果
2.1 处理前后黄体组织形态学观察
HE染色结合物理拍照对比不同组别处理前后黄体形态变化,结果如图1所示,各组之间的黄体组织结构形态均发生了不同程度的变化:1)PGD2组中,黄体体积未发生显著变化,但卵巢组织中出现多个卵泡,HE染色发现,黄体结构已发生空腔化并伴有CL结构退化的初期特征;2)PGF2α组中,黄体体积明显缩小,卵巢组织中出现单个较大卵泡,HE染色结果显示,黄体组织已发生显著结构性退化;3)与 前两组相比,PGD2+PGF2α组中,黄体体积缩小更为明显,同时,卵巢组织中出现多个较大卵泡,HE染色发现,黄体组织已基本退化完成,并出现多个活性卵泡;4)对照组中,黄体体积未发生明显变化,同时卵巢组织呈现静止状态(无活性卵泡),HE染色结果显示,黄体组织结构完整,并未发生CL退化现象。

A. PGD2组;B. PGF2α组;C. PGD2+PGF2α组;D. 对照组;黑细箭头指示黄体结构,黑粗箭头指示卵泡
2.2 不同组别中激素水平的变化
2.2.1 不同组别P4水平的变化 使用ELISA法检测血清中P4水平,结果如图2所示。PGD2组P4浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-0.212 5,在PGD2处理后24 h出现明显的单峰,峰值为8.65 ng·mL-1;PGF2α组P4浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-0.222 1,在PGF2α处理后30 h出现明显的单峰,峰值为8.37 ng·mL-1;PGD2+PGF2α组中P4浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-0.349,在PGD2结合PGF2α处理后6和36 h出现明显的双峰,峰值分别为10.69和8.70 ng·mL-1; 对照组中P4浓度随时间变化不显著(P>0.05),趋势线斜率为0.021 5,在生理盐水处理后24 h出现不明显波动性变化。此外,通过组间P4激素变化趋势对比分析,发现对照组与上述3个试验组之间均存在极显著性差异(P<0.01)。
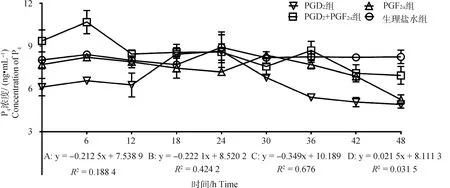
A. PGD2组;B. PGF2α组;C. PGD2+PGF2α组;D. 对照组。下同
2.2.2 不同组别E2水平的变化 结果如图3所示,PGD2组E2浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-0.953 9,在PGD2处理后24 h 出现不明显的单峰,峰值为211.35 pg·mL-1;PGF2α组E2浓度随时间变化呈显著上升趋势(P<0.05),趋势线斜率为4.538 3,在PGF2α处理后12和36 h出现明显的双峰,峰值分别为252.44和282.26 pg·mL-1;PGD2+PGF2α组中E2浓度随时间变化呈显著上升趋势(P<0.05),趋势线斜率为0.527 7,但在PGD2结合PGF2α处理后18 h出现明显的单峰,峰值为274.82 pg·mL-1;对照组中E2浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-1.556 3,处理后48 h内未出现明显的波动性变化。此外,通过组间E2激素变化趋势对比分析,发现对照组与上述3个试验组之间均存在显著性差异(P<0.05)。

图3 各组母羊血清中E2浓度变化
2.2.3 不同组别PGD2水平的变化 结果如图4所示,PGD2组PGD2浓度随时间变化呈显著上升趋势(P<0.05),趋势线斜率为2.576 1,在PGD2处理后24和36 h出现明显的双峰,峰值为77.78和101.94 pg·mL-1;PGF2α组PGD2浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-1.240 4,在PGF2α处理后6 h出现明显的单峰,峰值为83.82 pg·mL-1;PGD2+PGF2α组中PGD2浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-0.841 3,在PGD2结合PGF2α处理后6和24 h出现不明显的双峰,峰值分别为92.34和92.38 pg·mL-1;对照组中PGD2浓度随时间变化呈显著上升趋势(P<0.05), 趋势线斜率为1.204 5,处理后48 h内未出现明显的峰值。此外,通过组间PGD2激素变化趋势对比分析,发现对照组与上述3个试验组之间均存在显著性差异(P<0.05)。
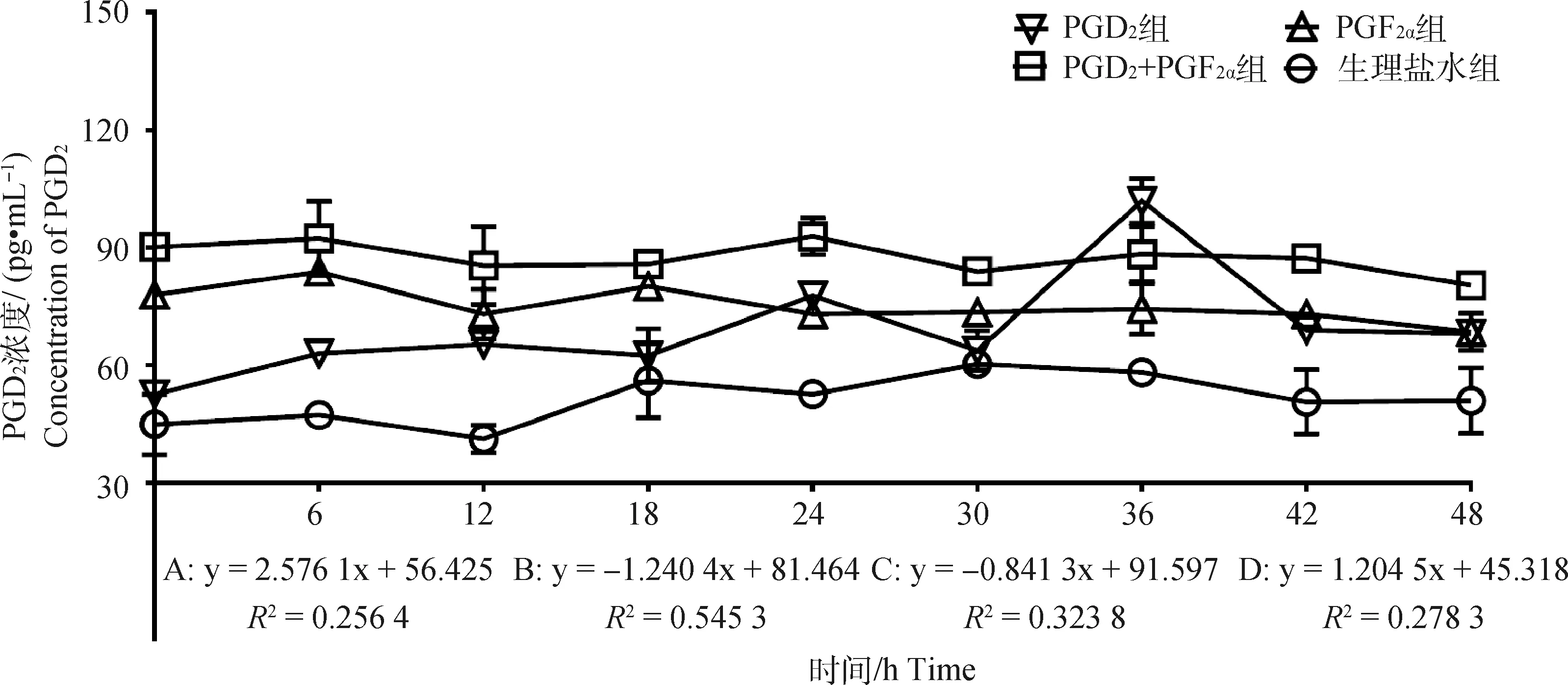
图4 各组母羊血清中PGD2浓度变化
2.2.4 不同组别PGF2α水平的变化 结果如图5所示,PGD2组PGF2α浓度随时间变化呈不显著下降趋势(P>0.05),趋势线斜率为-0.000 8,在PGD2处理后24 h出现明显的单峰,峰值为33.50 pg·mL-1;PGF2α组PGF2α浓度随时间变化呈不显著上升趋势(P>0.05),趋势线斜率为0.046,在PGF2α处理后6和18 h出现明显的双峰,峰值为34.07和33.03 pg·mL-1;PGD2+PGF2α组中PGF2α浓度随时间变化呈显著下降趋势(P<0.05),趋势线斜率为-0.456 4,在PGD2结合PGF2α处理后18 h出现明显单峰、峰值为34.79 pg·mL-1,36 h出现明显谷峰,谷值为24.95 pg·mL-1;对照组PGF2α浓度随时间变化呈不显著上升趋势(P>0.05),趋势线斜率为0.026 2,在处理后24 h出现明显的谷峰,谷值为24.42 pg·mL-1。此外,通过组间PGF2α激素变化趋势对比分析,发现对照组与上述3个试验组之间均存在显著性差异(P<0.05)。
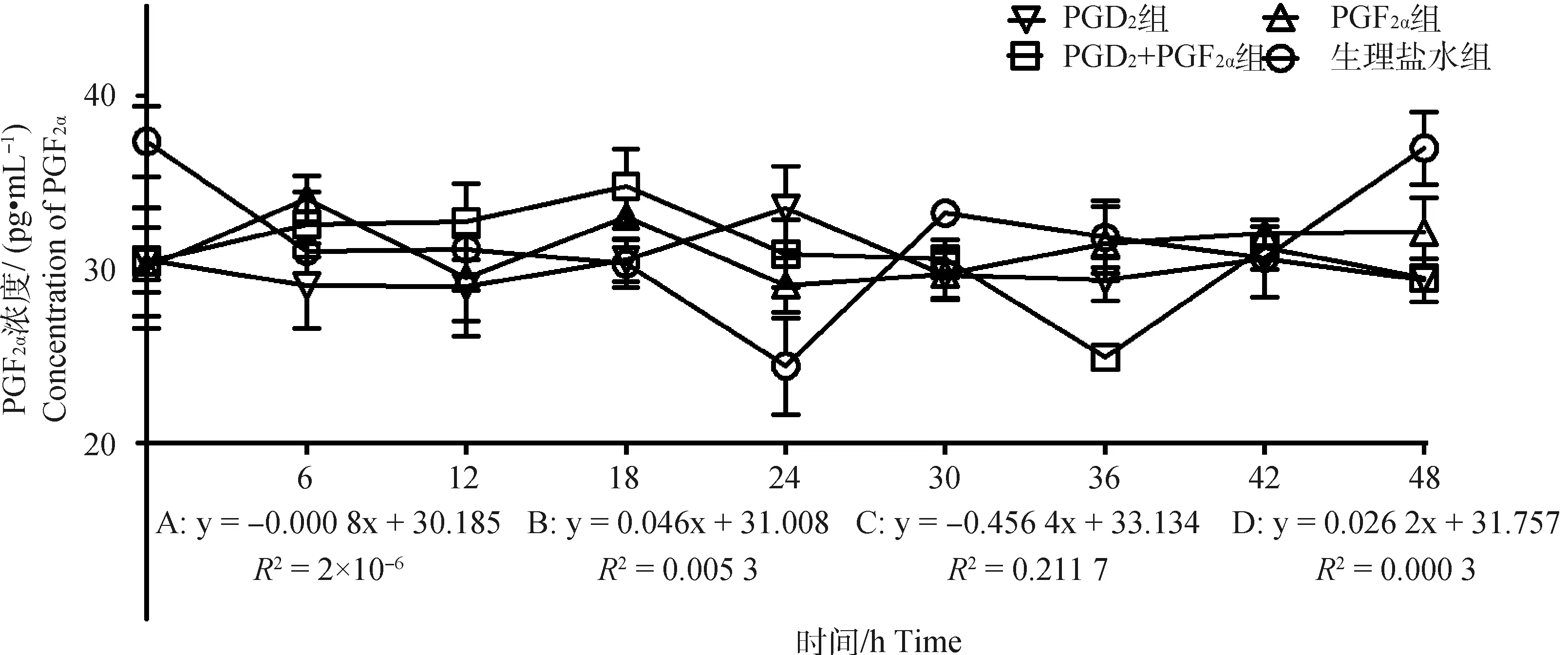
图5 各组母羊血清中PGF2α浓度变化
2.3 不同方案处理前后PGs关键合成酶表达量
不同方案处理后48 h分别提取总RNA和蛋白,进行qRT-PCR和Western blot检测子宫端PGs的关键合成酶表达水平。结果如图6所示,与对照组相比,PGD2组HPGDS mRNA和蛋白表达量显著上调(P<0.05),PGF2α组和PGD2+PGF2α组HPGDS mRNA和蛋白表达量显著下调(P<0.05);而PGFS mRNA和蛋白表达量在上述3个试验组中均呈显著性上调表达(P<0.05)。

图6 PGD2和 PGF2α关键合成酶mRNA(A)和蛋白相对表达量(B和C)
2.4 不同方案处理前后PGs受体表达量
不同方案处理后48 h分别提取总RNA和蛋白,qRT-PCR和Western blot检测黄体端PGs的受体表达水平。结果如图7所示,与对照组相比,PGD2组、PGF2α组中DP1 mRNA和蛋白表达量显著上调(P<0.05),PGD2+PGF2α组中DP1 mRNA和蛋白表达量呈不显著上调(P>0.05);类似地,PGF2α组、PGD2+PGF2α组中CRTH2 mRNA和蛋白表达量显著上调(P<0.05),PGD2组中CRTH2 mRNA和蛋白表达量呈不显著上调(P>0.05);而FP mRNA和蛋白表达量在上述3个试验组中均呈显著性上调表达(P<0.05)。同时,通过组间的数据对比发现,PGD2单独使用对DP1受体的影响呈最大促进效应,PGF2α单独使用时,对CRTH2受体的影响呈最大促进效应,PGD2+PGF2α结合使用时,对FP受体的影响呈最大促进效应。此外,PGD2两种类型受体的表达中,发现PGD2组中DP1表达量显著高于CRTH2(P<0.05),而PGF2α组中CRTH2表达量显著高于DP1(P<0.05)。

图7 PGD2和PGF2α不同受体mRNA(A)和蛋白(B和C)相对表达量变化
3 讨 论
CL是哺乳动物卵泡排空后形成的一个暂时的内分泌腺体,是建立和维持妊娠的必需内分泌器官。正常繁殖周期中,哺乳动物的CL必须有规律地退化,才能保证生殖活动的正常进行。目前,普遍认为PGF2α是引起CL退化关键因素[9,13],PGE2是CL维持的重要保护介质[11,14]。妊娠CL维持期间,PGE2合成酶会竞争性抑制PGH2向PGF2α的合成转化,降低体内PGF2α浓度,利于CL维持[15-16];但在CL启动退化机制后,PGE2合成的竞争性抑制效应减弱,体内PGF2α的合成增加,从而加速CL退化的进程[17-18]。因此,不难发现,PGF2α和PGE2在CL维持与退化过程中存在竞争性拮抗效应,这为本试验开展PGD2在CL退化过程中的作用机制研究提供了重要参考。
目前,大量研究显示,PGs对CL组织的调控取决于每个PGs成员之间形成的叠加效应[12,15-17]。本研究通过HE染色结合物理拍照对比不同方案处理前后CL组织形态学变化,发现PGD2与PGF2α对母羊CL组织的作用效应一致,均能够促进CL组织的退化;但其效果呈现明显的差异,即PGF2α组>PGD2组,说明单独使用PGD2时并不能够有效的促进CL的退化。然而,PGD2不同于PGE2,它能够协同PGF2α共同促进CL的退化,其效果明显优于前两者单独使用的退化效果,这一结论与邵焱焱等[19]在黄体化细胞中分别添加PGD2、PGF2α及PGD2+PGF2α观察CL细胞退化结论一致,这提示,在CL维持与退化过程中,PGD2与PGF2α之间可能存在协同效应,而不同于PGE2与PGF2α之间的拮抗效应。
CL作为母体合成和释放孕激素的重要内分泌器官,其结构或功能的改变直接或间接地影响着机体卵巢-子宫轴内分泌功能的变化[20-21]。本研究通过检测外周血P4分泌水平发现,3个试验组P4浓度随时间变化均呈现下降趋势,其下降程度分别为PGD2+PGF2α组>PGF2α组>PGD2组。这一结果与上述形态学观察结果一致,提示PGD2与PGF2α单独使用或联合使用均能够引起CL发生功能性退化。但是,由于PGs作用于CL组织存在一定的时效性,导致不同组别中CL功能性退化时间出现差异,效果也不相同[22-24]。本研究发现,PGD2组中P4浓度曲线峰值出现的时间(24 h),比PGF2α组提前6 h, 这可能是由于PGD2舒张了子宫-卵巢轴血管丛系统(UOP)血管,导致其血流加大、速度加快,使其PGs(内源性PGF2α和外源性PGD2)被迅速转运至黄体组织而发挥生物学效应[25-26];但是这种退化机制效应没有PGF2α强烈。不过,与对照组和上述试验组相比,PGD2结合PGF2α使用时,P4浓度曲线呈现双峰状态,峰值出现在6和36 h,说明二者结合使用能够更早地启动CL的功能性退化。P4和E2作为CL组织自分泌或旁分泌的调节剂[27],在CL退化过程中P4浓度的降低会导致LH搏动性增加,从而加快发育中卵泡的生长速率和E2生成水平[28]。这一结果与本研究中PGD2+PGF2α组和PGF2α组的结果相吻合,即在CL退化机制启动后,卵巢卵泡的抑制效应被解除,从而导致E2浓度升高[29-30]。但是,值得注意的是,PGD2+PGF2α组中E2浓度曲线单峰最大值出现的时间明显早于PGF2α组,这与本研究中P4浓度曲线变化趋势相吻合。但与前者不同,PGD2单独使用时,E2水平却呈现明显下降趋势,这一现象也与Farhat等[31]发现的PGD2能够调节卵巢颗粒细胞增殖、促进E2的分泌结果相悖;推测产生这种差异的主要原因,可能是相较于卵泡结构,PGD2更倾向于优先靶向CL组织,以参与其维持与退化过程的调节;但其具体机制仍有待于进一步研究。
CL退化过程中,不同PGs家族成员之间既相互制约、又相互促进。本研究通过ELISA法检测外周血液PGD2和PGF2α浓度发现,在PGD2组中,PGD2在处理后24和36 h出现明显的双峰,而PGF2α浓度则仅在处理后24 h出现一个明显的单峰,提示在24 h出现的CL功能性退化很可能是由于“外源PGD2+内源性PGF2α”分泌的短暂增加所致[32-33]。但与前者不同,PGF2α单独使用或联合PGD2使用时,发现PGD2浓度呈现下降趋势,说明在此时PGF2α能够抑制内源性PGD2的生成,从而导致体内PGD2浓度下降[34]。与PGD2类似,在本研究中PGD2+PGF2α组中PGF2α浓度也呈下降趋势;但产生这一下降趋势的原因与PGD2不同,在PGD2+PGF2α组中很可能是由于超生理浓度的PGD2较大程度地舒张了UOP血管[25-26],导致大部分外源和内源性PGF2α能够及时地被转运至CL组织发挥生物学效应而产生损失。这一趋势结果与HE观察结果相一致,说明当PGD2和PGF2α联合使用时,PGD2很可能发挥着双重调控作用:即一方面促进内源性PGF2α的产生、延长其衰减时长,另一方面促进UOP血管舒张、增加外源性PGF2α的有效利用,从而呈现了明显的优于单独注射PGF2α时CL退化效果。
PGs属于类二十烷酸的多不饱和脂肪酸的衍生物,它们是由特定的PGs关键合酶催化反应产生。其中,PGD2关键合成酶是HPGDS,PGF2α关键合成酶是PGFS。本研究通过检测HPGDS和PGFS的表达水平发现,无论是单独使用还是结合注射外源性PGF2α,子宫端HPGDS的表达均呈显著性下调,提示当体内PGF2α浓度升高时能够明显地抑制其内源性PGD2的合成,从而引起外周PGD2浓度的下降;这一结论与ELISA检测PGD2的结果相吻合。但与前者不同,PGD2单独或联合PGF2α使用时,子宫端PGFS的表达呈显著性上调,说明当体内PGD2浓度增加时能够明显促进其内源性PGF2α的合成,从而导致机体CL退化呈现最大化。造成这一现象的原因很可能与体内E2含量变化有关,即E2处于低水平时,能够促进PGD2的合成,而当E2水平升高时,则促进PGF2α的合成;Chaud 等[35]、Acosta等[36]和Hayashi[37]的研究也证实了这一观点。同时,依据不同的受体类型,PGs在靶标组织中发挥着不同的生物学效应。本研究发现,PGD2或PGF2α单独使用时,主要影响PGD2受体(DP1和CRTH2)的表达,即PGD2促进DP1受体的高表达,而PGF2α则促进CRTH2受体的高表达。但两者不同的是,当PGD2浓度升高时,PGD2主要是通过结合DP1受体扩张UOP血管[38-39],以加速内源性PGF2α向CL组织的转运,促进CL退化;而当PGD2浓度较低时,PGD2则主要是通过结合CRTH2受体开启CL细胞的凋亡过程[40],以“外源性PGF2α促进+内源性PGD2启动凋亡”的机制形式,双重促进CL退化,这一观点也在本研究中HE染色与形态学观察结果中得到验证。此外,当PGD2结合PGF2α使用时,发现二者对PGF2α受体(FP)的作用呈最大促进效应,且此时DP1和CRTH2受体也均呈较高水平,说明PGD2结合PGF2α使用时之所以能够表现出最佳的CL退化效果,很可能是开启了两种机制:即一是促进主效激素PGF2α的合成与受体的表达,二是提高PGD2受体DP1和CRTH2受体的均衡表达,最终以“PGF2α+PGD2”协同作用于CL退化过程。
4 结 论
本研究发现,PGD2无论单独使用或结合PGF2α使用,均呈现促进CL退化的效应。但单独使用时,其促进CL退化效果不明显,而当其与主效促溶素PGF2α联合使用时,呈现出最佳的促进CL退化效果,这为全面探析CL退化机制以及进一步优化哺乳动物高效繁殖技术(尤其是PGs方案)提供了新的参考依据。
