供体牛外周血AMH浓度对荷斯坦青年奶牛体内胚胎生产效率的影响
2021-06-30李树静冯春涛胡智辉朱化彬余文莉赵善江
李树静,冯春涛,胡智辉,朱化彬,余文莉* ,赵善江*
(1.石家庄天泉良种奶牛有限公司,石家庄 050299; 2. 中国农业科学院北京畜牧兽医研究所,农业农村部动物遗传育种与繁殖(家禽)重点实验室,北京 100193)
母牛发情周期中卵巢卵泡发育数量及质量直接决定着其繁殖性能[1-2],正常生理状态下,卵泡发育、成熟和排卵不仅受下丘脑-垂体-卵巢生殖轴的激素调节[3-5],而且还受抗缪勒管激素(anti-Müllerian hormone,AMH)等卵巢自身分泌激素的调节[6]。AMH是由卵巢早期有腔卵泡的颗粒细胞合成分泌的一种糖蛋白激素,属于转化生长因子β(transforming growth factor-β, TGF-β)超家族的一员,AMH合成后释放进入卵泡液和外周血,可以通过放射免疫或者酶联免疫吸附法(ELISA)等方法从血样中检测出来[6]。多项研究发现,AMH与卵巢储备和发育潜能关系密切,外周血中AMH浓度可以较为准确地反映卵巢上发育的有腔卵泡数量(antral follicle count, AFC)和质量[6-9],并对动物超数排卵(超排)的效果有直接影响[6, 10-11]。
AMH水平下降与多个物种雌性动物的生殖力下降相关,因而,血液中AMH浓度高低可作为母牛繁殖性能高低的内分泌标记物[12-13]。目前,在人的辅助生殖中,AMH已经比较广泛地用于预测女性卵巢储备和激素处理下卵巢产生可用卵子的可能性。同样,牛AMH水平也可以用于选择繁殖力或者人工授精受胎率高的奶牛或肉牛,作为超数排卵-胚胎移植(multiple ovulation and embryo transfer,MOET)筛选供体牛的一个高效标志分子,可以帮助选择能够提供更多可移植胚胎的供体母牛,以增加体内胚胎生产的效率。
当前,MOET技术已经在全球商业化应用,成为牛新品种培育和快速扩繁的重要技术手段[14-15]。然而在过去的30年里,通过超数排卵供体牛生产的可用胚胎数量一直没有得到显著的提高[16-17],而这其中不同供体牛卵巢对外源促性腺激素处理的反应不稳定可能是导致体内胚胎生产效率低的重要原因之一[18]。因此,近年来,从事胚胎生产的研究人员一直在致力于寻找可预测供体母牛超排反应效果、胚胎生产数量的分子标记物,以用于预测和筛选超排反应良好的供体牛,从而获得更多的可用胚胎[19-21]。研究表明,供体牛血清中AMH浓度与超排后获得胚胎数量相关性高[22-24]。但是国内关于供体牛外周血AMH浓度与体内胚胎生产效率的研究较少,尤其是对超排处理过程不同时间点供体牛外周血AMH浓度与供体牛MOET获得胚胎数量相关性的研究少,仅见薛建华等[25]研究的供体牛血液中AMH浓度对荷斯坦供体牛可获得胚胎数的影响,毕江华等[26]等研究的重复超排过程中血液AMH浓度对超排效果的影响,但是上述研究的研究内容较为单一,且AMH采样时间点单一,部分研究的试验动物头数也较少。
本试验分别采集CIDR埋置、人工授精和胚胎回收3个时间点的外周血,研究体内胚胎实际生产过程中不同时间点供体牛外周血AMH浓度与体内胚胎生产效率的相关性,以期为供体牛的高效筛选提供一定的应用参考。
1 材料与方法
1.1 试验动物
供体母牛为营养状况良好、发情周期正常、14~16月龄的96头荷斯坦青年牛,试验地点为石家庄天泉良种奶牛有限公司,时间为2019年7~9月。
1.2 试验试剂
促卵泡激素(FSH,Folltropin-V, 稀释后20 mL·瓶-1, 含NIH-FSH-P1 20 mg· mL-1,Bioniche公司生产)、孕酮阴道栓 (CIDR,1.56 g孕酮·支-1,Vetoquinol公司生产)、氯前列腺稀醇(PG,0.322 mg·mL-1,齐鲁动物保健品公司生产),保存液、冲胚液均由Bioniche公司生产;AMH检测试剂盒(Beckman)。
1.3 试验设计
根据供体牛的选择标准,挑选符合条件的健康供体母牛。分别采集供体牛胚胎生产过程中CIDR埋置、人工输精以及胚胎回收当天的外周血,检测AMH浓度的同时测量记录供体牛体重,分别将不同时期的AMH浓度和体重按照高(分布最高的25%)、中等(分布中间的25%~75%)、低(分布最低的25%)分为3组。
1.3.1 超数排卵 供体母牛超排处理时间和操作见图1。试验采用连续4 d 递减注射FSH方法超排处理供体牛,1瓶FSH(400 mg)用20 mL无菌超纯水稀释为20 mg· mL-1。具体操作:供体牛埋置CIDR的同时肌肉注射10 mL 维生素ADE(埋植当天计为第0天),埋置CIDR后第5 天开始超数排卵处理,每天07:00、19:00 分2次肌肉注射FSH(第5天:3 mL·头-1×2次;第6 天:2 mL·头-1×2次;第7天:1 mL·头-1×2次;第8 天:0.5 mL·头-1×2次); 第7天两次肌肉注射FSH同时注射两次PG(0.6 mg·头-1)并撤出CIDR;第9天全天人工观察发情,站立接受爬跨后10~12 h进行人工授精(未发情牛同样参加配种),间隔10~12 h后进行第二次人工授精,每天早、晚两次观察供体母牛自然发情情况并记录。第16天采用非手术方法采集胚胎。
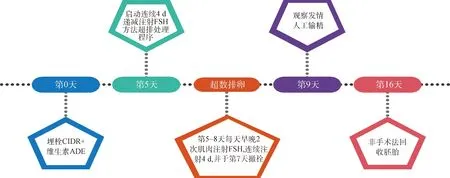
图1 体内胚胎生产流程示意图
1.3.2 胚胎采集与质量鉴定 对供体牛进行利多卡因硬膜外麻醉后,高锰酸钾水消毒外阴,纸巾擦拭后酒精消毒并用生理盐水冲洗干净。用15号采卵管(wörrlein 15)采集胚胎,两侧子宫角共用400 mL PBS液回收胚胎。体式显微镜下收集胚胎并根据形态学鉴定胚胎质量,分为可用胚胎(A、B级)和不可用胚胎(退化胚、未受精胚)。
1.3.3 血液采集及处理 埋植CIDR(第0 天)当天上午、第一次人工授精时和胚胎回收当天各采集供体血液5 mL(促凝管,河北鑫乐科技有限公司)。血样室温下静置2 h后2 500 r·min-1离心10 min,收取血清并按试验编号分装标记,于-20 ℃冰箱保存。ELISA检测血清中AMH浓度。
1.3.4 测定指标和数据筛选 测定不同试验组间AMH浓度、回收胚胎数、可用胚胎数、A级优质胚胎数、不可用胚胎数、退化胚胎数、未受精卵母细胞数等指标。所有数据按照“平均数±3倍标准差”的标准进行剔除。经过数据筛选,符合上述条件的供体牛为92头。
1.4 统计分析
试验数据采用“平均值±标准误”表示,各组数据应用SAS 9.2软件分别对不同供体类型、超排次数、FSH剂量和同期发情处理方法进行单因素方差分析及多重比较。P<0.05 表明组间差异显著。
2 结 果
2.1 外周血AMH浓度分析
结果表明,体内胚胎生产过程中的3个时间点(CIDR埋置、人工输精和胚胎回收)外周血AMH浓度均为正态分布,从CIDR埋置到胚胎回收,其浓度呈明显减少的趋势(图2)。CIDR埋置时平均AMH浓度为(113.51±2.66) ng·L-1,最大值为224.10 ng·L-1,最小值72.12 ng·L-1,上四分位数为126.07 ng·L-1,下四分位数为96.66 ng·L-1。人工输精时平均AMH浓度为(86.27±3.74)ng·L-1,最大值为225.54 ng·L-1,最小值32.98 ng·L-1,上四分位数为112.06 ng·L-1,下四分位数为55.18 ng·L-1。胚胎回收时平均AMH浓度为(50.40±1.67)ng·L-1,最大值为116.64 ng·L-1,最小值34.48 ng·L-1,上四分位数为54.44 ng·L-1,下四分位数为40.74 ng·L-1。因此,为明确各个时间点AMH浓度的筛选阈值,本研究将不同时期的外周血AMH浓度按照高(浓度分布最高的25%)、中等(浓度分布中间的25%~75%)、低(浓度分布最低的25%)分为3组,并检验了这3组之间头均回收胚胎数、头均可用胚胎数、头均退化胚胎数和头均未受精卵母细胞数等指标间的差异。
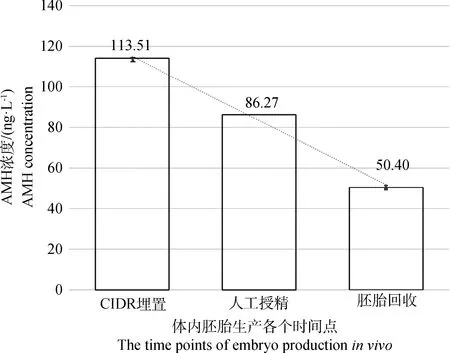
图2 体内胚胎生产不同时间点供体牛外周血AMH浓度的分布图
2.2 CIDR埋置时外周血AMH浓度对胚胎生产效率的影响
CIDR埋置时外周血AMH浓度对胚胎生产效率的影响分析结果见表1。从表1可以看出,外周血AMH浓度对头均回收胚胎数和头均未受精卵母细胞数均有显著影响(P<0.05),高浓度组头均回收胚胎数(9.38枚)显著高于中等浓度组(6.47枚)(P<0.05),高浓度组头均未受精卵母细胞数(2.15枚)显著高于其余两组(P<0.05),说明CIDR埋置时外周血中高AMH浓度可能会刺激更多卵泡募集和发育,后期FSH处理后形成更多的优势卵泡排卵。但是,头均回收胚胎数增加的同时头均未受精卵母细胞数也显著增加,这可能是因为人工输精时间与排卵时间不吻合导致,高浓度组更多的优势卵泡排卵,但是排卵时间不一致,排卵周期更长,因此观察到发情后12 h配种可能并不能覆盖所有排卵的卵母细胞,导致部分后排或者先排的卵母细胞未能受精,后续应进一步细化研究其影响机制。
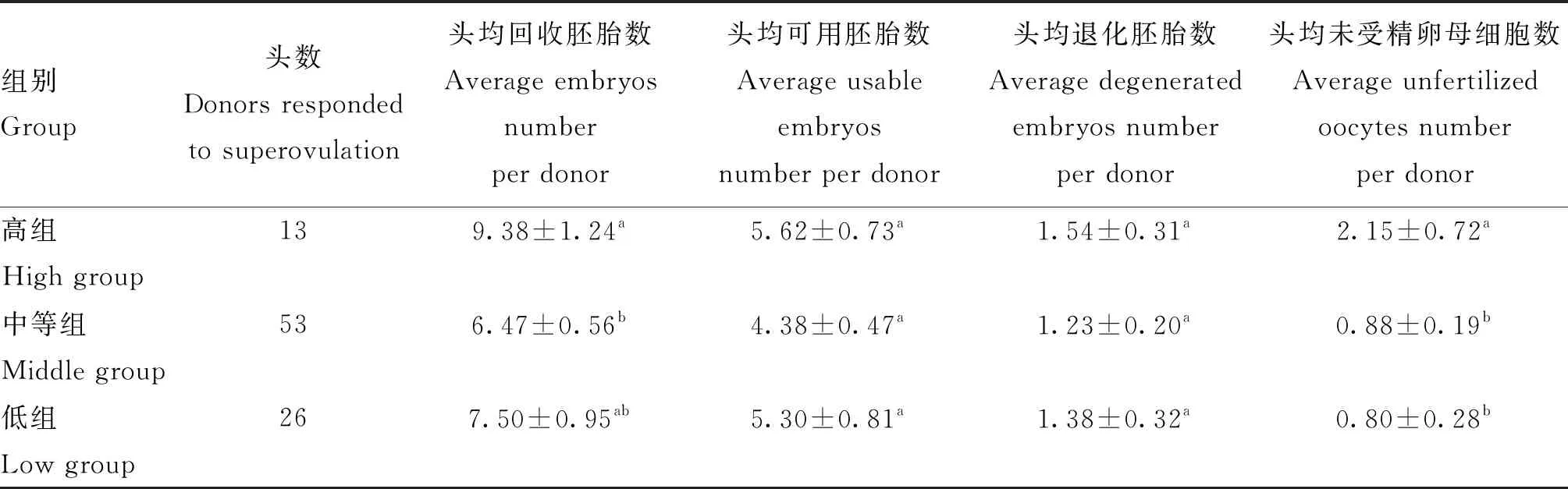
表1 CIDR埋置时母牛血清中AMH浓度与胚胎生产效率的关系
2.3 人工输精时外周血AMH浓度对胚胎生产效率的影响
人工输精时外周血AMH浓度对胚胎生产效率的影响分析结果见表2。从表2可以看出,人工输精时外周血AMH浓度对头均回收胚胎数、头均可用胚胎数、头均退化胚胎数和头均未受精卵母细胞数均无显著影响(P>0.05)。人工输精时大多数优势卵泡已经排卵,AMH浓度明显低于CIDR 埋置时,这与Maggi等[3]的研究结果一致,随着卵泡的发育,AMH浓度逐渐降低。但是,总体来看,高浓度组的体内胚胎生产效率最低,无论是头均回收胚胎数,还是头均可用胚胎数均低于其余两组,且头均退化胚胎数和头均未受精卵母细胞数均最高,高浓度AMH代表高组还有部分卵泡没有排卵,从而导致高浓度组头均可用胚胎和胚胎总数均降低。

表2 人工输精时母牛血清中AMH浓度与胚胎生产效率的关系
2.4 胚胎回收时外周血AMH浓度对胚胎生产效率的影响
胚胎回收时外周血AMH浓度对胚胎生产效率的影响分析结果见表3。从表3可以看出,胚胎回收时外周血AMH浓度对头均回收胚胎数、头均可用胚胎数、头均退化胚胎数和头均未受精卵母细胞数均无显著影响(P>0.05),这可能是因为当体内胚胎生产执行到胚胎回收时,卵巢上黄体正处于发育期,机体内孕酮含量高,卵泡发育被抑制,此时AMH浓度高的牛只可能说明下一个发情周期时其卵泡募集和发育数量多,并不能作为体内胚胎生产效率的标记之一。
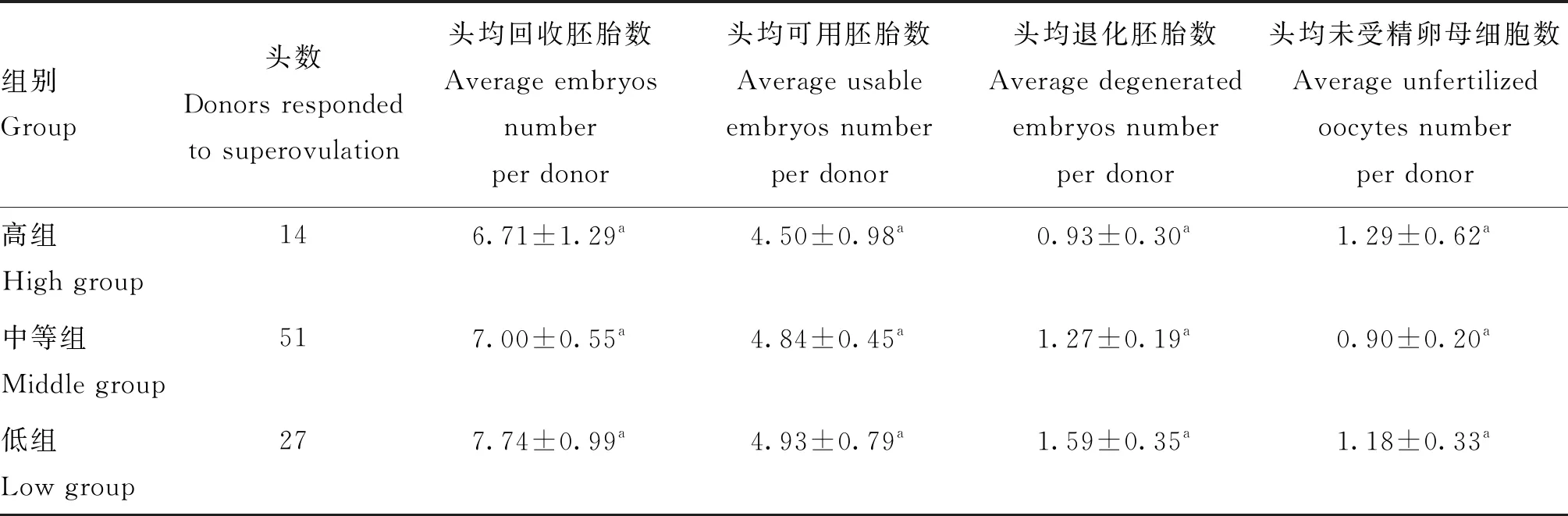
表3 回收胚胎时母牛血清中AMH浓度与胚胎生产效率的关系
2.5 体重对胚胎生产效率的影响
在研究体内胚胎生产中3个时间点(CIDR埋置、人工输精和胚胎回收)外周血AMH浓度对体内胚胎生产效率的影响以外,本研究还收集了本次试验92头供体牛体重数据,按照“平均值±3倍标准差”筛选后,按照高(分布最高的25%,>384 kg)、中等(浓度分布中间的25%~75%,350~384 kg)、低(浓度分布最低的25%,<350 kg)分为3组,用于分析体重与体内胚胎生产效率之间的关系。从表4中可以看出,虽然各组间没有显著差异(P>0.05),但是高体重组头均可用胚胎数、头均回收胚胎数均低于中等体重组和低体重组,其中,中等体重组最优,说明体重适中更适合体内胚胎生产,过胖或过瘦都有可能会影响体内胚胎生产效率。
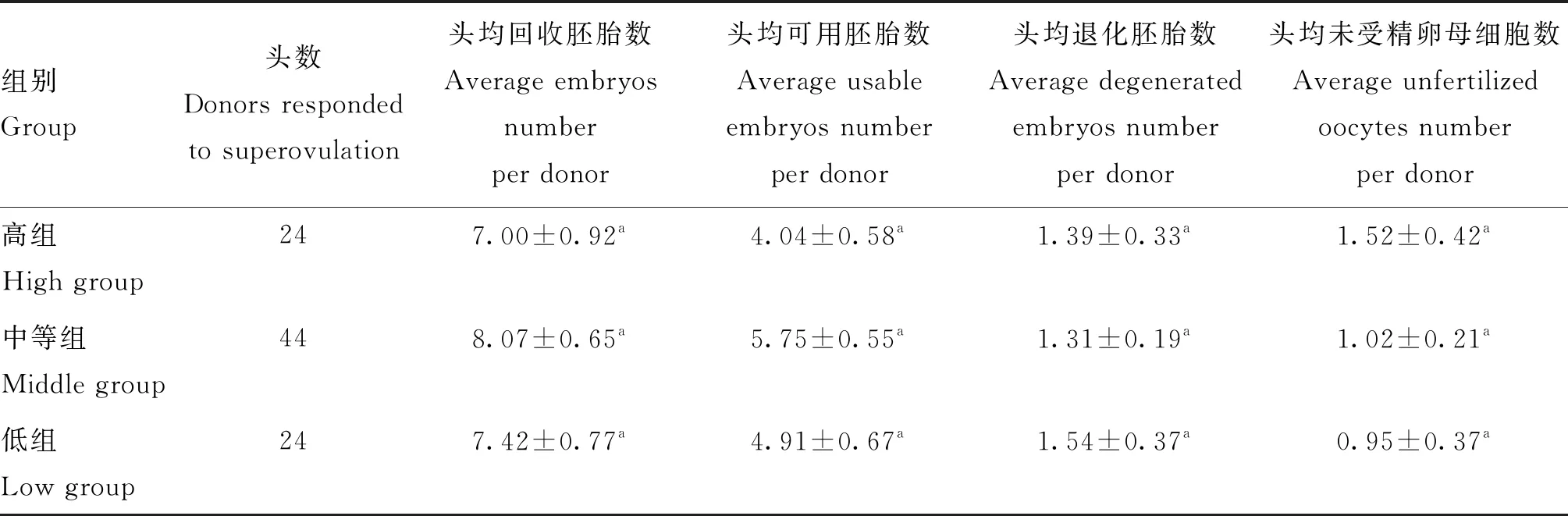
表4 供体牛体重与胚胎生产效率的关系
3 讨 论
超数排卵生产体内胚胎是牛胚胎移植商业应用获得胚胎来源的重要途径之一[27-29]。虽然研究人员一直在不断改进牛胚胎生产与移植技术,但是超数排卵后供体平均获得可用胚胎数在过去几十年里也没有显著提高,平均可用胚胎数仍为6~7枚,这可能与供体母牛对超数排卵反应差异较大,即超数排卵时卵巢状态有关[30-31]。研究发现,牛外周血液中AMH含量与母牛卵巢活性、有腔卵泡数量和卵泡质量有关[24]。
AMH发挥生物学功能需要与颗粒细胞上的AMH受体Ⅰ型(AMHR1)和Ⅱ型(AMHR2)二聚体结合,随后启动AMH的信号传导过程。Poole等[32]研究发现,小卵泡(5~8 mm)中AMH受体比大卵泡(13~24 mm)的数量更多,说明年轻卵泡比老年卵泡产生更多的AMH。Monniaux等[10]研究也发现,随着奶牛卵泡直径的增加,AMH的浓度显著下降,说明AMH主要在卵泡发育前期发挥作用,例如卵泡募集等。因而,外周血液AMH含量可能与超数排卵后供体母牛获得胚胎数量有关,高浓度AMH组牛只超排后可见更多的优势卵泡或可以通过活体采卵回收到更多的卵丘-卵母细胞复合体,Monniaux等[10]研究发现,血液AMH浓度在100~200 pg·mL-1之间和大于200 pg·mL-1的供体母牛头均获得胚胎数和可用胚胎数均显著高于AMH浓度低于100 pg·mL-1的供体牛。毕江华等[33]等重复超数排卵荷斯坦供体母牛发现,血液中AMH含量在1 000~1 100 pg·mL-1的供体牛体内胚胎生产效率显著高于含量在500~800 pg·mL-1的供体母牛,因此,外周血AMH浓度可作为预测供体胚胎产量的一项内分泌指标[34]。但是上述研究测定的都是采集胚胎后供体血清中AMH浓度,且每组试验牛数量较少。
因此,本试验增加多个采样点,旨在研究供体牛超排过程中不同时间外周血AMH浓度与荷斯坦奶牛体内胚胎生产效率的相关性,优化供体牛筛选标准,以提高体内胚胎生产效率。经分析发现,CIDR埋置时,外周血AMH浓度对胚胎生产效率有显著影响,高AMH浓度组头均回收胚胎数(9.38枚)显著高于其余两组(6.47和7.50枚),说明CIDR埋置时外周血中高AMH浓度可能会刺激更多卵泡募集和发育,后期FSH处理后形成更多的优势卵泡排卵。但是,头均回收胚胎数增加的同时头均未受精数也显著增加,这可能是因为人工输精时间与排卵时间不吻合导致,虽然高AMH浓度组有更多的优势卵泡排卵,但是排卵时间不一致,排卵周期可能更长,因此,观察到发情后12 h配种可能并不能覆盖所有排卵的卵母细胞,导致部分后排或者先排的卵母细胞未能受精。上述结果说明,不仅开始超数排卵时供体牛卵巢对FSH的反应可影响超数排卵效果,而且超数排卵处理前供体牛外周血AMH浓度也直接影响超数排卵获得的胚胎总数和可用胚胎数[35-36]。后续应针对高AMH浓度组未受精卵的增加开展进一步研究,以进一步提高高AMH浓度组的可用胚胎数。此外,依托供体牛体重数据分析发现,尽管不同体重组之间体内胚胎的生产效率无显著性差异,但是,体况适中组牛只的可用胚胎数、回收胚胎数等均优于其他两组,尤其是优于体重偏胖组,这与Souza 等[11]的研究结果一致,说明体重适中更适合体内胚胎生产,过胖或过瘦都有可能会影响体内胚胎生产效率。
4 结 论
本试验结果表明,在华北地区现有的生产管理水平下,荷斯坦青年牛超排前外周血AMH浓度可以一定程度反映供体牛超排的效果,高AMH浓度牛只的胚胎总数更多,可以作为供体牛筛选条件之一,且供体牛选择时宜选用体况适中的牛只。本研究结果对荷斯坦青年奶牛体内胚胎高效生产和核心群的建立具有一定的参考价值。
