GADD45β蛋白抑制ALV-J在DF-1细胞中的复制
2021-06-30廖志宏谢青梅
陈 胜,廖志宏,谢 姿,陈 峰,谢青梅,舒 薇
(1. 华南农业大学动物科学学院 畜禽健康养殖与疾病防控实验室,广州 510642; 2.华南农业大学测试中心,广州 510642)
禽白血病(avian leukosis,AL)是一种由禽白血病病毒(ALV)感染宿主引起的肿瘤性疾病,包括血管瘤、肾细胞瘤和结缔组织瘤等[1-2]。在能够感染禽的ALV中,根据囊膜蛋白的抗原模式,ALV被分为7个亚群(A~E、J和K)[3]。其中,J亚群禽白血病病毒(ALV-J)于1988年首次在英国报道[4],由于其传染性强,随即迅速扩散到世界各地,成为养禽业重大病毒性疾病之一。ALV-J属于逆转录病毒科α逆转录病毒属的单股RNA病毒,原型株HPRS-103基因组长度为7.2 kb。其中,gag、pol和env基因分别编码特异性抗原、多聚酶和囊膜蛋白(gp85和gp37)[5-6]。ALV-J可以水平传播和垂直传播,并且其水平传播效率比其他ALV亚群更高[7]。由于缺乏疫苗保护,根除计划是迄今为止唯一有效的控制ALV-J的方法[2]。
生长阻滞和DNA损伤诱生蛋白45(growth arrest and DNA damage 45,GADD45),包含了GADD45α、GADD45β/Myd118和GADD45γ 3种蛋白成员,其转录水平能在胁迫性生长停滞条件下增加[8]。GADD45β可参与调节肿瘤细胞多种生理进程,包括肿瘤生成及转移、细胞自噬与细胞凋亡等[9-10]。研究表明GADD45β可通过作用于NF-κB,减少促炎性肿瘤相关巨噬细胞的激活和肿瘤内相关免疫细胞的浸润,从而促进肿瘤的生成[11]。Myint等[12]在胆管癌中发现GADD45β蛋白可能参与EMT通路的调控和肿瘤转移。最新研究表明GADD45β表达能影响卵巢浆液性囊腺癌患者的总生存时间,表明GADD45β可能参与化疗诱导的凋亡或肿瘤免疫反应[13]。此外,本实验室前期在ALV-J抗性基因筛选过程中发现了GADD45β的显著上调[14]。这些研究结果均表明GADD45β与病毒感染及肿瘤生成密切相关。但是,GADD45β在ALV-J感染方面的具体研究鲜有报道。
本研究中,作者发现ALV-J感染可显著上调GADD45β的表达水平。在DF-1细胞中,通过过表达试验,作者发现GADD45β的上调能显著抑制ALV-J的复制,而干扰GADD45β则促进了ALV-J的复制,这说明GADD45β具有抗ALV-J复制的功能。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒和质粒 鸡胚成纤维细胞系(DF-1)和pRK5-Flag空载质粒,为华南农业大学动物科学学院畜禽健康养殖与疾病防控实验室保存。ALV-J SD1005毒株为山东农业大学崔治中教授实验室馈赠。
1.1.2 主要试剂 大肠杆菌DH5α菌株购自上海唯地生物技术有限公司。DMEM培养基、0.25%胰酶、磷酸缓冲液PBS、Lip3000转染试剂、羊抗兔IgG二抗均购自英潍捷基(上海)贸易有限公司。Flag标签抗体与内参抗体均购自上海优宁维生物科技股份有限公司。gp37多克隆抗体由上海生工生物工程有限公司制备。SalⅠ和BamHⅠ限制性内切酶购自BioLabs公司。PAGE凝胶快速制备试剂盒购自上海雅酶生物技术有限公司。蛋白Marker、ECL发光液、ProLongTMGold Antifade Mountant with DAPI染料购自赛默飞世尔科技有限公司(中国)。4%多聚甲醛溶液和0.1%曲拉通X100购自开封市沛瑜生物科技有限公司。ALV抗原检测ELISA试剂盒购自IDEXX生物科技有限公司。
1.2 总RNA的提取
Trizol法提取总RNA:在培养细胞的六孔板中加入适量Trizol试剂,裂解2 min,吹打转移至2 mL离心管,4 ℃ 12 000 r·min-1离心5 min。转移上清至新的离心管,加入200 μL氯仿,混匀静置5 min,4 ℃ 12 000 r·min-1离心15 min。转移上清至新的离心管,加入等体积异丙醇,颠倒混匀静置10 min,4 ℃ 12 000 r·min-1离心10 min。弃上清,加入75%乙醇,4 ℃ 12 000 r·min-1离心5 min。弃上清,在通风橱干燥5 min,加入适量DEPC水溶解RNA沉淀。
1.3 GADD45β真核表达质粒的构建
首先用PrimeScript RT试剂盒将总RNA进行两步法反转录,得到cDNA。以cDNA为模板扩增GADD45β基因,在引物两端加入SalⅠ和BamHⅠ酶切位点,引物序列: 5′-GGATCCATGACTCTGGAAGAGACGCA-3′(F);5′-GTCGACTCACTCAGG TAAGGCAATAGTTGC-3′(R)。
将GADD45β扩增片段与pRK5-Flag线性化载体进行连接,构建pRK5-Flag-GADD45β真核表达质粒。之后进行转化涂板,挑取单克隆菌落进行PCR鉴定,鉴定结果为阳性的菌落送生工生物工程(上海)股份有限公司测序,证实构建成功。
1.4 病毒感染
将DF-1细胞接种于培养皿中,待细胞密度达到70%~80%时,进行ALV-J SD1005毒株(103.6TCID50·0.1 mL-1) 感染试验,感染2 h后换成含2%胎牛血清的维持液,继续在37 ℃培养箱中培养。
1.5 Western blot
转染一定时间后,收集细胞蛋白样品,经SDS上样缓冲液裂解样品,于沸水中煮沸5 min后进行凝胶电泳。电泳时,设定电压为80 V,待样品压成一条直线后,改为110 V恒压直至结束。电泳结束后,将SDS-PAGE凝胶转印至PVDF膜上,用5% 脱脂奶粉室温封闭2 h。封闭完成后,将相应蛋白抗体(Flag抗体、β-actin内参抗体、GADD45β抗体与gp37多克隆抗体,均为兔源抗体)经TBST 1∶1 000 稀释后,室温孵育1 h,经TBST洗涤3次,每次10 min, 再使用经TBST 1∶10 000稀释的山羊抗兔二抗,室温孵育30 min,经TBST洗涤3次,每次5 min。最后,按照ECL发光液试剂盒的指示配制发光液,并使用超灵敏化学发光成像仪C600进行成像。
1.6 实时荧光定量PCR
以cDNA作为模板进行实时荧光定量PCR检测,反应体系:10 μL SYBR Green,上下游引物各1 μL, 1 μL cDNA,7 μL DEPC水。反应程序:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 1 min,共40循环。引物: 5′-GCCTTCTGCTGCGACAATGA-3′(GADD45β-qPCR-F);5′-GGCTCTCGGCGCAGTAAT-3′(GADD45β-qPCR-R)。
1.7 间接免疫荧光试验
将DF-1细胞接种于15 mm共聚焦培养皿,经转染孵育一定时间后,进行样品处理,步骤如下:弃液,PBS洗涤3次,加入500 μL 4%多聚甲醛固定15 min, 弃液经TBST洗涤3次后,加入500 μL 0.1%曲拉通X100穿孔15 min,弃液,经TBST洗涤3次后,加入500 μL 5%脱脂奶粉室温封闭30 min,封闭完成后,将gp37多克隆抗体经TBST 1∶100稀释后,室温孵育1 h,经TBST洗涤3次,每次10 min, 再使用荧光抗兔二抗经TBST 1∶100稀释后,室温孵育1 h,再经TBST洗涤3次,每次10 min。最后,滴加一滴ProLongTMGold Antifade Mountant with DAPI染料,4 ℃保存或进行激光共聚焦显微镜观察。
1.8 酶联免疫吸附试验(ELISA)
收取待检测细胞上清液,按照禽白血病病毒抗原检测试剂盒(Avian Leukosis Virus Antigen Test Kit)的步骤检测p27 抗原。
1.9 GADD45β-siRNA干扰试验
将DF-1细胞接种于六孔板,待密度为70%~80%时分别转染2 μg的NC siRNA(5′-UUCUCCGAACGUGUCACGUTT-3′)和GADD45β siRNA(5′-CCAGAUAACGUGGCGUUCUTT-3′),转染24 h后,分别感染ALV-J SD1005毒株(103.6TCID50·0.1 mL-1),在24、48、72 h不同时间点收取样品用于后续检测。
1.10 统计分析
使用Image Pro Plus 6.0软件对Western blot条带进行灰度分析。使用GraphPad Prism 8.0.1软件进行统计分析。采用Student-t检验组间差异。P<0.05为统计学意义上的显著差异。
2 结 果
2.1 GADD45β真核表达质粒的构建及鉴定
利用引物对GADD45β基因进行PCR扩增后,进行1%琼脂糖凝胶电泳,检测到509 bp扩增条带(图1A),大小与预期相符。将经SalⅠ和BamHⅠ双酶切的片段与pRK5-Flag载体连接,转化DH5α大肠杆菌感受态细胞,划线涂板,挑取单克隆菌落进行PCR鉴定,如图1B所示,检测到509 bp扩增条带,经测序正确,说明GADD45β真核表达质粒构建成功。
为了鉴定pRK5-Flag-GADD45β真核表达质粒是否能够成功表达,将其与pRK5-Flag空载对照质粒分别转染DF-1细胞,36 h收取细胞样品,用Flag抗体进行Western blot检测,检测到18 ku条带,大小与预期相符,证明pRK5-Flag-GADD45β在DF-1细胞中成功表达(图1C)。为了进一步验证这一结果,还通过激光共聚焦检测了GADD45β的表达,并且观察到其均匀分布于细胞核与细胞质中(图1D)。

A. GADD45β PCR扩增;B. 菌液PCR鉴定;C. 蛋白质印迹法检测pRK5-Flag-GADD45β质粒表达;D. 激光共聚焦检测pRK5-Flag-GADD45β质粒表达及其细胞定位
2.2 ALV-J感染上调GADD45β的表达水平
将DF-1细胞接种于六孔板中,待细胞密度达到70%~80%时,进行ALV-J SD1005毒株(103.6TCID50·0.1 mL-1)感染试验,分别收集24、48与72 h细胞样品进行检测。荧光定量PCR结果表明,ALV-J感染能显著上调GADD45β的mRNA表达水平(图2A)。同时,用Western blot方法检测内源性GADD45β蛋白表达变化,如图2B所示,ALV-J感染能显著上调GADD45β的蛋白水平。对目的条带进行了灰度分析(图2C),与对照组相比,攻毒组GADD45β/β-actin的比值显著上调。为了进一步证明这一结果,还通过激光共聚焦检测了GADD45β的蛋白表达情况。结果表明,ALV-J感染显著上调了GADD45β的表达,并且改变了GADD45β的表达模式,从核质均匀分布转移到主要分布于细胞质中(图2D)。此外,我们前期研究表明在ALV-J攻毒后的鸡体免疫器官中也检测到了GADD45β基因的显著上调[14]。总的来说,上述试验结果说明了ALV-J感染能显著上调GADD45β的表达水平。
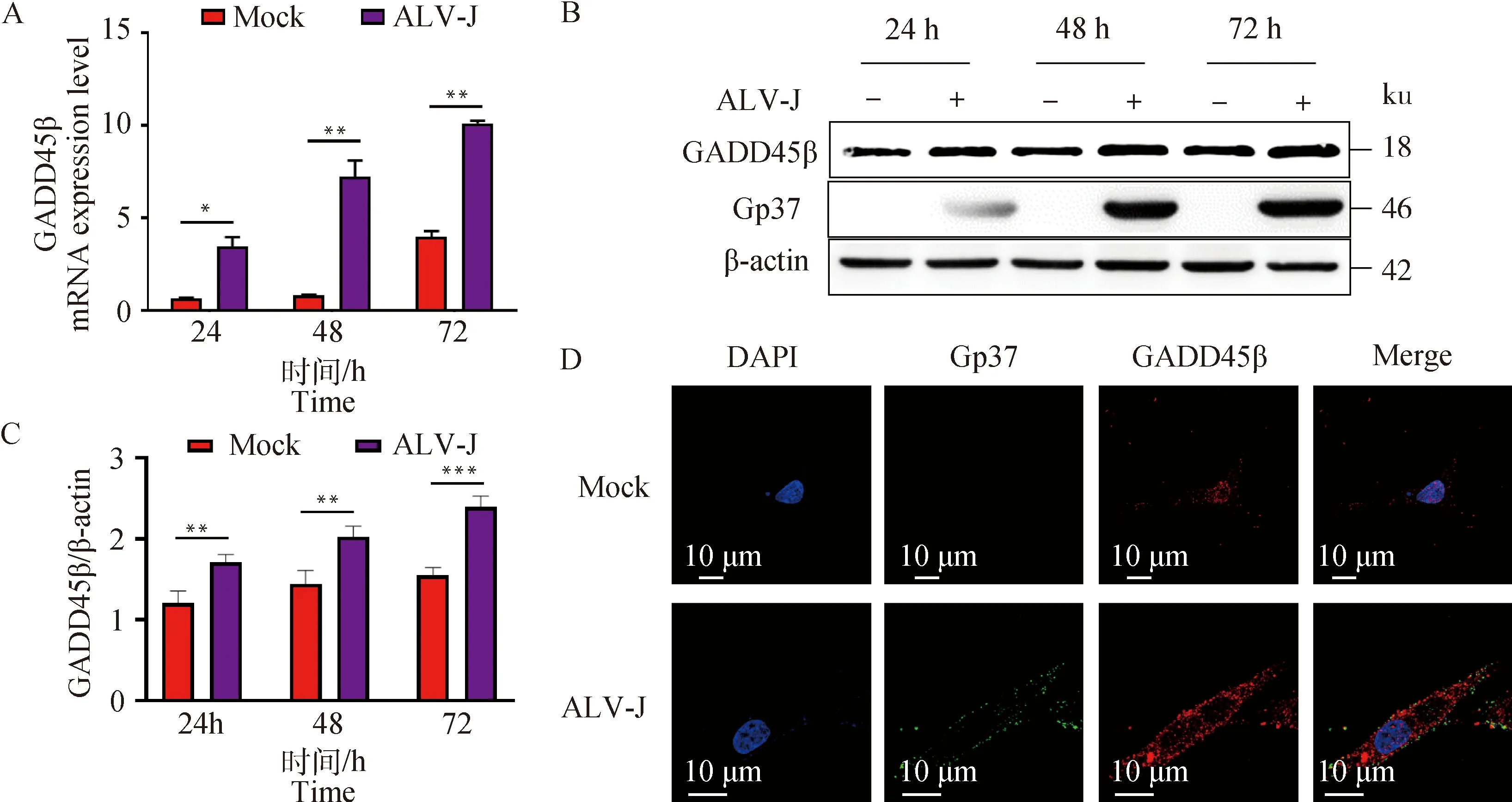
A. 实时荧光定量PCR检测GADD45βmRNA水平变化;B. Western blot检测GADD45β蛋白水平变化;C.灰度分析GADD45β/β-actin比值;D. 激光共聚焦检测GADD45β蛋白表达变化;*. P<0.05, **. P<0.01, ***. P<0.001
2.3 过表达GADD45β抑制ALV-J的复制
为了验证GADD45β过表达对ALV-J复制的影响,将GADD45β真核表达质粒转染DF-1细胞,并于24 h后进行ALV-J SD1005毒株(攻毒剂量103.6TCID50·0.1 mL-1)感染试验,收取24、48、72 h细胞蛋白进行Western blot检测。结果表明(图3A~C),与空载对照组相比,过表达GADD45β显著下调了gp37表达,即降低ALV-J的复制水平(图3A)。灰度分析也进一步说明了这一结果(图3C)。此外,我们收集了感染后第1~6天的细胞上清液进行ELISA检测,SP值显示感染后第2、3、5和6天,过表达组细胞上清p27抗原水平均显著低于对照组(图3B)。间接免疫荧光试验也证明了GADD45β蛋白的过表达能下调ALV-J在DF-1细胞的复制水平(图3D)。

A. Western blot检测gp37蛋白水平变化;B. 灰度分析gp37/β-actin;C. ELISA检测细胞上清p27抗原水平变化;D. 间接免疫荧光试验检测gp37蛋白表达变化(20×);*. P<0.05, **. P<0.01, ***. P<0.001
2.4 下调GADD45β促进ALV-J的复制
为了进一步探究GADD45β对ALV-J复制的影响,笔者还进行了GADD45β的干扰试验。首先合成了3条GADD45β siRNA,并分别转染DF-1细胞,转染后48 h收集蛋白检测GADD45β的表达水平,以验证siRNA的干扰效率。结果如图4A与4B所示,GADD45β siRNA-3的干扰效率最佳。
将GADD45β siRNA-3与NC siRNA分别转染70%生长密度的DF-1细胞,并于转染后24 h感染ALV-J SD1005(103.6TCID50·0.1 mL-1),收集24、48、72 h细胞蛋白进行Western blot检测。目的条带及灰度分析结果表明,下调GADD45β的表达水平能显著增加ALV-J的复制(图4C与4D)。同样的,我们收集了感染后第1~6 天的细胞上清液进行ELISA检测,结果显示,从第3 天开始,GADD45β siRNA组细胞上清液p27抗原水平显著高于NC siRNA对照组(图4D)。间接免疫荧光试验结果也表明干扰GADD45β的表达能够有效促进ALV-J的复制水平。
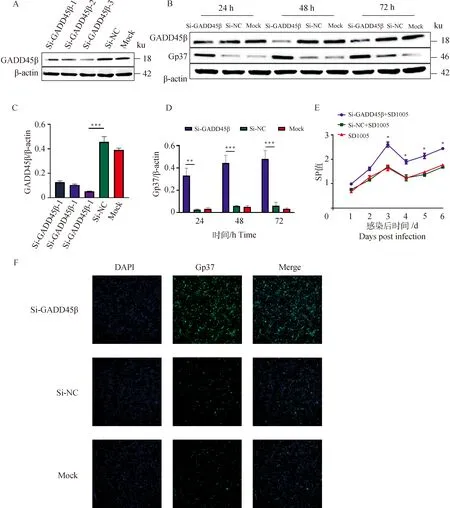
A. Western blot检测siRNA 干扰效率;B. Western blot检测gp37蛋白水平变化;C. 灰度分析siRNA干扰效率;D. 灰度分析gp37蛋白水平变化;E. ELISA检测细胞上清p27抗原水平变化;F. 间接免疫荧光试验检测gp37蛋白表达变化(10×);*. P<0.05, **. P<0.01, ***. P<0.001
3 讨 论
禽白血病是一种高度危害养禽业的传染性疾病。ALV-J是典型的致瘤性逆转录病毒,其生命周期高度依赖宿主细胞蛋白。然而,很少有研究揭示负责ALV-J复制的宿主蛋白。最近的一项研究通过蛋白质组学发现CTHRC1(collagen triple helix repeat containing 1)与ALV-J的复制显著相关,并且通过试验证明了CTHRC1能够抑制ALV-J的复制水平[15]。TRIM62(tripartite motif containing 62)同样在限制ALV-J的复制中起着重要作用,并且其是通过靶向SPRY结构域而发挥抗病毒活性[16]。此外,chZAP(chicken zinc finger antiviral protein)在mRNA水平和蛋白水平上均能显著抑制ALV-J在DF-1细胞上的复制[17]。宿主蛋白在ALV-J的复制过程中起着重要作用,但具体有哪些宿主蛋白参与其中还未可知,丰富这一过程对于ALV-J的抗病毒研究及开发新的抗病毒药物具有重要意义。
GADD45β是公认的调节细胞自噬和细胞凋亡的功能性蛋白[9],其能通过介导p38-MAPK/JNK信号通路的激活来响应环境压力,维持细胞稳态。不仅如此,GADD45β还与细胞生长控制,以及细胞对DNA损伤的反应相关,缺乏GADD45β可能会导致肿瘤细胞的生长或凋亡[10]。例如,在肝癌中,GADD45β的下调水平就与肿瘤恶性程度的升高密切相关[18]。GADD45β已被鉴定为肝癌和慢性肝病的潜在分子标志物和治疗靶标[19]。此外,在丙型肝炎病毒感染的小鼠模型中也发现了GADD45β的表达下调,且启动子活性降低[20]。在脑垂体肿瘤中,GADD45β通过遏制肿瘤的增殖与存活被鉴定为肿瘤抑制因子[21]。这些研究充分证明GADD45β与肿瘤发生之间有着密切的联系。本试验前期研究也在致瘤性病毒ALV-J的抗性基因筛选过程中发现了GADD45β的差异表达[14],但是其在ALV-J复制过程中的具体作用尚未报道。本研究表明,GADD45β与ALV-J的复制密切相关。ALV-J感染能显著上调GADD45β的mRNA和蛋白表达水平。通过过表达GADD45β和siRNA敲低其表达水平,分别得到了抑制和促进ALV-J复制的结果,这表明GADD45β能够抑制ALV-J的复制。在ALV-J感染DF-1细胞后,通过激光共聚焦检测,笔者发现GADD45β的表达模式从核质均匀分布转变为只在细胞质中表达。GADD45β本身无酶活性,其可通过蛋白间相互作用来执行其生理功能,如调节细胞增殖、细胞死亡和细胞存活等[22]。目前研究中发现GADD45β蛋白能与MEKK4结合,其蛋白可以从细胞核转移至细胞质,进而介导p38MAPK/JNK途径的激活来发挥其生理功能[23]。而p38MAPK和JNK信号通路的变化很可能是GADD45β发挥抗病毒作用的关键,这也是接下来研究的重点。
4 结 论
成功构建GADD45β真核表达质粒,且在DF-1细胞中成功表达并均匀分布于核质。ALV-J感染可显著上调GADD45β的表达水平,提示GADD45β与ALV-J之间存在着紧密联系。通过过表达与干扰试验,发现GADD45β上调能显著抑制ALV-J的复制,而干扰GADD45β的表达则能促进ALV-J在DF-1细胞上的复制水平。综上所述, GADD45β能够抑制ALV-J在DF-1细胞上的复制水平。
