氨氯地平对去势大鼠前列腺增生的影响及其机制
2021-06-30李卓莫介荣叶木石莫妍妍彭志宏吴昊开柳建军
李卓 莫介荣 叶木石 莫妍妍 彭志宏 吴昊开 柳建军
1广东医科大学附属医院泌尿外科(广东湛江524000);2佛山市第一人民医院急诊科(广东佛山528000)
良性前列腺增生(BPH)近年来已成为一个严重的健康问题,并影响世界范围内老年男性的生活质量,且良性前列腺增生发病率有明显上升趋势,很多患者最终都要接受手术治疗[1-2]。然而,其发病机制尚未明确。据统计,60 岁以上的BPH 患者中,约25%伴有高血压[3],其前列腺体积明显高于非高血压患者,另一项研究显示BPH 与(舒张)血压[4]呈正相关,而且高血压可使前列腺上皮及间质细胞增殖增加,前列腺体积及前列腺上皮细胞增殖率与高血压持续时间显著相关[5],提示高血压病和BPH 显著相关,更说明高血压是BPH 的一个重要因素,因此,高血压的治疗可以减轻甚至抑制BPH 的发生发展。治疗高血压的钙离子阻滞剂在治疗高血压的同时也对BPH 的防治有相关作用,或许能增强特异性抗BPH 治疗的效果。根据目前的报道,氨氯地平钙通道阻滞剂(CCB)是世界卫生组织/国际高血压学会推荐的一线降压药之一,可用于治疗不同程度的高血压[6]。因此,本研究通过建立BPH 大鼠模型,通过多种方法探究氨氯地平对BPH的作用效果及其可能机制。
1 材料与方法
1.1 试剂和药品大鼠酸性磷酸酶和大鼠非前列腺特异性酸性磷酸酶酶联免疫吸附试验(ELISA)试剂盒购自R&D(美国),Trizol RNA 分离试剂盒购自Sigma。VEGF 抗体、Bcl-2 抗体、Bax 抗体、GAPDH 抗体均购自Bioss(中国北京),SP-0023 免疫组化试剂盒购自Zymed(美国)。AR 和actin 的PCR 引物由南京建成生物工程研究所(中国南京)提供,非那雄胺购自Proscar(5 mg,lot no.)。(默克公司,285922)。
1.2 仪器本研究使用了以下工具:电子分析天平(GB2002,梅特勒-托利多全球、瑞士),冰机(AF100、苏格兰人、意大利),电泳仪(Liuyi,北京),microinstrument(上海手术器械厂、上海、中国),解剖显微镜(日本奥林巴斯)PCR 循环(美国Bio-Rad 580 bk),冷冻离心机(3 k18,σ,德国),数字彩色显微图像分析系统(7001×紫外线指数,紫外线指数,英国),辐射免疫计数器(gc-1500r,Zonkia,中国),离心机(Biofuge Fresco,Sorvall,美国),切片机(RM2125,徕卡,德国),酶标板阅读器(MK3,Finnpipette)。
1.3 BPH 大鼠模型的建立42 只健康的8月龄雄性SD大鼠(动物许可证:SCXK(Jing)2012-0001),体质量450 ~520 g,驯化1周后,随机分为6组(n=7):正常对照组、去雄组、模型组、非那雄胺组、低剂量氨氯地平组、高剂量氨氯地平组[7-9]。正常对照组大鼠进行假去势,其余各组大鼠均进行去势,7 d 后皮下注射丙酸睾酮5 mg/(kg·d)(药物处理组)或等量大豆油(去势对照组和模型组)。各组通过灌胃的方式给予非那雄胺、氨氯地平6 d。
1.4 前列腺指数计算阉割30 d后,大鼠称重并麻醉,通过下腹正中切口切除前列腺。腹叶的湿重被确定,使用溢水法测量他们的体积。以前列腺湿重(mg)/大鼠体质量(g)计算前列腺指数(PI)。
1.5 前列腺组织病理学检查前列腺称重脱水后,从每个前列腺中取一个腹侧叶用4%多聚甲醛固定,石蜡包埋,切成薄片。苏木精和伊红染色(HE)检查组织切片有无病理改变。
1.6 免疫组织化学(包含IHC)石蜡切片在二甲苯中脱蜡,在乙醇梯度中脱水,在3%过氧化氢中孵育10 min 以抑制内源性过氧化物酶,分别与一抗和二抗结合后,用苏木精染色,再用中性胶密封。VEGF 染色采用Image-Pro Plus version 6.0 软件分析。
1.7 Western blot用冷冻蛋白裂解缓冲液裂解前列腺组织,在4 ℃超声裂解,12 000 g 离心30 min 并测定上清蛋白浓度。用SDS-聚丙烯酰胺凝胶电泳分离每个样品等量的蛋白质并转移到PVDF 膜上。封闭后与一抗(1∶1 000稀释)在4 ℃孵育过夜,清洗后再与二抗(1∶2 000 稀释)在室温孵育1 ~2 h,然后用化学发光试剂显色。使用Image-Pro Plus 6.0软件扫描分析。
1.8 Reverse transcription(RT)-PCR用Trizol试剂从解冻组织中提取总RNA,通过逆转录合成cDNA。大鼠雄激素受体(AR)基因95 kb 片段的特异性引物序列如下:正向5'-CTGGCATGGAAGGCTTTGTGAAC-3',反向5'-CAGTGGCGAGTCGTTTGTGTTAC-3'。以actin 为对照,引物序列为:正向5'-GAATTCCCAGTAAGTGCGGGTCATA-3',反向5'-CGAGGGCCTCACTAAACCATC-3',扩增片段105 个基点。RT-PCR 在ABI PRISM7500 序列检测系统中进行,数据采用7500 软件2.0.6 版本进行分析。
1.9 统计学方法所有数据均通过SPSS 17.0 版本软件(SPSS,IL,USA)采用单因素方差分析进行分析,以均数±标准差表示,P<0.05 为差异有统计学意义。
2 结果
2.1 氨氯地平对大鼠PI 的影响各实验组的PI较去势对照组明显升高(P<0.01)。与模型组比较,非那雄胺和低剂量氨氯地平组的PI 均明显降低(P<0.01),结果见表1。
表1 大鼠体重、前列腺腹侧叶重量、体积和前列腺指数的比较.Tab.1 Comparison of rat body weight,prostate ventrolateral lobe wet weight,volume,and PI±s
注:与控制组比较:*P <0.05,**P <0.01;与模型组比较:#P <0.05,##P <0.01
平均体重(g)前列腺腹外侧叶湿重(mg)前列腺腹外侧叶容积(mL)前列腺指数508.3±77.4662.5±148.00.51±0.121.32±0.24组别正常组控制组模型组非那雄胺组低剂量氨氯地平组高剂量氨氯地平组498.0±37.4 457.6±62.8 482.5±67.5 523.1±21.7 463.8±35.0 91.4±50.0 417.4±112.0 276.0±191.0 294.1±164.0 385.7±106.0 0.07±0.03 0.38±0.11**0.26±0.20 0.27±0.14*0.34±0.09 0.18±0.05 0.93±0.17**0.54±0.13**##0.57±0.14**##0.83±0.25
2.2 氨氯地平对大鼠前列腺组织病理学的影响与正常对照组(图1B)相比,模型组大鼠前列腺腔内可见乳头状增生和部分钙化,腺体周围未见纤维组织和平滑肌增生。低剂量氨氯地平处理大鼠上皮细胞呈立方或管状,腺腔微增,乳头及间质组织减少。大剂量氨氯地平可导致部分气泡乳头状增生,但整体外观与正常对照组相似(图1)。
2.3 氨氯地平对原位前列腺VEGF 表达的影响VEGF 主要表达于腺体细胞,模型组明显高于正常组(P<0.01)。与模型组相比,低剂量和高剂量氨氯地平均能显著恢复前列腺VEGF 水平(P<0.01,图2、表2)。

图2 氨氯地平对大鼠前列腺组织VEGF 表达的影响Fig.2 Influence of amlodipine on VEGF expression in the rat prostate tissue
表2 大鼠前列腺组织原位血管内皮生长因子(VEGF)的表达Tab.2 Influence of amlodipine on VEGF expression in the rat prostate tissue±s
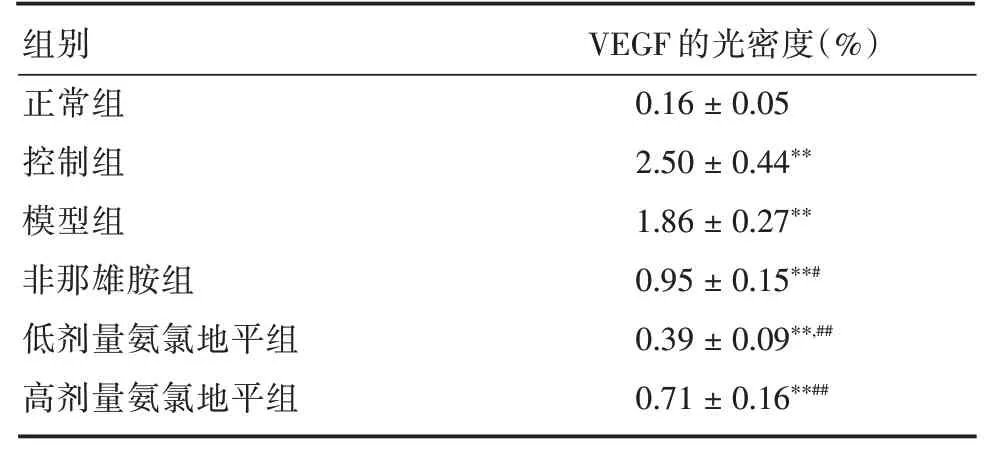
表2 大鼠前列腺组织原位血管内皮生长因子(VEGF)的表达Tab.2 Influence of amlodipine on VEGF expression in the rat prostate tissue±s
注:与控制比较:*P <0.05,**P <0.01;与模型组比较:#P <0.05,##P <0.01
组别VEGF 的光密度(%)正常组0.16±0.05控制组2.50±0.44**模型组1.86±0.27**非那雄胺组低剂量氨氯地平组高剂量氨氯地平组0.95±0.15**#0.39±0.09**,##0.71±0.16**##
2.4 氨氯地平对大鼠前列腺组织Bcl-2/Bax比值的影响与模型组比较,低剂量氨氯地平组的Bcl-2的表达量显著降低(P<0.01)。另外,与去势对照组和模型组相比,非那雄胺、低剂量氨氯地平和高剂量氨氯地平组的Bax 表达水平也显著升高(P<0.01)。与去势对照组相比,模型组Bcl-2/Bax 比值明显升高(P<0.01),而低剂量氨氯地平组Bcl-2/Bax 比值明显降低(P<0.01,图3、表3)。
表3 Bcl-2 和Bax 在各组前列腺组织中的表达量Tab.3 Bcl-2 and Bax expression in the prostate tissues of each group±s

表3 Bcl-2 和Bax 在各组前列腺组织中的表达量Tab.3 Bcl-2 and Bax expression in the prostate tissues of each group±s
注:与控制比较:*P <0.05,**P <0.01;与模型组比较:#P <0.05,##P <0.01
别Bcl-2/GAPDHBax/GAPDHBcl-2/Bax常组0.10±0.010.02±0.003.75±0.25制组0.12±0.010.03±0.003.34±0.28组正控模型组非那雄胺组低剂量氨氯地平组高剂量氨氯地平组0.17±0.01**0.21±0.02**#0.13±0.01##0.19±0.02**0.03±0.00 0.04±0.00 0.05±0.00**##0.05±0.01**#4.71±0.31**5.35±0.41**2.57±0.22##3.56±0.35

图3 各组前列腺组织中Bcl-2、Bax 表达Fig.3 Bcl-2 and Bax expression in the prostate tissues of each group
2.5 氨氯地平对大鼠前列腺组织AR 表达的影响与去势对照组相比,去势后大鼠前列腺组织AR表达水平明显降低,而在丙酸睾酮注射后所有组的前列腺组织AR表达水平均显著升高(P<0.01)。与模型组比较,非那雄胺组、高剂量氨氯地平和低剂量氨氯地平组AR表达明显降低(P<0.01,表4)。
表4 各组前列腺组织中AR 的表达Tab.4 AR expression in the prostate tissues of each group±s

表4 各组前列腺组织中AR 的表达Tab.4 AR expression in the prostate tissues of each group±s
注:与控制比较:*P <0.05,**P <0.01;与模型组比较:#P <0.05,##P <0.01
组别控制组模型组非那雄胺组低剂量氨氯地平组高剂量氨氯地平组AR 表达量0.41±0.07 3.13±0.42**##1.00±0.24**##1.96±0.22**##1.28±0.15**##
3 讨论
BPH 是一种由性激素失衡、生长因子以及前列腺间质细胞与上皮细胞[10]相互作用引起的多因子变性疾病。去势后前列腺迅速萎缩,雄激素诱导增生,提示前列腺形态和功能的维持依赖于雄激素[11]。本研究结果表明,低剂量氨氯地平可明显改善前列腺形态和功能。有研究报道[12],不同剂量氨氯地平对睾酮诱导的BPH 雄性大鼠模型下尿路障碍有显著改善作用,细胞外钙离子通过二氢吡啶敏感的钙通道进入细胞,进而动员细胞内钙离子以激活逼尿肌。在人逼尿肌中,细胞外钙离子也在激活过程中起主要作用,而L 型钙通道拮抗剂对人逼尿肌有较强的抑制作用。因此,氨氯地平可能通过上述途径改善前列腺增生。
目前,前列腺增生发生发展的机制仍未明确,现有的研究认为其发生发展与性激素及其受体、细胞因子、炎症、细胞自噬、细胞增殖、细胞凋亡等相关[13-14]。本研究发现氨氯地平可以降低BPH 模型大鼠前列腺组织Bcl-2/Bax 比值,从而抑制前列腺增生,诱导细胞凋亡。此外,Bcl-2/Bax 比值与未去势大鼠的差异表明,前列腺细胞在AR 作用下可能发生增殖和凋亡,BPH 通常是前列腺上皮细胞和间质细胞[15]增殖增加和凋亡减少的结果。细胞凋亡减少和Bcl-2 的高表达参与BPH 形成过程[16]。在正常细胞中,Bcl-2 在刺激后和发育过程中维持着增殖和凋亡的平衡。在成熟组织和肿瘤细胞中也有表达,在凋亡细胞中低表达或检测不到[17]。Bax 和Bcl-2 具有高度的同源性,彼此形成同源二聚体/异源二聚体,从而形成调节[18]细胞凋亡的线粒体膜通道。增生前列腺Bcl-2 表达随Bax 表达增加而下调,Bcl-2/Bax 比值降低可诱导细胞凋亡,进而抑制前列腺增生[19-20]。本研究发现氨氯地平也降低了前列腺中VEGF 的表达,表明其对前列腺增生后前列腺组织有保护作用。VEGF 是刺激前列腺内皮细胞和前列腺上皮细胞的最有效的有丝分裂因子之一[21]。之前的研究报道,6SL 可通过抑制VEGFR-2 的激活和随后的血管生成,在体外和体内对BPH 模型有改善作[22]。氨氯地平是一种L型钙通道阻滞剂(L-CCB),研究表明L-CCBs 可抑制逼尿肌收缩,改善膀胱血氧供应[23-25]。结果表明氨氯地平具有调节高血压和抑制前列腺增生的作用。此外,氨氯地平单独或联合特拉唑嗪治疗BPH 诱导的[26]大鼠下尿路功能障碍均有改善。因此,通过以上的研究,有理由认为氨氯地平通过下调VEGF、AR、Bcl-2 和Bcl-2/Bax 比值诱导细胞凋亡来抑制前列腺增生。
