YAP1、JAG1在三阴性乳腺癌中的表达及意义
2021-06-28王红艳刘金丽秦福霞刘志鹏韩昊丞郭素芬
刘 野,王红艳,刘金丽,秦福霞,刘志鹏,韩昊丞,郭素芬
(1.牡丹江医学院病理教研室;2.牡丹江市第二人民医院病理科;3.牡丹江医学院药学院药物制剂专业2017级1班,黑龙江 牡丹江 157011;4.佳木斯大学医学部2019级临床医学6班,黑龙江 佳木斯 154007)
Hippo信号通路是近年来发现的一条高度保守的抑制细胞生长的信号通路,主要通过调控细胞增殖、凋亡和分化来控制器官大小[1-2]。YAP1主要作用于Hippo信号通路下游,可与多种蛋白相互调节,参与机体内多条信号通路的调控,从而行使多种生物学功能,包括促进恶性表型、肿瘤干细胞的扩增和肿瘤细胞的耐药性[3]。Notch信号异常激活与肿瘤进程密切相关[4],参与肿瘤细胞增殖、肿瘤干细胞、促进上皮-间充质转化(Epithelial mesenchymal transformation,EMT)、化疗耐药及肿瘤血管增殖[5]。JAG1作为Notch信号的配体之一,在乳腺癌、宫颈癌、卵巢癌等多种恶性肿瘤中发挥作用[6]。TNBC是一种缺乏雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)和人表皮生长因子受体2(Human epidermal growth factor receptor-2,HER2)表达的浸润性乳腺癌,约占所有乳腺癌病例的10%~20%[7]。由于其与其他亚型乳腺癌相比恶性程度高、侵袭性强且远处转移能力强,且对激素及化疗反应不敏感,寻找TNBC发生中的致癌因素及影响其发展的分子对判断其预后及靶向药物开发具有重要意义。本研究通过免疫组织化学方法检测YAP1、JAG1蛋白在TNBC组织中的表达,探讨YAP1、JAG1蛋白与TNBC患者的临床病理特征的关系,从而去发现促进TNBC发生发展的致癌因素,并帮助判断预后及开发靶向治疗药物。
1 资料与方法
1.1 临床资料所选标本均为2016年1月至2020年12月间牡丹江医学院附属红旗医院病理诊断中心、牡丹江市第二人民医院和牡丹江市肿瘤医院病理科石蜡组织标本。收集TNBC标本30例为实验组(II级13例,III级17例),取10例距肿物距离>5 cm以上组织做对照组。纳入标准:所选病例患者均为女性,术前均未进行任何放化疗及内分泌治疗等,术后经过病理学证实确诊为乳腺浸润性癌,经IHC检测结果为ER(-),PR(-),HER2(-/+),且肿物最小径均大于0.5 cm,并有完整详细的临床资料。所有使用标本均符合伦理委员会要求并签署知情同意书。
1.2 方法所有标本均经10%中性福尔马林固定,采用IHC进行检测。YAP1抗体购自于Proteintech公司,JAG1抗体购自于武汉云克隆科技股份有限公司,一抗浓度均为1:100,二抗试剂盒(包含DAB显色液)购自于北京中杉金桥生物技术有限公司。选用微波法修复,修复液为柠檬酸钠(pH 6.0)。一抗4 ℃孵育过夜。
1.3 结果判读YAP1虽然在正常乳腺肌上皮细胞核阳性表达,但在腺上皮细胞不表达(判读为阴性),在癌组织中细胞阳性部位为癌细胞核和细胞浆[8]。JAG1在癌组织细胞阳性部位为细胞核[9],在癌旁组织不表达。阳性部位出现棕黄色颗粒即为阳性。随机观察5个高倍视野(×200),每个视野计数100个细胞,根据阳性细胞着色强度和阳性细胞百分率进行评估,最后将二者相乘总积分进行评定。阳性细胞着色评分:0分为无染色、1分为淡黄色、2分为棕黄色、3分为棕褐色。阳性细胞的百分率评分:阳性细胞<10% 为0分、阳性细胞10%~25%为1分、阳性细胞26%~50%为2分、阳性细胞>50% 为3分。总积分=染色强度评分×阳性细胞百分率评分。0~1分为 (-)、2~3分为 (+)、4~6分为 (++)、7~9为 (+++);定义 (-/+) 为低表达, (++/+++) 为高表达。
1.4 统计学方法采用SPSS 20.0统计学软件进行处理,采用Fisher确切概率分析数据,以P<0.05为差异有统计学意义。
2 结果
2.1 YAP1和JAG1在TNBC及癌旁组织中的表达情况IHC结果见图1。IHC结果显示,YAP1在TNBC组织的表达明显,而在癌旁组织中未见表达,且二者差异明显,有统计学意义(P<0.001),见表1。较II级TNBC组织相比,YAP1在III级TNBC组织中,无论是阳性细胞着色程度还是阳性细胞数量,均有增加,差异具有统计学意义(P<0.001),见表2。JAG1在TNBC组织中的表达水平较癌旁组织相比呈现明显高表达,差异有统计学意义(见表1)。另外,与YAP1的表达相似,JAG1的在III级TNBC组织中的表达也明显强于II级TNBC,差异有统计学意义(见表2)。以上结果说明YAP1、JAG1参与TNBC发生发展。
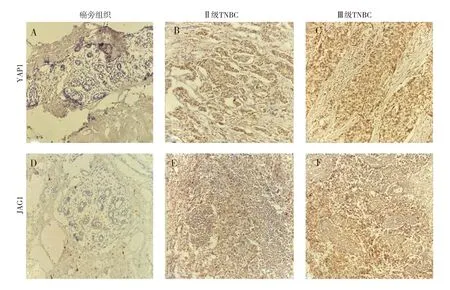
图1 YAP1和JAG1在癌旁组织和TNBC组织中的表达情况(×200)
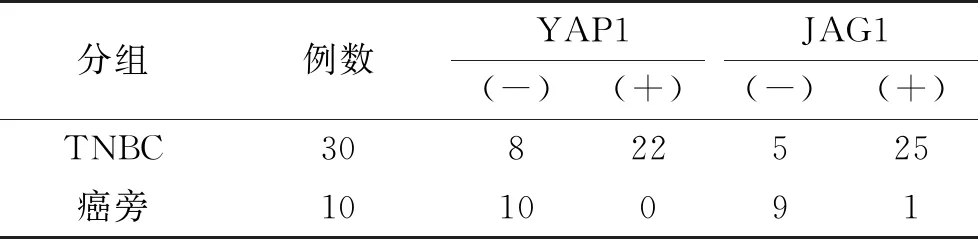
表1 YAP1和JAG1在组织中的表达情况
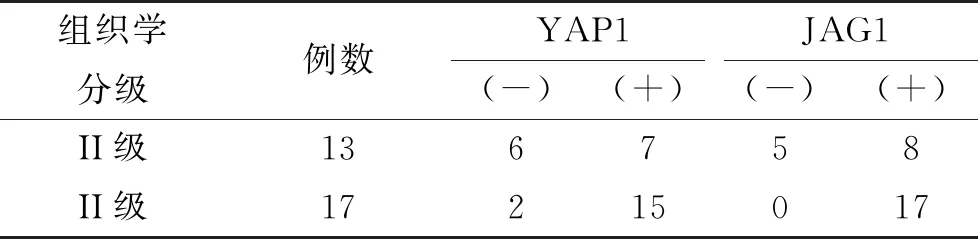
表2 YAP1和JAG1在TNBC组织学分级中的差异性表达
2.2 YAP1蛋白和JAG1蛋白在TNBC中的表达与临床病理参数的相关性通过与相关临床病理参数的统计分析可以发现,YAP1蛋白和JAG1蛋白的表达与患者年龄和月经情况无关,而均与肿物大小、淋巴结转移及病理分级相关。YAP1蛋白和JAG1蛋白高表达者,肿瘤增大明显,易发生淋巴结转移,且病理组织学分级较高(见表3)。
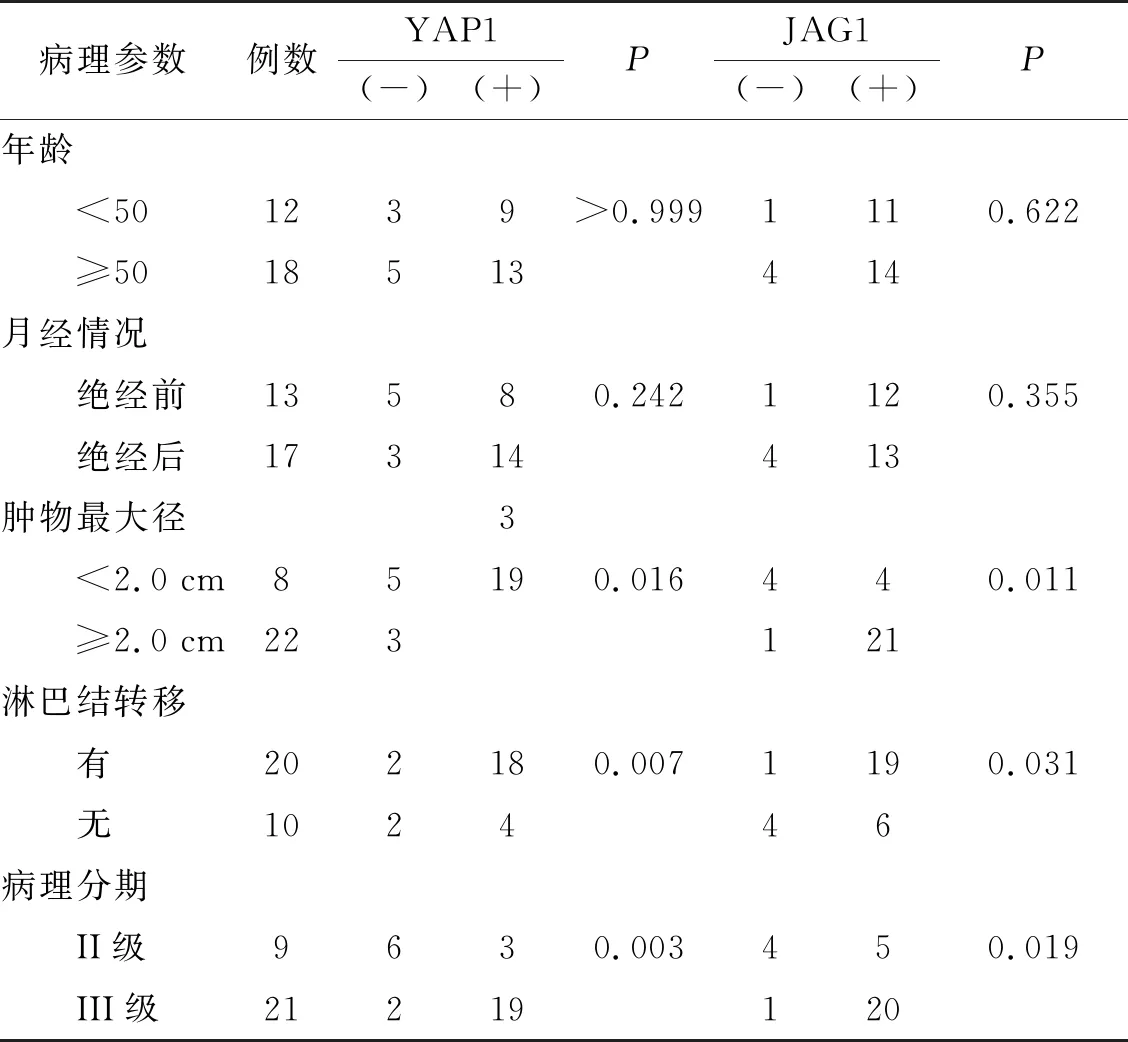
表3 YAP1和JAG1的表达与临床病理参数的相关性
3 讨论
世界卫生组织发起全球应对乳腺癌倡议,并称预计到2040年,每年将乳腺癌死亡率降低2.5%,将挽救250万人的生命。TNBC作为乳腺癌的一个亚型,具有恶性程度高、复发率高、侵袭性强、远处转移能力强等诸多特点。YAP1作为Hippo信号通路末端效应因子,已成为一个重要的癌基因,受Hippo信号通路激酶级联反应的负向调控。既往研究表明,Hippo通路下游效应因子YAZ/TAZ可以激活JAG1,而Notch受体活化形式NICD通过抑制TAZ降解,起到稳定TAZ蛋白的作用,从而增强YAZ/TAZ的活性,则Notch信号通路配体JAG1与Hippo信号通路效应因子YAZ/TAZ之间形成正反馈回路[10-11]。有研究表明,YAP1过表达与多种癌症放化疗抵抗及耐药性有关。通过使用YAP1抑制剂不仅能增强浸润性乳腺癌对标准疗法的反应,还能使TNBC靶向药物放疗增敏[12-13]。JAG1是Notch信号的一个关键配体,有文献报道,JAG1与ER/PR/HER-2受体状态等有密切关联,在TNBC组织中的阳性表达率明显高于其他亚型乳腺癌[14]。有研究发现,其表达水平可以直接影响患者预后,并能预测患者远处转移的发生与否[15]。
本研究通过对YAP1蛋白和JAG1蛋白的表达水平的观察,发现此二种蛋白在TNBC组织中表达明显高于癌旁组织,且差异显著,P值均<0.001,具有统计学意义。且与II级TNBC组织相比,YAP1和JAG1蛋白在III级TNBC组织中的表达明显增强,证明YAP1和JAG1的表达与TNBC恶性程度呈正相关。由此可以看出,YAP1和JAG1共同促进TNBC的发生发展。另外,在与临床病理参数的相关性分析中我们可以看出,YAP1和JAG1的表达情况与患者年龄大小和月经情况无明显相关性,而与肿物大小、淋巴结转移情况和病理分级有明显相关性。其中,二者的表达与临床病理分级的相关性也验证了如前所述的YAP1和JAG1的表达与肿物恶性程度相关这一观点。
综上所述,YAP1和JAG1在TNBC可能作为促癌基因,通过Hippo/Notch信号通路,共同促进TNBC发生发展,YAP1和JAG1有望成为TNBC治疗的新靶点。
