澳大利亚假体类高值医用耗材医保准入管理经验及启示*
2021-06-24邱英鹏赵羽西
——邱英鹏 赵羽西 赵 翔 肖 月
高值医用耗材一般具有操作风险大、单价高、临床用量大等特点,是各国医疗保险监管部门准入管理的重点。目前,我国医保对医用耗材采用“负清单”(Negative List)管理,即除明确规定不纳入报销的医用耗材以及对定价和使用有特殊规定的耗材外,其他医用耗材都可单独或包含在医疗服务项目中收费和报销。随着医改和医用耗材治理的推进,2020年国家医保局发布《基本医疗保险医用耗材管理暂行办法(征求意见稿)》,指出未来拟针对医用耗材采用准入管理,建立准入产品目录及动态调整机制并定期更新,即采用“正清单”(Positive List)管理。
在发达国家中,参保人通过商业保险获得除基本医保外的高值医用耗材服务,其中,澳大利亚商业保险的高值耗材管理较成熟[1]。我国基本医疗保险是以保障人民基本医疗需求为目的进行医保报销目录准入的。虽两国国情不同,但澳大利亚商业保险采用以价值为基础、以卫生技术评估为支撑并结合第三方独立评审的高值耗材准入制度对我国医保具有一定参考意义。本研究通过分析澳大利亚假体类高值医用耗材医保准入管理经验,结合我国高值医用耗材治理改革要求,提出了医保高值医用耗材准入机制、流程和方法的建议。
1 澳大利亚医保体系和医用耗材准入管理
澳大利亚商业医疗保险覆盖率达47%[2]。澳大利亚政府颁布的《私人健康保险法案(2017)》规定,为体现全面医疗保险制度覆盖的相关专业服务手术(如髋关节置换术)的可支付性,由国家卫生部负责制定和管理《假体类医用耗材目录》(以下简称《目录》),包含了商业医疗保险给予报销的外科植入假体、人体组织和其他高值医用耗材项目及报销标准[3]。
目前,《目录》纳入了一万余种产品,分为A、B、C 三个子目录[4]。A目录为外科手术植入类假体及辅助产品,B目录为涉及人体组织的产品,C目录为特殊医用耗材/器械。子目录下产品按5级分类,依次为类、亚类、组、亚组和后缀组。除类组分类信息外,《目录》内产品信息还包括产品名称、厂家、描述、规格和适应证说明、收费码及补偿价格等。其中,各类中临床效果相似的产品归为同一组/亚组/后缀组,补偿价格相同(表1)。每个产品都有唯一的收费码。
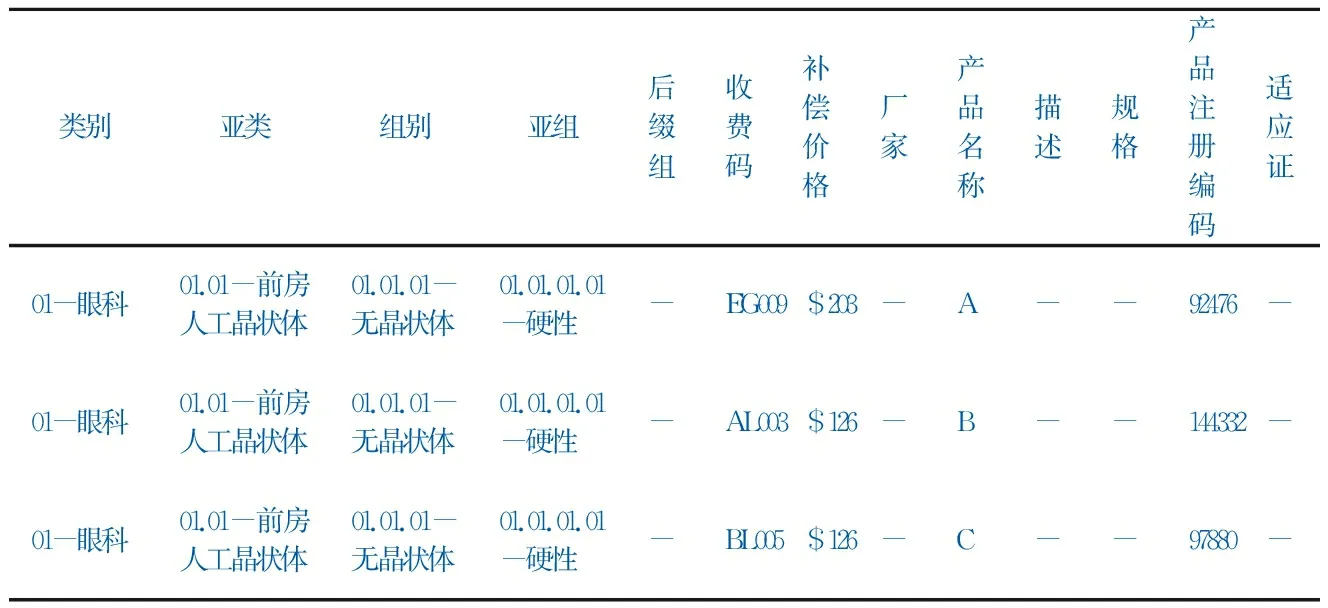
表1 《假体类医用耗材目录》信息:以人工晶体为例
2 《假体类医用耗材目录》准入管理机制
2.1 管理主体及职责
澳大利亚卫生部负责《目录》的制定及维护,每年进行3次更新,重点确定纳入《目录》的产品清单并进行补偿价格调整。卫生部建立了明确的《目录》管理机制。
企业提交新产品准入申报材料,经专业领域咨询组评估后,转交假体目录咨询委员会(Prostheses List Advisory Committee, PLAC)进行评审,基于评审结果形成建议书并提交至国家卫生部,由国家卫生部做出最终准入决策[5]。相关部门和组织的任务职能如表2所示。

表2 《目录》管理主要相关部门职能和组织结构
2.2 准入管理流程
澳大利亚是最早将卫生技术评估(Health Technology Assessment,HTA)引入医保决策的国家,用于国家医保药品和诊疗项目目录制定[8]。假体目录准入流程也采用了基于卫生技术评估的申请准入机制,包括申报材料及证据提交、评估、评审及决策四大步骤[8],如图1所示。

图1 《目录》调整流程示意图
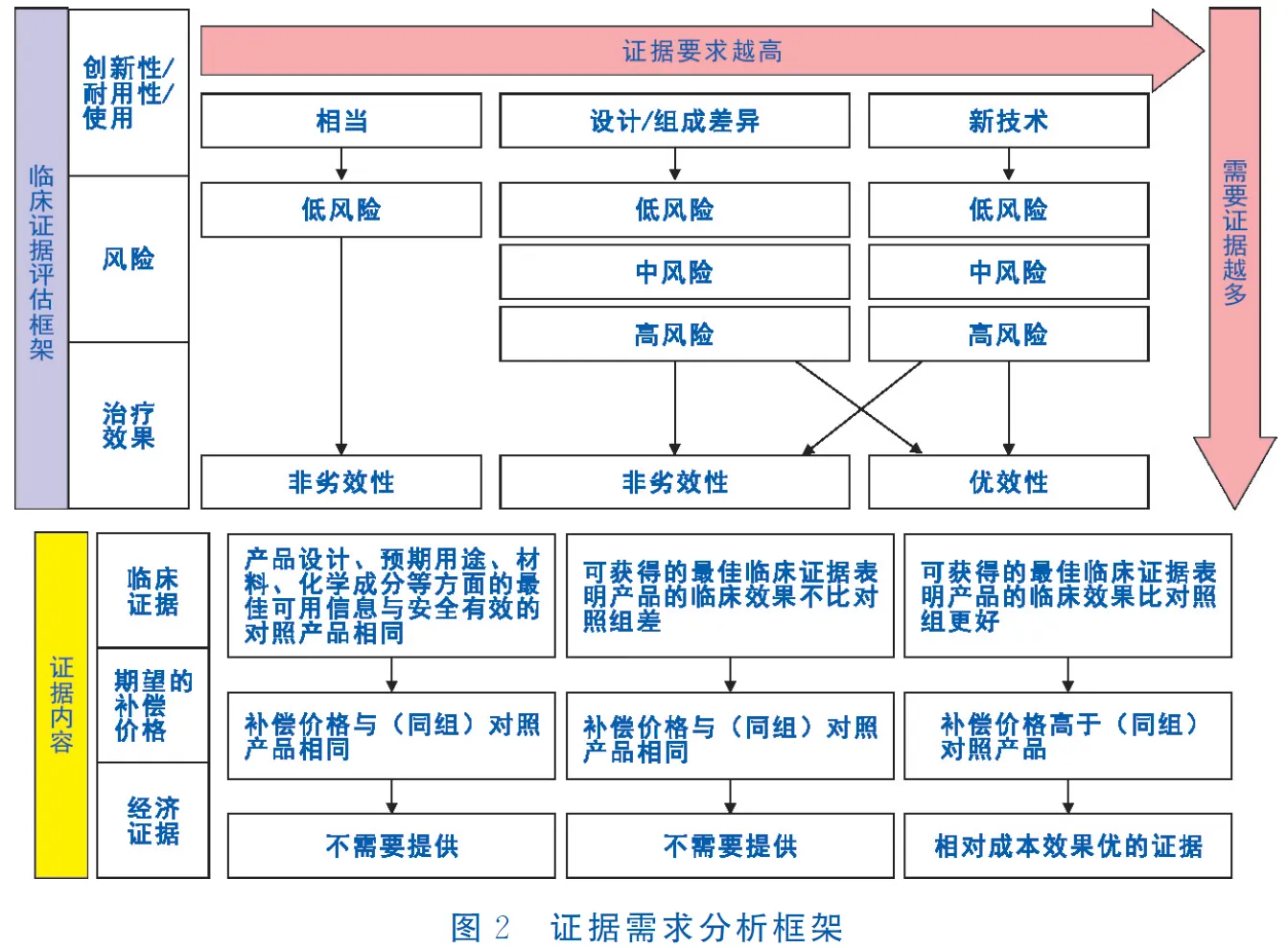
2.2.1 申报材料及证据提交 按照申报指南要求,申请人需通过在线管理平台提交申请表格及支持证据材料[9],包括风险性、创新性、使用寿命和范围、临床效果和经济性等方面的证据和信息[10](表3)。根据所申请产品的不同特性,证据要求有所不同。总体材料准备要求是:创新性佳、临床应用风险高、潜在疗效好的产品,补偿价格预期标准越高,对证据要求越高(图2),如相比同组同类产品(对照产品)效果更好且补偿价格更高的产品需要提供成本和效果证据或报告。

表3 申报材料证据要求
2.2.2 评估和评审 相关专业临床医生对申报材料进行初审后,由临床评估咨询组(CAGs)或临床专家小组(PoCE)开展正式评估,基于结果判断是否纳入,并提供产品分组意见。评估意见会反馈给申请人,申请人可对评估意见进行答辩或按照意见补充证据。目录咨询委员会定期召开评审会,根据申报材料和评估意见,讨论产品的临床证据及其他影响。评审决策重点参考内容包括产品特点、临床疗效、目录同类产品补偿价格、临床应用和费用情况及评估意见等。
对于申请的产品,评审委员会主要依据5类标准(表 4)进行评判。其中,前3项为法律和管理相关标准,第4项为产品功能标准, 第5项为临床效果和成本效果标准。

表4 评审标准
目录咨询委员会评审后形成推荐意见,个别难以决断的情况一般以投票方式决定评审结果。推荐意见包括但不限于以下5类:(1)同意纳入,主要为与目录中同类产品(对照产品)效果相同或更优的产品,且根据补偿价格测算成本效果较好;(2)有条件纳入,一般为补偿价格较高的产品,建议调整价格后纳入;(3)开展卫生技术评估,一般为证据不明确的产品,需要组织证据研究分析;(4)推迟申请,为在评审期内仍未能获得注册的产品;(5)不建议纳入。
2.2.3 决策 目录咨询委员会起草推荐意见建议书后提交至国家卫生部,由卫生部长审阅后最终做出决策。如决策涉及目录的修订调整,则由国家卫生部发布最新目录信息。
3 对我国的启示
3.1 基于价值评估进行准入决策
如何在保证临床价值的同时体现新医疗技术产品的综合价值是探索的重点。在《基本医疗保险医用耗材管理暂行办法(征求意见稿)》中同样提出:突出临床价值,在强化安全性、有效性及经济性评估基础上,按照基本医疗保险的功能定位,逐步明确医保支付标准。分析澳大利亚经验发现,针对医用耗材品种、规格、型号分类多样化问题,澳大利亚采取以临床价值(安全有效性)为基础,针对同一组别提出收费和补偿标准价格的方式管理价格和支付决策,同时结合创新性、疗效优越性确定实际报销价格,这不失为一种简单、高效的医保管理模式。
此外,当前我国基本医保拟全面实行DRG或DIP付费制度改革[11]。面对临床在用的多种不同产地、品目、规格、材质等耗材产品,亟需结合与临床疗效直接相关的核心技术特点进行组别分类,定义组别支付标准,未来结合具体产品特点和疗效情况调整耗材支付价格,实现对临床重点耗材的高效管理。
3.2 引入卫生技术评估支持循证决策
HTA是对医用耗材等卫生技术的临床安全性、有效性、经济性及社会影响进行综合分析以支持决策的系统方法。我国医保药品目录管理的专利药谈判准入已初步引入了卫生技术评估的理念和方法,要求相关企业提交安全性、有效性和经济性证据,但是缺乏证据申报指南且未根据产品风险、创新和定价级别提出精细化要求,这可能导致不同厂家提交证据的系统性、全面性和针对性有所差别。因此,在今后的耗材准入管理中,可借鉴澳大利亚经验,明确HTA在准入中的地位和作用,建立证据评估维度,对企业提出较为明确的申报路径,并根据产品的不同特点提出有差异性和针对性的证据要求。
3.3 建立第三方委员会,实现独立评审
从《目录》准入管理组织模式上来看,澳大利亚成立了由多方利益相关方组成的评审委员会,涵盖卫生技术评估、流行病学、临床医学和卫生经济学等专业领域,拥有多元专业视角,其意见可保障所提交证据的全面性、系统性和可靠性。评审委员会从第三方角度对新产品进行评审,以安全有效为前提,将价格和效果挂钩,判断是否“物有所值”,独立提出推荐意见,形成卫生部门最终决策判断的依据。我国医保部门已针对药品谈判定价和医保准入引入了类似的企业提交申报材料和独立专家评审机制,未来可参考澳大利亚经验,针对部分高值医用耗材等重点耗材品类施行第三方评审准入管理。
