乌萸汤对高龄小鼠卵母细胞的能量代谢相关影响
2021-06-24郑凌琦黄文玲刘艳霞徐彩
郑凌琦 黄文玲 刘艳霞 徐彩
在有生育需求的高龄女性中,因卵巢衰老而出现的卵细胞质量下降是导致不孕及辅助生殖技术失败的主要原因。临床上,对高发育潜能、高受精能力、高胚胎发育能力的高质量卵母细胞的要求日益增加。面对高龄女性助孕需求,如何防治卵巢衰老、保护卵巢功能、改善生育能力成为了生殖医学界关注的热点问题,也是其治疗的重点难点。已有大量临床研究证明,中医治疗卵巢衰老相关疾病能取得良好的治疗效果,甚至恢复生育功能[1],且中医药在辅助生殖技术中改善卵巢功能的作用逐渐被医学界认可。本研究采用未成熟卵母细胞体外成熟(in vitro maturation, IVM)技术,探讨乌萸汤对体外培养的高龄小鼠卵母细胞能量代谢相关影响,进而证实乌萸汤促进卵母细胞成熟的作用。
1 材料与方法
1.1 实验动物
SPF级C57BL/6J小鼠,雌性6周龄20只,体质量(18.5±0.6) g,24周龄60只,体质量(28.8±1.3) g;SPF级SD大鼠,雄性6周龄6只,体质量(150±20) g,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。以上动物均饲养于北京中医药大学东方医院实验中心动物屏障系统内,SPF环境,12小时/12小时,动物自由饮水摄食。
1.2 主要实验药物、仪器与试剂
乌萸汤药物组成:山茱萸10 g、乌药10 g、菟丝子15 g、丹参10 g、鸡血藤15 g、肉苁蓉10 g、香附10 g,北京中医药大学东方医院颗粒药房提供,康仁堂药业生产。
超净工作台(苏州净化SW-CJ-1FD,中国),CO2培养箱(SANYO XD-101,日本),生物倒置显微镜(OLYMPUS,IX51,德国),体式显微镜(世纪科信,中国),台式低速离心机(上海医疗器械股份有限公司医疗设备厂,80-2,中国),低温离心机(Sigma,3-30K,德国),酶标仪(Thermo,MULTISKAN MK3),荧光显微镜(OLYMPUS-IX51,德国),PVDF膜(0.45μm,Millipore,IPVH00010),电泳仪(北京百晶生物技术有限公司,BG-subMIDI),SDS-PAGE电泳系统(BIO-Rad,美国),脱色摇床(海门其林贝尔仪器制造公司,TS-100)。
山茱萸环烯醚萜苷类提取物(上海陶素生物科技,登记号:131189-57-6),孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)(宁波三生生物科技有限公司,批号:S200808),人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)(宁波三生生物科技有限公司,批号:B200805),M2培养基(Sigma,货号:M7167),石蜡油(Sigma,货号:M8410),羊抗兔-HRP(博奥森,货号:bs-0295G-HRP),β-actin(proteintech,货号:20536-1-AP),腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPKα)(CST,货号:5831),磷酸化腺苷酸活化蛋白激酶(p-AMPKα)(CST,货号:2535),过氧化物酶体增殖物激活受体γ辅助因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)(GeneTex,货号:GTX31921),蛋白marker(Thermo,货号:26617)。三磷酸腺苷ATP检测试剂盒(Sigma,货号:MAK190),总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(碧云天,货号:S0101),活性氧(reactive oxygen species,ROS)检测试剂盒(普利莱,货号:C1300-1),Mito-Tracker Green荧光探针标记线粒体染色(碧云天,货号:C1048),JC-1线粒体膜电位荧光探针(索莱宝,货号:J8030)。
1.3 含药血清制备
取雄性6周龄SD大鼠6只,乌萸汤连续灌胃7天,据李玲等[2]前期实验最优效剂量,灌胃药物按原药材浓度4.8 g/mL配制,每日灌胃1 mL/100 g药液,于第7天灌胃后1小时腹主动脉取血,3000 rpm离心15分钟,分离血清,将同组血清混匀,以0.22 μm滤器抽滤除菌,56℃灭活,分装,-20℃保存备用。
1.4 原代细胞提取
(1)培养液解冻24小时以上,配置M2培养基为基础培养基,含药培养基用基础培养基将药物稀释至乌萸汤含药血清10%、山茱萸环烯醚萜苷类提取物20 mg/L,分别称为乌萸汤培养基、山茱萸提取物培养基。
(2)在培养皿中做好清洗液滴(M2培养液),培养液滴(基础培养基、乌萸汤组培养基、山茱萸提取物组培养基),每滴20 μL,覆盖2 mL石蜡油后置于37℃、 5%CO2恒温培养箱平衡过夜。
(3)雌性清洁级C57BL/6J小鼠6、24周龄分别腹腔注射10 IU PMSG,间隔48 小时后再注射10 IU HCG,16小时后颈椎脱臼处死小鼠,在超净台中取出卵巢,转移至体式显微镜下用注射器针头将其扎破,待内含物溢出后挑取卵丘卵母细胞复合体(cumulus-oocytes complex, COCs),整个过程于15分钟内完成。
(4) 将所取得COCs置于预先平衡的培养液滴中清洗2~3次,转移至培养液滴中培养,控制每个液滴培养的COCs数量为10个,每个培养皿有10个含卵母细胞培养液滴。
1.5 细胞分组及培养
细胞共分为4个组:青年组:6周龄小鼠卵母细胞培养于基础培养基中;高龄组:24周龄小鼠卵母细胞培养于基础培养基中;乌萸汤组:24周龄小鼠卵母细胞培养于乌萸汤组培养基中;山茱萸提取物组:24周龄小鼠卵母细胞培养于山茱萸提取物组培养基中。
1.6 各观察指标检测方法
各组以放进培养箱为0小时,培养24小时后进行相关指标观察检测。
1.6.1 卵母细胞第一极体排出率 培养24小时后,随机选取20个细胞观察卵母细胞是否排出第一极体,第一极体排出率=排出第一极体的细胞数/总观察细胞数×100%。
1.6.2 卵母细胞ATP含量检测 采用荧光检测/比色的方法进行ATP浓度检测,各组收集20个培养液滴的卵母细胞,按照说明书进行检测。每组细胞置于96孔板不同孔中,用50 μL裂解液裂解细胞;另取0、2、4、6、8、10 μL的1 mmol标准品加入96孔板,最终每孔ATP含量为0、2、4、6、8、10 nmol,用水补齐至50 μL;每孔加50 μL反应液,混匀,室温反应30分钟;测570 nm处吸光度。去掉背景干扰值,根据标准品绘制标准曲线,计算每组卵母细胞的ATP浓度。
1.6.3 卵母细胞线粒体含量测定 利用荧光显微镜观察Mito-Tracker Green荧光探针标记线粒体,按照说明书进行。取1 mmol/L储存液按照1∶5000的比例加入到细胞培养液中,最终浓度为200 nmol;各组收集20个培养液滴,去除细胞培养液,加入使用前37℃预温育染色工作液,与细胞37℃共孵育15分钟;去除工作液,加入37℃预温育的新鲜细胞培养液;荧光显微镜观察拍照,根据其绿色荧光强度大小,反映卵母细胞线粒体含量高低。
1.6.4 线粒体膜电位变化检测 采用JC-1荧光探针法观察线粒体膜电位的变化。每组收集20个培养液滴并吸除培养液,用PBS溶液洗涤后加入1 mL细胞培养液、JC-1染色工作液,充分混匀;细胞培养箱中37℃孵育20分钟;吸除上清,用PBS洗涤2次;再加入1 mL细胞培养液,荧光拍照观察,测定红色荧光和绿色荧光的比值作为线粒体膜电位的变化值。
1.6.5 卵母细胞SOD酶活性检测 采用WST-8法检测卵母细胞SOD酶含量,按照说明书指示进行。各组收集20个培养液滴中的卵母细胞,用4℃或冰浴预冷的PBS或生理盐水洗涤1~2遍,沉淀后在4℃或冰浴进行匀浆,匀浆液4 ℃离心,取上清作为待测样品;96孔板设置样品孔和各种空白对照孔,依次加入待测样品、SOD检测缓冲液、WST-8/酶工作液、反应启动工作液,混匀后在37℃孵育30分钟;在450 nm处测定吸光度。根据试剂盒所述方法计算SOD酶活力单位。
1.6.6 卵母细胞ROS检测 利用DCFH-DA探针法检测卵母细胞ROS含量,操作步骤按说明书指示。各组收集20个培养液滴,去除细胞培养基上清,加入用无血清培养液稀释好的探针(探针终浓度为10 μmol)37℃孵育细胞30分钟;弃去上层培养液,用无血清培养液或0.01 mol PBS反复吹打,使细胞层全部进入PBS或培养液中;收集细胞悬液,用0.01 mol PBS或无血清培养液洗涤2次,去除未进入细胞内的探针,1000 rpm离心5分钟,弃上清,收集细胞沉淀,用PBS缓冲液洗涤2次,重悬细胞,荧光拍照观察。荧光强度大小反映卵母细胞线粒体含量高低。
1.6.7 卵母细胞AMPKα、p-AMPKα、PGC-1α蛋白的表达 为了了解线粒体的功能,检测ATP产生相关的AMPKα、p-AMPKα、PCG-1α蛋白的表达,采用Western Blot法测定蛋白含量。在4℃下将已加入裂解液的卵母细胞,12000 rpm离心10分钟,取上清液,BCA法蛋白定量。10%聚丙烯酰胺凝胶电泳,每孔上样量为50 μg蛋白;以每块胶80 V浓缩胶,120 V分离胶,恒压电泳,当目的蛋白处于分离胶面的下1/3的最佳分辨位置时停止电泳分离;4℃、110 V/120 mA恒流湿转;将剪切好的PVDF膜放到甲醇中浸泡10秒,室温摇床封闭2小时,然后分别加入稀释后一抗AMPKα、p-AMPKα、PGC-1α及β-actin,4℃孵育过夜转膜;洗去多余一抗,加入稀释HRP,37℃摇床孵育1小时;洗去多余二抗后显色曝光,使用Image J软件分析灰度值。
1.7 统计学方法

2 结果
2.1 第一极体排出率
青年组排出率为65%(13/20),高龄组排出率为15%(3/20),乌萸汤组排出率为45%(9/20),山茱萸提取物组排出率为35%(7/20)。青年组第一极体排出率高于其他各组,乌萸汤组和山茱萸提取物组高于高龄组,且乌萸汤组较山茱萸提取物组略高。见表1。
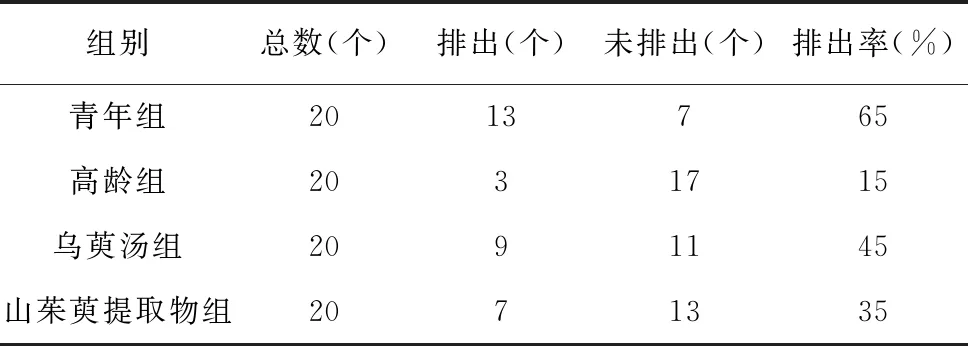
表1 各组小鼠卵母细胞第一极体排出率
2.2 ATP含量
与青年组相比,高龄组、山茱萸提取物组ATP含量明显降低,且差异有统计学意义(P<0.05),但乌萸汤组和青年组之间差异没有统计学意义(P>0.05);与高龄组相比,乌萸汤组和山茱萸提取物组含量有所升高(P<0.05)。见表2。

表2 各组小鼠卵母细胞ATP含量
2.3 卵母细胞线粒体荧光染色定位标记、线粒体膜电位变化
Mito-Tracker Green荧光探针标记线粒体(图1),测定各样本荧光强度,分析可知高龄组线粒体数量明显低于青年组(P<0.05),乌萸汤组、山茱萸提取物组线粒体数量明显高于青年组和高龄组(P<0.05)。

注:Mito-Tracker Green将线粒体绿染,Hochest将活细胞蓝染。
各组线粒体膜电位变化检测(图2)可知,高龄组膜电位变化弱于青年组(P<0.05),但乌萸汤组、山茱萸提取物组与青年组、高龄组相比差异没有统计学意义(P>0.05)。见表3。

注:线粒体膜电位较低时显示为绿色荧光,线粒体膜电位较高时显示为橙红色荧光。

表3 各组小鼠卵母细胞线粒体含量、膜电位比较
2.4 卵母细胞SOD酶活性、ROS含量
各组卵母细胞SOD酶活性比较发现,高龄组、乌萸汤组、山茱萸提取物组比青年组明显降低(P<0.05),乌萸汤组和山茱萸提取物组比高龄组有所升高(P<0.05)。
各组卵母细胞ROS荧光强度比较发现,高龄组、乌萸汤组、山茱萸提取物组比青年组明显升高(P<0.05),但乌萸汤组、山茱萸提取物组和高龄组之间差异比较无统计学意义(P>0.05)。见表4。

表4 各组小鼠卵母细胞SOD活性、ROS含量荧光强度比较
2.5 卵母细胞AMPKα、p-AMPKα、PGC-1α蛋白表达
与青年组比较,高龄组AMPKα、p-AMPKα、PGC-1α蛋白的表达明显降低(P<0.05),乌萸汤组p-AMPKα蛋白的表达明显降低(P<0.05);与高龄组比较,乌萸汤组AMPKα、PGC-1α均有所升高(P<0.05),山茱萸提取物组p-AMPKα有明显升高(P<0.05)。见表5、图3。

表5 各组卵母细胞AMPKα、p-AMPKα、p-AMPKα/AMPKα、PGC-1α蛋白表达的比较

图3 各组小鼠卵母细胞AMPKα、p-AMPKα、PGC-1α蛋白表达
3 讨论
数十年来,生育年龄的推迟成为全球趋势,加之“二孩政策”开放,有生育要求的高龄女性越来越多[3-4]。高龄女性的卵巢功能下降,常表现为月经周期紊乱、对卵巢刺激反应欠佳、高流产风险甚至不孕[5]。面对日益增加的高龄女性助孕需求,如何改善卵巢功能受到了生殖医学界的广泛关注。卵巢功能下降,其实质为女性年龄相关的卵母细胞数量减少和质量下降。卵巢是最容易受到年龄影响的器官之一,加上社会心理因素、医源病理因素、行为学因素、环境污染等因素的影响[6],卵母细胞出现某些基因突变、卵巢组织的端粒酶活性异常,氧化应激状态中酶活性下降、线粒体结构功能异常、细胞超微结构改变等,进而干扰卵细胞的正常发育,加重卵巢衰老[7-10]。最新研究表明,线粒体功能对调控卵泡闭锁和卵细胞质量起着决定性作用[11-12]。
线粒体能够通过氧化磷酸化产生ATP和少量ROS,是细胞一系列正常生理活动提供能量的物质基础,它的数量及功能能够反映细胞的生理状态[13]。AMPK是生物能量代谢调节的关键分子,其下游分子PGC-1α主要调控线粒体增生,对于维持线粒体数量具有重大意义。而膜电位的稳定给线粒体提供了正常的生理环境,是线粒体功能实现的前提[14]。 由于ROS能改变线粒体通透性,所以少量的ROS对于细胞正常生理功能和细胞代谢调节具有重要作用,但高浓度的ROS就会诱发氧化应激,损伤线粒体DNA,造成线粒体DNA突变或缺失,ATP生成减少,线粒体膜上离子交换通道破坏,膜电位消失等,导致卵母细胞老化[15]。SOD是生物体内一种重要的抗氧化酶,可以清除ROS,故ROS含量及SOD活性也是评价生物体能量代谢的指标之一[16]。经本实验研究证实,随着小鼠年龄增大,卵母细胞线粒体数目减少、膜电位变化减弱,产生的ATP减少、ROS增加,SOD酶活性降低,AMPKα、p-AMPKα、PGC-1α蛋白表达降低。在此过程中,SOD酶活性降低不能清除线粒体氧化磷酸化产生的多余ROS,线粒体膜电位异常,且AMPKα、p-AMPKα、PGC-1α蛋白表达降低影响了线粒体增生。线粒体损伤严重、增生受阻,破坏了线粒体稳态,线粒体产生的ATP减少不能供给正常的细胞代谢所需,最终导致细胞能量代谢下降、氧化应激状态减弱,卵母细胞成熟受阻,第一极体排出障碍。
中医认为肾虚肝郁是卵巢功能下降的基本病机。由于现代女性生活、工作压力较大,生育之心不遂,久而致郁,肝郁气滞,日久成瘀,血瘀为实,阻塞胞宫胞络。肾精是产生月经的物质基础,精血同源,肾精不足,精亏血少,则冲任血虚,胞宫胞脉失养,故经水难下,胎孕难成,治宜补肾调肝。据此,国家级名老中医金哲教授自拟经验方乌萸汤。方中山茱萸温能通行、辛能走散、酸能入肝,乌药温肾散寒,能够补益肝肾,以益其源,共为君药。菟丝子、肉苁蓉温肾益精,取阳中求阴,阴得阳生之意,共为臣药;佐以丹参、鸡血藤养血活血,香附疏肝理气开郁。诸药共用补肾以助先天、调肝以畅气血,共奏补肾调肝之效而达调经种子目的。
本课题组前期研究显示,乌萸汤可提高卵巢不敏感综合征模型小鼠血清雌激素水平,降低促卵泡生成素、促黄体生成素水平,上调卵巢抑制素B及卵泡抑素水平,下调激活素水平,有效改善卵巢功能[17-18]。本实验研究发现,与高龄组相比,乌萸汤组小鼠卵母细胞第一极体排出率增加、线粒体数量增多、ATP含量上升、SOD酶活性增强,p-AMPKα、AMPKα及PGC-1α蛋白表达量增加,说明了乌萸汤能够通过改善卵母细胞线粒体能量代谢及氧化应激反应提高卵母细胞质量。
此外,目前关于卵母细胞的线粒体研究主要集中在动物层面,即治疗后取卵,但控制性超促排卵的使用使得多胎妊娠和卵巢过度刺激综合症的发病率明显上升[19]。为了避免此类医源性并发症的发生,部分学者主张采用IVM技术为卵泡发育异常的患者提供治疗途径[20]。本实验采用取卵后治疗的方式,将IVM技术运用在卵细胞体外培养当中。
综上,本实验在IVM技术基础上,证实了乌萸汤能够通过影响高龄小鼠卵母细胞的线粒体功能,改善其能量代谢和氧化应激状态,促进卵母细胞成熟,可作为乌萸汤应用于IVM技术中提高卵母细胞质量的实验依据。
