脑电刺激和外周电刺激治疗慢性非特异性腰痛的镇痛效果
2021-06-24任英杰汪桂青赵美英薛宗贵朱智张晓燕杨楠楠
任英杰,汪桂青,赵美英,薛宗贵,朱智,张晓燕,杨楠楠
(郑州大学附属郑州中心医院,1.老年医学科;2.骨科,河南郑州 450000)
目前,慢性非特异性腰痛(chronic nonspecific low back pain,CNSLBP)尚无特异性干预措施,非甾体类抗炎药、骨骼肌松弛剂和阿片类药物等虽可缓解患者的疼痛,但长期服用易并发各种不良反应,非药物疗法引起临床广泛关注[1]。经皮神经电刺激(transcutaneous electrical nerve stimulation,TENS)源于传统针灸,镇痛效果与电针类似,对患者无创,广泛用于各种疼痛的治疗,但在CNSLBP中的应用结果尚存在争议[2]。研究显示,大脑机制改变参与CNSLBP慢性疼痛过程,神经影像学检查显示慢性肌肉骨骼疼痛患者存在大脑皮层结构和功能改变[3]。单纯外周TENS虽然可抑制大脑皮层兴奋性,但强度可能不足以改善外周和大脑的中枢疼痛调节作用。经颅直流电刺激(transcranial direct current stimulation,tDCS)是非侵袭性经颅刺激方法,可有效缓解疼痛,但其联合TENS是否可增强对CNSLBP的疼痛控制效果目前尚不明确[4]。本研究探讨tDCS和TENS联合对CNSLBP的镇痛效果,现报告如下。
1 资料与方法
1.1 一般资料
选择2018年3月~2020年3月在本院就诊的CNSLBP患者作为研究对象,纳入标准:①符合CNSLBP的诊断标准[5];②年龄18~65岁之间;③入组前6个月内未接受过TENS、tDCS治疗、电针治疗;④患者对研究知情并签署知情同意书。排除标准:①数字评分量表(numeric rating scale,NRS)疼痛程度<4分者;②既往有脊柱手术史者;③椎间盘突出伴神经损害者;④有起搏器或其他植入装置者;⑤孕期或哺乳期女性;⑥精神病或类风湿性疾病者;⑦吸烟或滥用药物、酒精摄入成瘾者。共纳入患者102例,采用随机数字表法分为TENS组、tDCS组和联合组各34例。TENS组男11例,女23例;年龄26~62岁,平均(42.14±11.87)岁;体质量指数16.9~28.6 kg/m2,平均(22.92±3.08)kg/m2;病程(2.87±1.48)年。tDCS组男13例,女21例;年龄25~65岁,平均(40.93±12.87)岁;体质量指数17.3~28.5 kg/m2,平均(23.08±3.14)kg/m2;病程(2.91±1.36)年。联合组男12例,女22例;年龄26~61岁,平均(41.13±10.67)岁;体质量指数17.1~28.5 kg/m2,平均(23.21±3.69)kg/m2;病程(2.85±1.38)年。三组患者的性别、年龄、体质量指数、病程等基线资料差异均无统计学意义(P>0.05),有可比性。
1.2 研究方法
TENS组给予经皮直流电刺激治疗,采用韩氏HANS-100A疼痛治疗仪,将电极贴片固定于腰椎疼痛节段两侧相应夹脊穴或阿是穴,用2 Hz波连续刺激30 min,1次/d,每周治疗3次,共治疗4周。tDCS组给予经颅直流电刺激,采用IS200型智能刺激仪,参照国际10-20系统脑电极分布图确定电极贴敷区域,阳极置于C3-C4区域(与疼痛主诉相对应),阴极置于眶上同侧区域,直流电强度2 mA(密度为57 μA/cm2),20 min/次,1次/d,每周治疗3次,共治疗4周。联合组给予TENS联合tDCS治疗,治疗方法和疗程同前两组。
1.3 观察指标
观察三组患者治疗前后的疼痛程度、功能障碍程度和脊柱活动度。疼痛程度采用NRS和口述评分法(verbal rating scale,VRS)两种方式评估:NRS将疼痛分为0~10共11个数字,0表示无痛,10代表极度疼痛,患者挑选一个数字作为自己的疼痛程度;VRS是提供无痛、轻度疼痛、中度疼痛、重度疼痛、极度疼痛5个选项,分别得分0~4分,患者选择1项作为疼痛程度。功能障碍程度采用Oswestry功能障碍指数(oswestry disability index,ODI)和Roland-Morris功能障碍(Roland Morris dysfunction questionnaire,RMDQ)调查表评定,均为分值越高则功能障碍程度越严重。
1.4 统计学方法
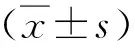
2 结果
三组患者治疗后的NRS、VRS、ODI和RMDQ评分均较治疗前显著降低(P<0.05);治疗后组间比较,联合组的4项指标改善情况均显著优于TENS和tDCS组,TENS组显著优于tDCS组,差异均有统计学意义(P<0.05)。见表1。
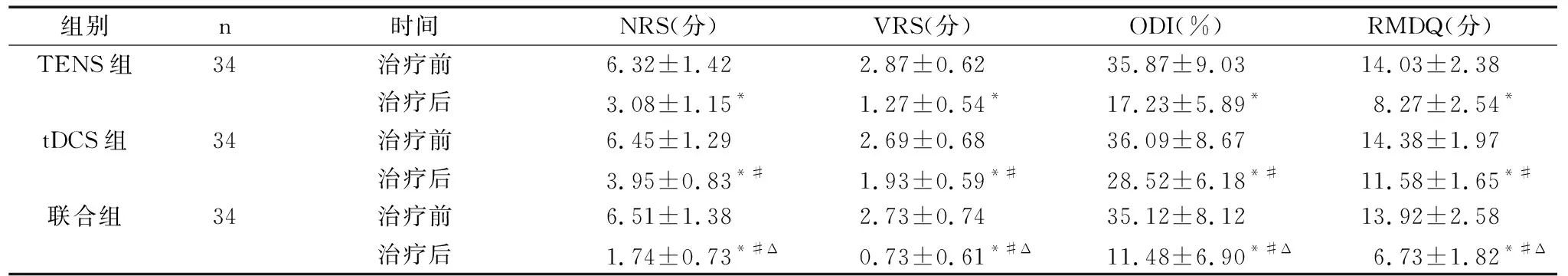
表1 三组患者治疗前后疼痛程度相比较(分)
3 讨论
研究显示,慢性腰痛与背外侧前额叶皮质、右侧丘脑灰质减少及初级体感皮质重塑相关,而CNSLBP患者的疼痛及不适强度逐渐增加与脑干和体感皮层灰质减少相关[6]。针对疼痛处理区域的脑结构治疗,可能是阻断和减少疼痛信号的有效方式。tDCS作为非侵入性脑刺激技术,已被用于各种慢性疼痛的治疗,但其单独应用缓解疼痛的效果存在争议,有学者建议将tDCS与其他治疗疼痛的方式相结合,以实现治疗的协同和叠加效应,提高临床疗效[7]。本研究显示,与TENS和tDCS+TENS相比,tDCS单独应用时镇痛和改善腰部功能的效果最差。目前tDCS对慢性疼痛的疗效存在相互矛盾的报道,Mariano等[8]研究显示,tDCS可缓解慢性下腰痛患者的疼痛强度;但Wrigley等[9]认为tDCS不能减轻脊髓损伤后的病理性疼痛。影响皮层兴奋性的内在和外在因素,均可能影响tDCS诱发的神经元兴奋性和可塑性变化,不同个体间异质性较大[10]。既往研究显示,单次tDCS+TENS、tDCS、TENS的疼痛改善效果持续时间约为3 d[11],因此本研究参照国外研究方案,采用每周治疗3次,而不是每周5次治疗,治疗方案的改变是否会影响单独tDCS的临床效果尚需要进一步研究探讨。
TENS激活复杂神经网络通过一系列神经递质和受体促进局部镇痛。研究显示,tDCS和TENS均可调节初级运动皮质的神经元活动[12-13],这些区域涉及到疼痛处理相关的重要区域如丘脑、扣带回皮质和中脑导水管周围灰质,联合应用tDCS和TENS理论上具有协同作用,但国内尚缺乏二者联合在CNSLBP中的应用报道[14]。本研究显示,tDCS+TENS对CNSLBP患者疼痛和功能障碍的改善效果优于单独TENS和tDCS治疗。对手臂神经源性疼痛的干预显示,tDCS联合TENS治疗后疼痛较单独应用至少缓解37%[15]。对复发性腰椎疼痛的研究显示,tDCS联合TENS可减少25%的疼痛评分[16]。综合本研究及既往研究,笔者认为tDCS和TENS联合作用可增强镇痛效果。
tDCS+TENS的协同机制尚不明确,这种协同效应可能由脑可塑性介导,M1区上的tDCS阳极可通过兴奋效应增加运动诱发电位,感觉水平的TENS则降低运动诱发电位和皮层兴奋性,TENS的抑制性干预和tDCS的兴奋性效应相结合可通过稳态可塑性增强提高M1的神经元兴奋性和镇痛效果[17]。闸门控制学说认为,脊髓背角的胶质细胞中有类似闸门的神经调节机制,神经冲动引发知觉和痛觉闸门开放,TENS可抑制疼痛信号对脊髓背角投身神经元的兴奋作用,即关闭疼痛闸门,减少伤害性冲动向中枢传导,减轻疼痛[18]。tDCS治疗时,极化电流能够诱导神经元膜电位及细胞和纤维的兴奋性,刺激扣带回皮质中部和导水管周围灰质内源性阿片类物质发挥作用,tDCS联合TENS治疗可能通过不同机制增强疼痛缓解效果[19]。
综上所述,本研究显示,tDCS联合TENS可有效缓解CNSLBP患者的疼痛程度,改善腰部功能状态,鉴于单独应用tDCS对CNSLBP患者疼痛缓解和功能改善的效果差于TENS和tDCS+TENS,在新的证据未被报道前,笔者不建议单独应用tDCS治疗CNSLBP。
