曲妥珠单抗联合DP化疗方案治疗HER2阳性表达乳腺癌患者的疗效及血清T淋巴细胞亚群水平分析*
2021-06-24吴晓婷
曾 茹 吴晓婷 郭 敬
厦门大学附属第一医院肿瘤内科,福建省厦门市 361001
乳腺癌是女性常见的恶性病变,发病年龄多在40~60岁,约占女性全部恶性肿的瘤25%,并呈上升趋势,据统计每年约100万女性确诊乳腺癌[1]。人表皮生长因子受体2(HER2)受体同源/异源二聚化激活中下游细胞信号通路传导,改善细胞的生长、增殖、分化与凋亡,据悉,20%~30%乳腺癌存在HER2基因过表达,而其过表达和乳腺癌细胞强侵袭性、不良预后存在密切关联性[2]。故治疗乳腺癌重要靶点为HER2,为临床治疗乳腺癌提供新方向。本文选取我院接收的HER2阳性表达乳腺癌患者96例进行分组,前瞻性分析曲妥珠单抗联合多西他赛+卡铂(DP)化疗方案的疗效,报道如下。
1 资料和方法
1.1 一般资料 前瞻性选取2017年1月—2020年5月我院接收的HER2阳性表达乳腺癌患者96例,依据SPSS随机编号法分为研究组和对照组,各48例。研究组患者年龄36~69岁,平均年龄(52.13±7.94)岁,肿瘤类型:导管癌34例、小叶癌6例、其他8例,临床分期为:ⅡA期13例、ⅡB期14例、ⅢA期10例、ⅢB期7例、Ⅳ期4例;对照组患者年龄38~71岁,平均年龄(54.37±8.06)岁,肿瘤类型:导管癌31例、小叶癌7例、其他10例,临床分期为:ⅡA期11例、ⅡB期16例、ⅢA期13例、ⅢB期6例、Ⅳ期2例。两组一般资料均衡可比(P>0.05)。本研究经我院伦理委员会审核通过。
1.2 选择标准 纳入标准:经病理穿刺活检诊断为乳腺癌;经相关检查确认肿瘤细胞内HER2阳性表达者;预计生存时间>3个月者;初诊者;知情本研究,且签署书面同意书者;卡氏评分(KPS)≥60分者。排除标准:伴重要脏器功能衰竭者;放疗与化疗史者;其他恶性肿瘤者;存在肿瘤转移者;无法耐受者;治疗依从性较差者。
1.3 方法 对照组接受DP化疗方案治疗。取100mg卡铂(辰欣药业股份有限公司,国药准字H20059008)与10ml 5%葡萄糖溶液混匀制作为10mg/ml溶液,后加入500ml葡萄糖溶液中混匀后,静脉滴注,AUC=5~6,滴速5mg/(ml·min);静滴75mg/m2多西他赛(扬子江药业集团有限公司,国药准字H20174009);3周为1个周期,每周期第1天静滴卡铂、多西他赛;4个周期为1疗程。研究组基于对照组加用曲妥珠单抗(F.Hoffmann-LaRocheAG,批准文号S20150067)治疗,静脉滴注,具体剂量依患者实际体质量调节,首次剂量为8mg/kg,之后均为6mg/kg,1次/3周。两组均持续治疗1个疗程(3个月)。
1.4 观察指标 (1)评价标准:肿瘤病灶消失为完全缓解;病灶长径较治疗前减少≥30%为部分缓解;病灶长径比治疗前减少<30%,但增加<20%为稳定;病灶长径较治疗前增加≥20%为进展。总有效率=部分缓解率+完全缓解率。(2)肿瘤标志物:取3ml空腹静脉血,高速离心取血清,放射免疫吸附法测血清癌胚抗原(CEA)、糖类抗原12-5(CA12-5)水平;统计两组治疗前后CEA、CA12-5水平,并予以对比。(3)T淋巴细胞亚群:利用免疫荧光法检测血清CD3+、CD4+、CD4+/CD8+水平,试剂盒由上海晶抗生物工程有限公司制造;统计两组治疗前后血清CD3+、CD4+、CD4+/CD8+水平并对比。(4)B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2-Associated X的蛋白质(Bax):利用穿刺针收集肿瘤标本以制备细胞悬液,取RNA,PCR基因扩增剂经RT-PCR法行Bax、Bcl-2扩增,获得凝胶图像,后定量分析Bax、Bcl-2水平表达;统计两组治疗前后Bcl-2、Bax水平。

2 结果
2.1 两组临床疗效对比 研究组总有效率为87.50%,较对照组的60.42%高(χ2=9.140,P=0.003<0.05),见表1。
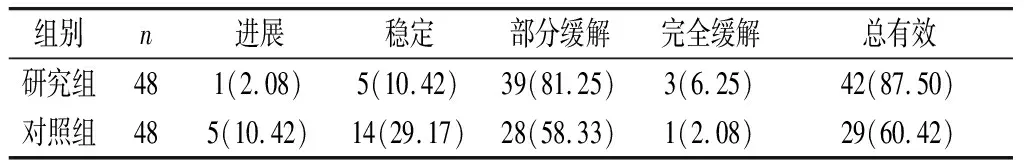
表1 两组临床疗效对比[n(%)]
2.2 两组T淋巴细胞亚群水平对比 治疗前,两组CD3+、CD4+、CD4+/CD8+水平对比差异不显著(P>0.05);治疗后,两组CD3+、CD4+、CD4+/CD8+水平均低于治疗前(P<0.05),但研究组高于对照组(P<0.05),见表2。
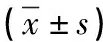
表2 两组T淋巴细胞亚群对比
2.3 两组治疗前后肿瘤标志物水平对比 治疗前两组CEA、CA12-5水平对比差异不显著(P>0.05);治疗后两组CEA、CA12-5水平均低于治疗前(P<0.05);且研究组低于对照组(P<0.05),见表3。
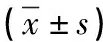
表3 两组治疗前后肿瘤标志物水平对比
2.4 两组治疗前后Bax、Bcl-2水平对比 治疗前两组Bcl-2、Bax对比差异不显著(P>0.05);治疗后两组Bcl-2均低于治疗前,Bax均高于治疗前(P<0.05),且研究组Bcl-2低于对照组,Bax高于对照组(P<0.05),见表4。
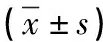
表4 两组治疗前后Bax、Bcl-2基因表达水平对比
3 讨论
乳腺癌是妇科最常见的恶性肿瘤之一,调查结果指出,我国2014年乳腺癌发病率达41.82/10万[3]。据悉,全球范围内乳腺癌5年生存率具有区域性,我国约80.40%,2014年病死率达9.90/10万[4]。临床常见的乳腺癌治疗方式为化疗,但其可损害机体正常细胞,致口腔黏膜反应、血小板下降等,下调免疫功能,甚至引发化疗不耐受即感染性病变等,影响化疗效果。故需寻找更有效的治疗方案。
本研究结果显示,研究组总有效率高于对照组,治疗后两组CD3+、CD4+、CD4+/CD8+水平均低于治疗前,但研究组高于对照组(P<0.05)。曲妥珠单抗能选择性作用HER2受体,激活细胞HER2受体胞吞反应,加快肿瘤细胞凋亡与坏死,还可诱导肿瘤细胞P27基因呈高表达状态,阻断HER2的信号转导途径,使肿瘤细胞终止于DNA合成前期,从而抑制病情恶化与阻止病灶扩散。此外,曲妥珠单抗可诱发细胞毒效应,汇集免疫细胞,改善免疫细胞平衡。故曲妥珠单抗辅助DP化疗治疗可提高治疗效果,减缓免疫功能下降速度。
基因可控制正常细胞自主死亡,但恶性肿瘤细胞死亡失控,Bcl-2为凋亡抑制基因,表达过度能抑制细胞凋亡;Bax使促凋亡基因和Bcl-2蛋白合成,分泌异源二聚体,下调Bcl-2抑制凋亡作用[5]。此外,肿瘤标志物(CA12-5、CEA等)是恶性肿瘤细胞分泌异常物质,和恶性肿瘤发生与发展关系密切[6-7]。本研究结果显示,治疗后两组CEA、CA12-5、Bcl-2均低于治疗前,Bax均高于治疗前,且研究组的CEA、CA12-5、Bcl-2低于对照组,Bax高于对照组(P<0.05)。曲妥珠单抗应用于乳腺癌治疗中,能改善Bax、Bcl-2水平表达,加快肿瘤细胞凋亡,进而降低CEA、CA12-5水平,利于病情转归。
综上所述,曲妥珠单抗联合DP化疗方案治疗HER2阳性表达乳腺癌患者效果确切,可下调肿瘤标志物水平,减缓免疫功能下降速度,改善Bcl-2、Bax基因表达水平。
