人绒毛膜促性腺激素对母驴促排卵效果的研究
2021-06-23唐斯嘎韩乌兰图雅娜仁花马跃军赵俊利吴海青
唐斯嘎,韩乌兰图雅,娜仁花,马跃军,赵俊利,吴海青
(1.内蒙古农业大学,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031)
驴是一种发情期和妊娠期较长的单胎动物。在生产实践中, 准确掌握母驴的排卵时间以及对其进行输精的时间难度较大。 母驴发情持续期平均为(6.0±2.1)d,发情结束前(0.7±0.7)d 发生排卵[1]。 卵泡发育受下丘脑—垂体—卵巢轴激素协调控制, 促卵泡素 (follicle-stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)在卵泡发育过程中起协同作用, 共同促进卵泡发育并排卵[2]。 FSH 与LH 的共同作用对卵泡成熟、雌激素分泌、排卵、黄体生成和维持、孕激素分泌有促进功效[3]。 母驴排卵后形成黄体,如果母驴妊娠,其黄体会保持体积和功能;如果没有妊娠,其黄体会逐渐退化[4-5]。
驴是季节性多次发情动物[6],但繁殖率低,并且卵泡发育至排卵所需的时间较长, 导致母驴的发情周期较长,很难准确把握其排卵时间,容易延误最佳配种时机[7]。 精确预测母驴的排卵时间,可以从根本上提高受胎率。 激素诱导发情及排卵技术在提高家畜繁殖效率以及提升畜牧业经济效益中发挥重要作用。 人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)是一种常用的外源促排卵激素,其作用与LH 相似。 hCG 可促进卵泡发育和成熟, 效果优于LH。 hCG 还能促进孕酮(progesterone,PROG)和雌二醇(estradiol,E2)的分泌[8-9],提升卵子质量并提高受胎率[10]。该研究通过使用不同剂量的hCG 对母驴进行处理,考查对不同直径卵泡发育的影响, 并评价对母驴受胎情况及血清生殖激素水平的影响, 为开发母驴促排卵技术以及提高母驴繁殖率提供参考。
1 材料与方法
1.1 试验时间及地点
该试验于2019 年6—8 月在内蒙古草原御驴科技牧业有限公司驴场进行。
1.2 试验动物
选择优势卵泡直径在30~35 mm 以及大于35 mm 的母驴各30 头。 驴卵巢观察和卵泡直径测量工具为兽用B 超仪。 选取的60 头母驴身体健康、发情正常、生殖机能正常。
1.3 试验分组及处理
将优势卵泡直径为30 ~35 mm 以及大于35 mm 的2 个群体的母驴各分为3 组(A、B、C 组和D、E、F 组),每组10 头。 2 个群体各自的3个组别中, 均包括1 个500 IU/头hCG 处理组、1个1 000 IU/头hCG 处理组以及1 个不进行hCG处理的对照组(见表1)。 采用肌肉注射方法对母驴进行hCG 处理。 母驴在试验期间按正常饲养方式饲养。

表1 试验分组及hCG 处理
1.4 卵泡发育观察及排卵率测定
各组母驴接受hCG 处理后,每隔24 h 进行1次B 超检查,观察、测量卵泡直径并记录,直到排卵;观察各组母驴在hCG 处理后不同监测时间点的排卵情况,记录各组发生排卵的母驴数量,计算排卵率。
1.5 人工输精及受胎率测定
对所有试验母驴进行人工输精。 采集驴场配种公驴精液, 将接精杯内的精液用消毒后的精液滤纸过滤到31 ℃水浴预热的灭菌烧杯内,用显微镜检查精液品质。 按比例将31 ℃水浴预热的稀释液沿杯口慢慢倒入装有品质合格原精的烧杯。 保定受配母驴,用35 ℃温开水冲洗外阴3 次,再对外阴部进行消毒, 消毒后用35 ℃温开水冲洗3遍,并用消毒纱布拭干。 输精时,输精员站在母驴后侧方,戴消毒一次性长臂手套握住输精管,五指形成锥形,缓缓送入母驴阴道,捋顺宫颈口后将输精管缓缓送入子宫,穿过子宫颈5~10 cm 处,并输入精液。 于输精后第18 天进行孕检。 记录各组受胎母驴头数,计算受胎率。
1.6 血清中E2 和PROG 水平测定
于hCG 处理后0、24、48、72 h 分别对各组母驴进行颈动脉采血,每头采集血样5 mL,直到排卵。 采血后离心分离血清,并冷冻保存。 利用高效液相色谱法检测E2和PROG 水平。
1.7 数据统计分析
利用Excel 软件进行数据整理。
2 结果与分析
2.1 hCG 对母驴卵泡发育的影响
由表2 可知,总体来看,2 个群体母驴卵泡直径随hCG 注射剂量的增加而增大。E 组母驴(优势卵泡直径大于35 mm)在hCG(1 000 IU/头)处理后48 h 多数排卵,未测定。
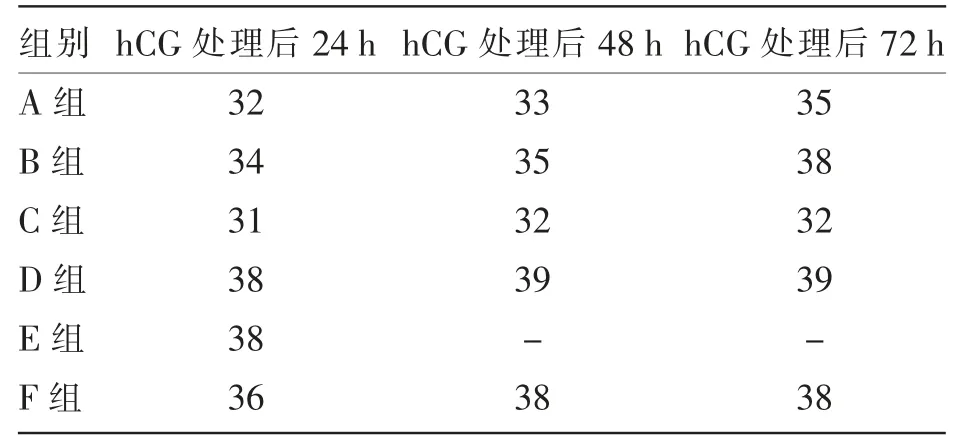
表2 hCG 处理对母驴卵泡直径的影响 单位:mm
2.2 hCG 对母驴排卵率的影响
由表3 可知,hCG 处理24 h 后, 优势卵泡直径为30~35 mm 的母驴 (A、B、C 组) 均未出现排卵;优势卵泡直径大于35 mm 的母驴群体中,500、1 000 IU/头hCG 处理组(D 组和E 组)分别有1 头和2 头母驴排卵,排卵率分别为10%和20%,而对照组(F 组)母驴没有排卵,排卵率为0。
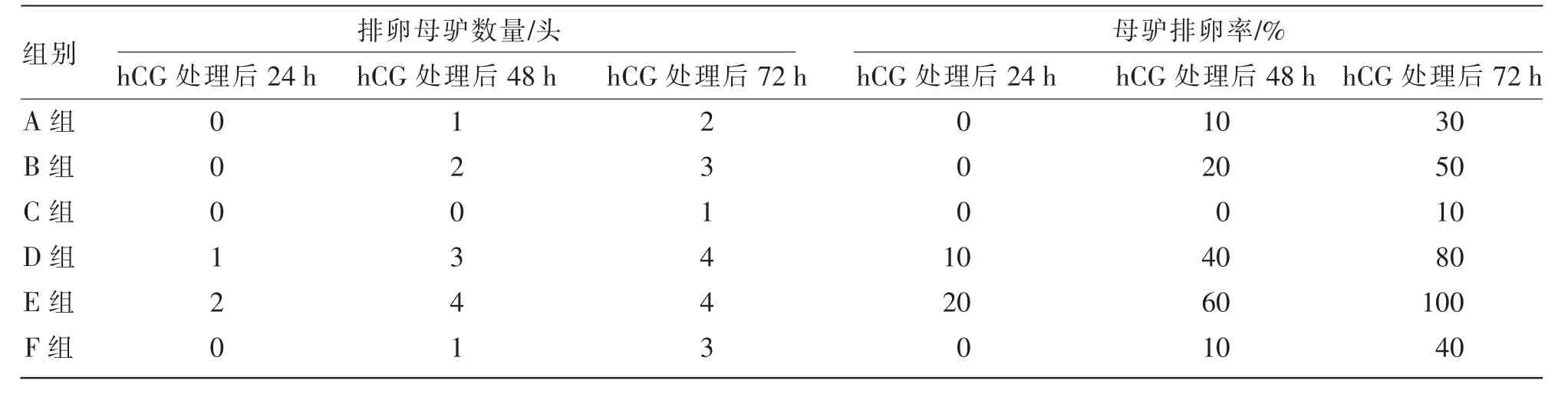
表3 hCG 处理对母驴排卵的影响
hCG 处理48 h 后,优势卵泡直径为30~35 mm的母驴群体中,500、1 000 IU/头hCG 处理组(A 组和B 组)分别有1 头和2 头母驴排卵,排卵率分别为10%和20%,而对照组(C 组)母驴没有排卵,排卵率为0; 优势卵泡直径大于35 mm 的母驴群体中,500、1 000 IU/头hCG 处理组(D 组和E 组)分别有3 头和4 头母驴排卵, 排卵率分别为40%和60%,而对照组(F 组)仅有1 头母驴排卵,排卵率仅为10%。
hCG 处理72 h 后,优势卵泡直径为30~35 mm的母驴群体中,500、1 000 IU/头hCG 处理组(A 组和B 组)分别有2 头和3 头母驴排卵,排卵率分别为30%和50%,而对照组(C 组)仅有1 头母驴排卵, 排卵率仅为10%; 优势卵泡直径大于35 mm的母驴群体中,500、1 000 IU/头hCG 处理组(D 组和E 组)均有4 头母驴排卵,排卵率分别为80%和100%,而对照组(F 组)有3 头母驴排卵,排卵率为40%。
优势卵泡直径大于35 mm 的母驴, 在接受2个剂量的hCG 处理后,与对照相比,排卵更快。 此外,优势卵泡直径不同的2 个母驴群体,hCG 处理48 h 后排卵母驴数和排卵率与对照组相比均有所提高。综上表明,hCG 处理对母驴具有明显的促排卵作用。
2.3 hCG 对母驴受胎率的影响
由表4 可知,优势卵泡直径为30~35 mm 的母驴群体中,500、1 000 IU/头hCG 处理组(A 组和B组)的受胎数量分别为3 头和4 头,受胎率分别为30%和40%,对照组(C 组)的受胎数量为3 头,受胎率为30%。 优势卵泡直径大于35 mm 的母驴群体中,500、1 000 IU/头hCG 处理组(D 组和E 组)的受胎数量分别为4 头和5 头, 受胎率分别为40%和50%,对照组(C 组)的受胎数量为3 头,受胎率为30%。
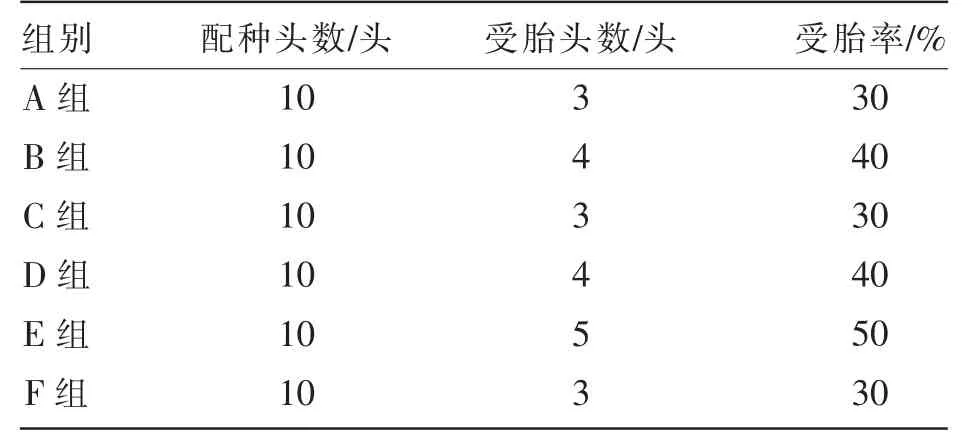
表4 hCG 处理对母驴受胎率的影响
总体来看, 在优势卵泡直径不同的2 个母驴群体中,接受hCG 处理的母驴,受胎率均高于对照组,同时,随着hCG 剂量的增加,受胎率有所提高。
2.4 hCG 对母驴血清中生殖激素水平的影响
2.4.1 优势卵泡直径在30~35 mm 的母驴经hCG处理后血清中E2 和PROG 水平的变化由图1可知,接受500 IU/头hCG 处理的母驴(A 组),血清中E2浓度在处理后0~48 h 内呈增加趋势,而处理后72 h 的血清E2浓度较处理后48 h 时有所降低;接受1 000 IU/头hCG 处理的母驴(B 组),处理后24 h 的血清E2浓度较0 h 时有较大幅度的提升, 在处理后24~72 h 内血清E2浓度呈逐渐下降趋势;对照组(C 组)的血清E2浓度在0~72 h 内基本呈现稳步提升的趋势。
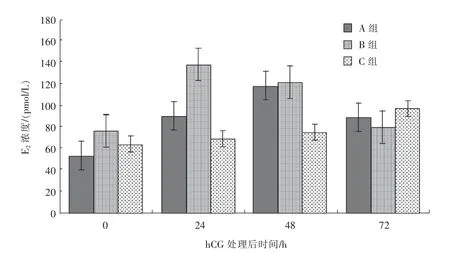
图1 hCG 处理对优势卵泡直径在30~35 mm 的母驴血清中E2 水平的影响
由图2 可知,接受500、1 000 IU/头hCG 处理的母驴(A、B 组),血清中PROG 浓度在处理后0~72 h 内呈逐渐升高的趋势,而对照组(C 组)的血清中PROG 浓度呈现先降低、后提高的趋势。总体来看,接受1 000 IU/头hCG 处理的母驴(B 组)血清中PROG 浓度的提升幅度较大。
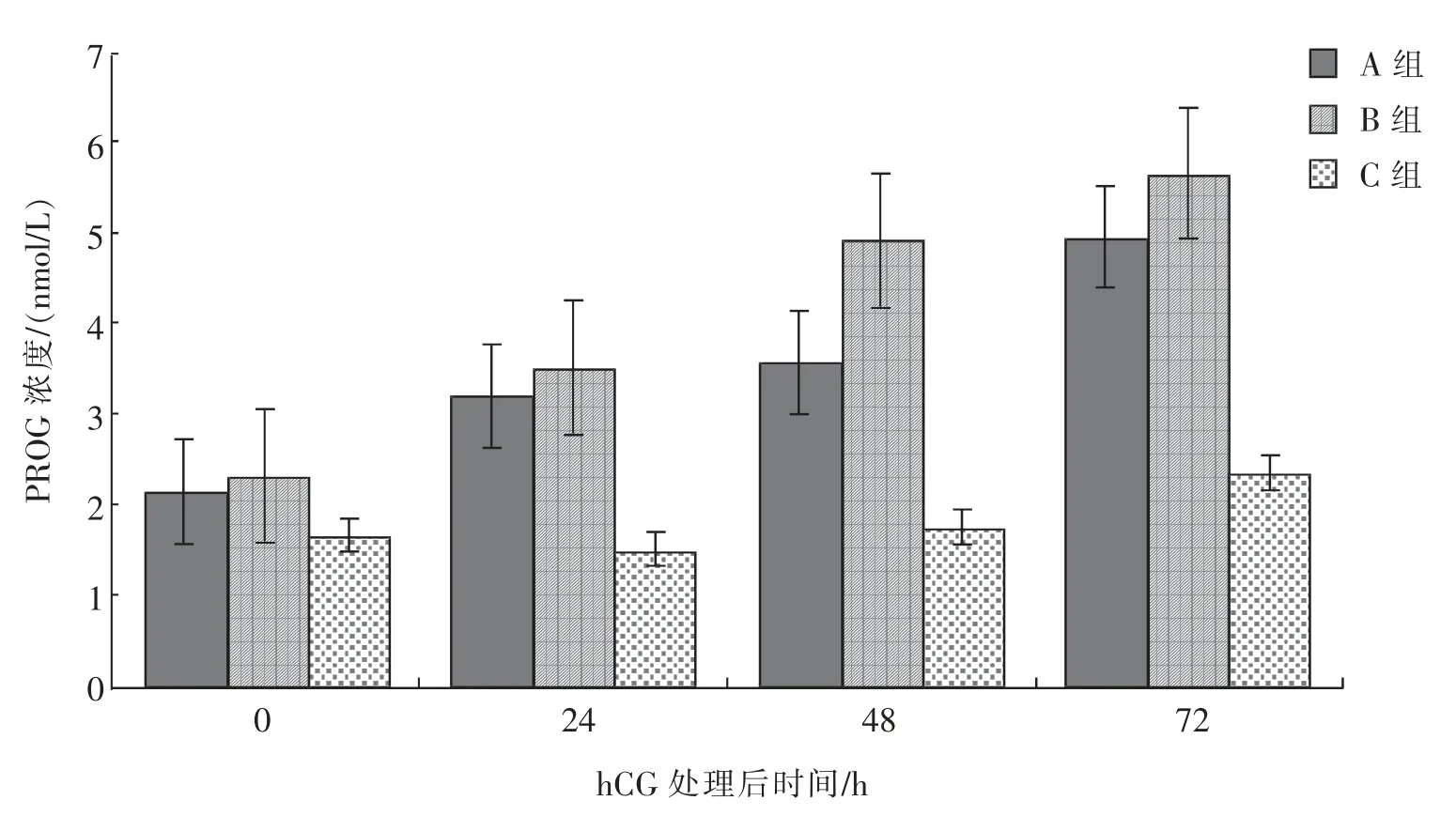
图2 hCG 处理对优势卵泡直径在30~35 mm 的母驴血清中PROG 水平的影响
2.4.2 优势卵泡直径大于35 mm 的母驴经hCG处理后血清中E2 和PROG 水平的变化由图3可知,接受500 IU/头hCG 处理的母驴(D 组),血清中E2浓度在处理后24 h 较0 h 时有所提升,在处理后24~72 h 内血清E2浓度呈逐渐下降趋势;接受1 000 IU/头hCG 处理的母驴(E 组),处理后24 h 的血清E2浓度较0 h 时有较大幅度的提升,在处理后24~72 h 内血清E2浓度呈逐渐下降趋势;对照组(F 组)的血清E2浓度在0~72 h 内基本呈现“下降—升高—下降”的变化趋势,整体变化幅度不大。
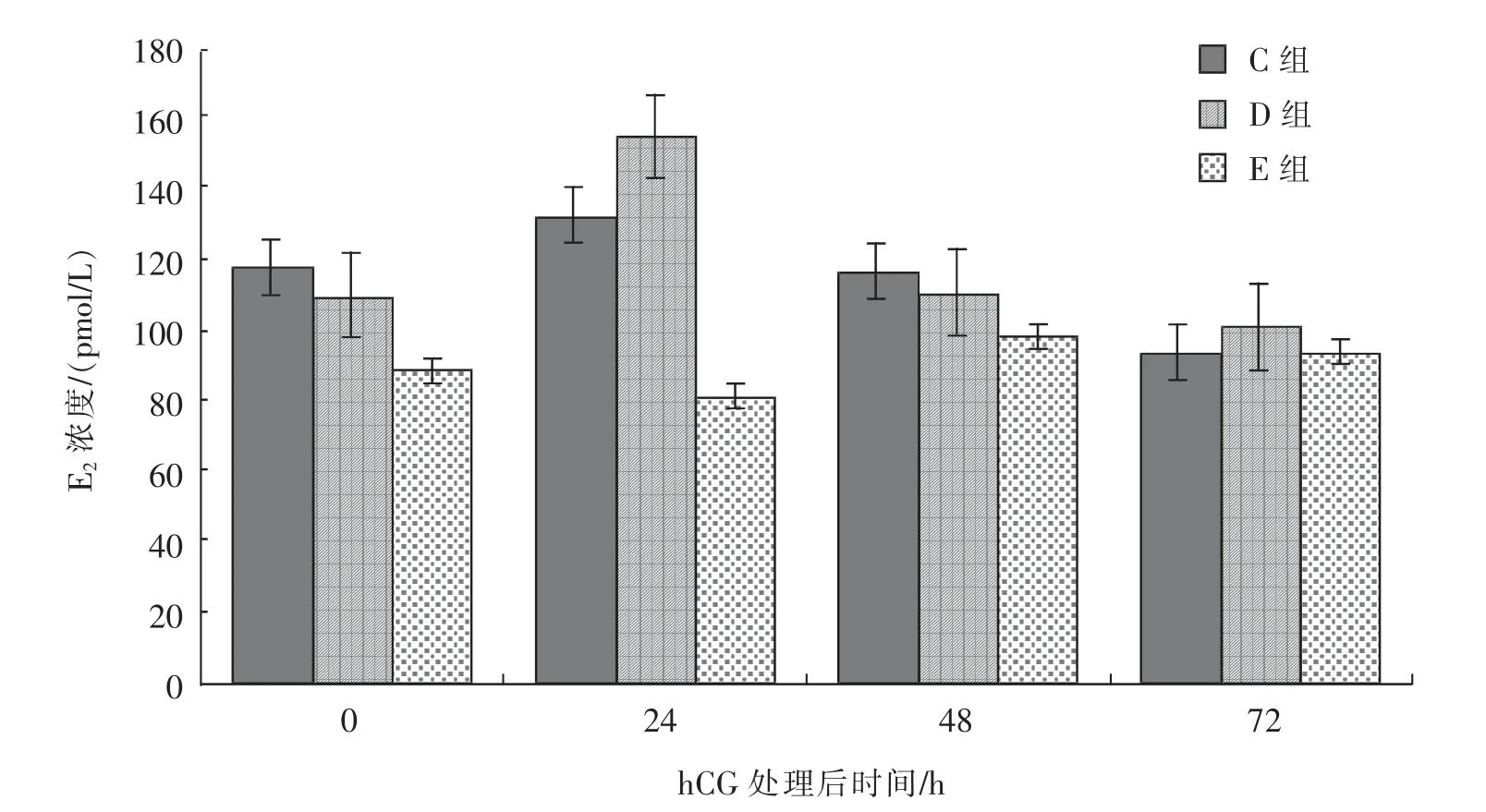
图3 hCG 处理对优势卵泡直径大于35 mm 的母驴血清中E2 水平的影响
由图4 可知,接受500 IU/头hCG 处理的母驴 (D 组), 血清PROG 浓度在处理后0~48 h内呈现逐渐提高的趋势, 而在处理后48~72 h,血清PROG 浓度趋于平稳,基本无变化;接受1 000 IU/头hCG 处理的母驴 (E 组), 血清PROG浓度在处理后0~24 h 和48~72 h 均出现较大幅度的提高;对照组(F 组)血清PROG 浓度在0~24 h 有小幅度提升, 在24~72 h 则有较大幅度的提高。
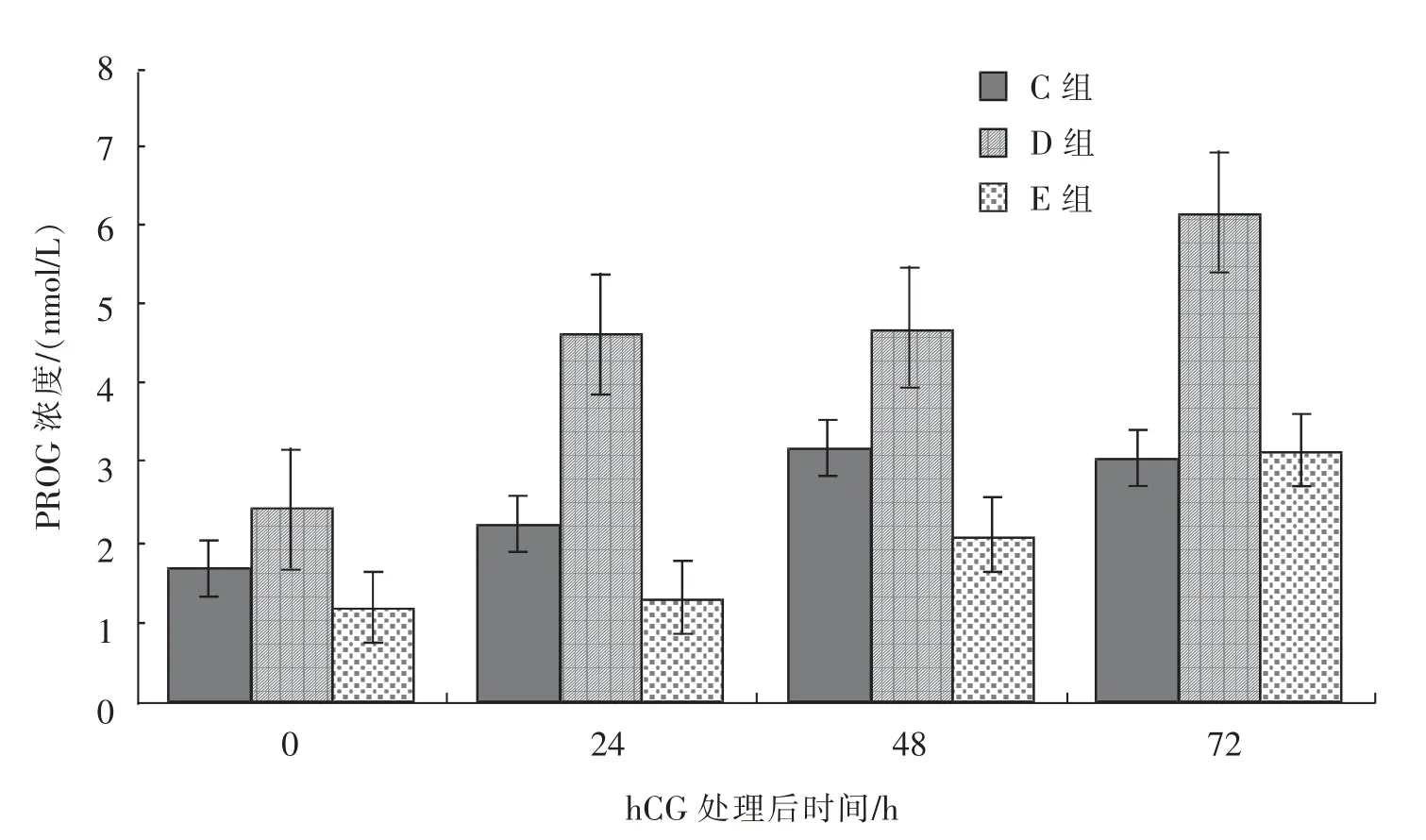
图4 hCG 处理对优势卵泡直径大于35 mm 的母驴血清中PROG 水平的影响
3 讨论
繁殖率低是影响驴产业发展的瓶颈问题,也是制约驴规模化、集约化养殖的主要因素。 目前,驴的繁殖率在40%~60%,远低于牛羊,主要原因是驴的繁育技术体系尚不完善,研究基础薄弱。同期发情及胚胎移植等繁殖技术在牛羊上的应用已经非常广泛, 这些技术利用外源激素对母畜卵泡发育的促进作用,有效提高了母畜生产性能,获得了显著的经济利益。 该研究对繁殖季节母驴注射外源激素hCG,可有效促进优势卵泡发育及排卵,也有利于提高受胎率。由此可知,hCG 在提升母驴繁殖性能方面具有一定的应用潜力。
大量研究证明hCG 可促进马属动物排卵。 张国庭[11]研究表明,利用hCG 对繁殖季节卵巢静止的3 匹母马进行处理,3~7 d 内出现发情的比例为100%;hCG 对于母马延迟排卵的治疗效果优于LH 和促排-3 号, 提示hCG 可有效增加卵泡发育速度,促排卵效果明显。该研究结果表明,hCG处理后母驴优势卵泡的直径明显增加, 比自然发育的卵泡发育速度快,与以上文献报道的结果一致。 Hannan 等[12]研究发现,当母马卵泡直径达到35 mm 时,注射hCG 可有效促进排卵,并提高受胎率。 Sieme 等[13]对卵泡直径为40 mm 的母马注射1 500 IU hCG 后,48 h 内排卵率为97.5%。Barbacini 等[14]对 卵 泡 直 径 为35 mm 的 母 马 注 射2 000 IU hCG 后,48 h 内排卵率达到90%,25~48 h的排卵率达到75%。 Chang 等[15]研究表明,当母驴优势卵泡直径达到35 mm 时, 肌肉注射hCG 后,有76%的母驴在24~48 h 内排卵。 该研究发现,在母驴优势卵泡直径达到35 mm 时,接受hCG 处理后48 h 内排卵率为60%,与以上研究结果相比较低,可能是由个体差异引起。 张永昌等[16]使用0.2 mg 前 列 腺 素F2α(prostaglandin F2α,PGF2α)对 非 繁殖季节母驴连续处理5 d, 第6 天使用500 IU 孕马血清促性腺激素 (pregnant mare serum gonadotropin,PMSG)进行处理,当优势卵泡直径达到35 mm 时使用1 500 IU hCG 进行处理, 具有较好的促排卵及受胎效果。 这一结果与该研究结果有相似之处, 但该研究中未使用PMSG 对母驴进行处理,主要原因是PMSG 对母畜的卵巢刺激较大。在该研究中,当母驴优势卵泡直径达到30 mm 时,对hCG 不够敏感,可能是该阶段影响卵泡发育的主导激素还是FSH,因此,与LH 功能相似的hCG受到抑制。 结合以往研究结果以及该研究结果不难发现,hCG 处理后卵泡排卵明显比自然排卵快,发情周期缩短, 表明hCG 可有效提高驴的受胎率,使排卵可控。
雌性动物在排卵前后都会出现E2分泌峰,峰值多出现在排卵前1~4 d 以及排卵后5~10 d。 吴帅帅[17]研究表明,母驴在排卵前2 d 和排卵后7 d各出现一个E2峰值。这与该研究结果相似。LH 是由腺垂体细胞分泌的一种糖蛋白类促性腺激素,可促进胆固醇在性腺细胞内转化为性激素。 hCG作为LH 的类似物, 可促进E2的分泌。 血清中的PROG 水平能反映黄体的活性。 体内的PROG 浓度会在排卵后4~6 d 开始增加,在10~17 d 达到峰值。 当PROG 持续保持在高水平时有助于维持母畜妊娠状态。 如没有发生妊娠,PROG 浓度开始下降[18-19]。 这与该研究结果类似:hCG 处理前后母驴血清中PROG 浓度无明显差异, 但随着排卵黄体逐渐形成,PROG 浓度在排卵后逐渐升高。 该研究证实hCG 作为LH 的类似物, 可促进E2和PROG的分泌。
马属动物因独特的卵泡发育机制, 导致人工干预繁殖技术难度较高。 繁殖技术人员需精确判断排卵时间才能有效提高驴的繁殖率。 该研究利用外源激素hCG, 提高了对母驴排卵时间预测的精确度,具有一定的应用潜力。
