切割小鼠X染色体的CRISPR/Cas9系统表达载体的构建及验证
2021-06-23谢绍怡蒋璐蔓杨晓峰张仙玉吴珍芳李紫聪
谢绍怡 蒋璐蔓 杨晓峰 张仙玉 吴珍芳 李紫聪
(华南农业大学动物科学学院 国家生猪种业工程技术研究中心,广州 510642)
性别控制即利用人为手段,控制动物后代性别比例向人们所希望的方向偏移[1]。实现性别控制可以有效减少畜牧生产上原材料的浪费,提高经济效益;同时,对于拯救濒危动物、减少伴性遗传疾病的发生等具有重要意义。
在自然繁殖条件下,孟德尔分离定律决定动物后代性别比例为1∶1,而其外部环境的改变则影响着动物实际性别比围绕着1∶1的比例上下波动[2]。由于环境因素对性别决定的作用机制尚未明确,关于这方面的性控研究均存在着重复性差、性别偏移程度较低的问题[3-5]。相反,在人为控制后代的遗传物质方面,却能取得了很好的性控效果,如流式细胞仪分选X/Y精子技术。它是使用Hoechst33342染料结合精子DNA,利用了X/Y精子DNA含量的差异,识别其结合染料的荧光强度,从而对精液进行分选。研究表明,适当浓度的Hoechst33342染料对精子活力等不会造成显著影响[6],且使用分选后的精液进行人工授精其怀孕率、产犊数、初生重等与普通精液相比无显著差别[7]。目前最新的流式细胞仪每秒可以分离8 000个精子,其X精子的分离纯度可达到90%以上,Y精子纯度可达到85%以上[8]。然而,流式细胞仪价格昂贵,技术要求高,且其分选速率很难满足猪等单次输精量很大的动物人工输精量的要求,故该技术现今主要应用于牛、羊业的生产上,难以在其他动物上推广应用。
近年,Galizi等[9-10]在蚊子上作出了一项创新性的性控研究,其通过转基因的方式在雄性减数分裂后期特异性切割X染色体,阻止X精子的形成,使后代中雄性的比例平均能够达到90%以上。该研究成功的关键在于:分别构建的内切核酸酶I-PpoI和CRISPR/Cas9系统的表达载体,这些载体可以切割仅在X染色体上发现的核糖体DNA(rDNA)重复序列内的保守序列,并最终能够达到X染色体整体失活的效果。遗憾的是,哺乳动物体内并不存在类似的核酸酶和rDNA序列。然而,CRISPR/Cas9系统作为目前较为成熟的一种基因编辑工具,在靶位点的选择上具有很高的灵活性,是代替内切核酸酶I-PpoI的一个理想选择。根据上述研究思路,我们可以利用CRISPR/Cas9系统,在不同动物上设计多个靶向性染色体上的sgRNA,删除一条性染色体,以减少某一性别的精子或胚胎,在哺乳动物上实现性别控制。
本研究设计并构建了靶向小鼠X染色体的CRISPR/Cas9系统表达载体,在体外、细胞及胚胎水平验证其切割效果,为制备只生产Y精子的转基因小鼠及小鼠胚胎注射提供载体基础,为进一步利用基因编辑技术控制大型哺乳动物后代性别比例的相关研究打下基础。
1 材料与方法
1.1 材料
实验所用的pKMV质粒由华大基因合成提供;载体一为杨晓峰构建并由本实验室保存[11];MLTC-1细胞购自中科院上海细胞库;C57BL/6雌鼠由广东省医学实验动物中心提供。
限制性内切酶FseI购自NEB公司,MluI购自TaKaRa公司;T4连接酶购自赛默飞公司。去内毒质粒小提试剂盒E.Z.N.ATMEndoFree Plasmid Mini Kit;sgRNA 体外转录试剂盒 Gene ArtTMPrecision gRNA Synthesis Kit、Cas9 蛋白和荧光定量试剂 Power SYBRTMGreen Master Mix购 自 Life公 司;DL2000、DL10000 DNA Marker,6×DNA Loading Buffer,2×RNA Loading Buffer 购自北京全式金生物技术有限公司;RPMI 1640培养基、胎牛血清(FBS)、0.25%Trypsin、DPBS均购自Gibico公司。
1.2 方法
1.2.1 靶位点的选择及其对应sgRNA的设计 对小鼠的X染色体进行深度测序,挑选出其中拷贝数多于50的重复序列备用。然后利用CRISPR/Cas9靶序列在线设计软件分析备选序列,并在NCBI基因库中与小鼠的全基因组序列进行比对,选择合适的靶位点及其sgRNA。
1.2.2 CRISPR/Cas9系统共表达载体的构建 根据所选择的sgRNA序列,设计具有如下结构的序列:MluI-loxP-U6 promoter-sgRNA X1-U6 promoter-sgRNA X3-loxP2272-FseI。由深圳华大基因公司合成对应的基因片段,并利用MluI和FseI双酶切的方法将上述基因片段连接到载体pKMV中,即得sgRNA片段合成质粒。分别取1 μg的载体一(本课题组保存)和sgRNA片段合成质粒,利用MluI和FseI两种酶进行双酶切。然后将酶切后的载体和目的片段回收,使用T4连接酶在22℃环境中连接1 h。最后经转化、涂板,挑取单克隆操作后,交由华大基因公司进行测序验证。构建好的CRISPR/Cas9系统共表达载体命名为CMV载体。
1.2.3 sgRNA X1和sgRNA X3体外转录及体外切割验证 根据靶位点X1和X3的核苷酸序列分别对应设计引物,以MLTC-1细胞的DNA为模板,通过PCR扩增,得到靶片段X1和靶片段X3,PCR引物如表1所示。同时将构建好的CMV载体菌液扩大培养后抽提质粒,用该质粒作为模板,使用表2中的引物进行PCR扩增,得到sgRNA X1体外转录模板和sgRNA X3体外转录模板。使用GeneArtTMPrecision gRNA Synthesis Kit(Life)试剂盒获得体外转录的sgRNA X1和sgRNA X3。
随后进行体外切割验证。配制反应体系:体外转 录 的 sgRNA 50 ng,Cas9 enzyme 1 μL,10×Cas9 Reaction buffer 2 μL,Nuclease-free water 15 μL。将配制好的反应体系混合均匀,于37℃金属浴放置15 min后,加入相应的靶片段,轻轻吹打混匀后,继续孵育1 h;最后在反应体系中加入2 μL蛋白酶K再次孵育20 min;结束反应后将全部的反应产物进行2%琼脂糖电泳,以等量(100 ng)的质粒做对照,使用凝胶成像系统分析其体外切割结果。

表1 靶片段扩增引物Table 1 Target fragment amplification primers
1.2.4 MLTC-1细胞培养及转染 MLTC-1细胞(购自中科院上海细胞库)的完全培养基为RPMI 1640培养基加12% FBS,培养条件为37℃,5% CO2。细胞转染是使用LONZA Amaxa Nucleofector2b细胞电转仪进行电转染,电转程序为U-023,质粒用量为15 μg每孔。转染完成后将细胞悬液转移培养基中,并均匀分到六孔板中培养,6 h后换液,去除未贴壁的死细胞。

表2 sgRNA体外转录模板扩增引物Table 2 Primers for amplification of sgRNA transcription template in vitro
1.2.5 MLTC-1细胞转染CMV载体致死效率的检测 实验以MLTC-1细胞转染CMV载体为实验组,转染空载体组为对照组。以12 h为间隔,使用倒置显微镜观察两组细胞,并对不同时间段的细胞使用白光和荧光两种模式拍照记录。在荧光拍照后收集细胞:首先用0.25%的胰酶消化六孔板细胞1 min,然后用移液器轻轻吹落细胞并转移至15 mL的离心管中,经800 r/min离心5 min后,弃上清,保留细胞沉淀。最后使用流式细胞仪进一步计算荧光细胞的比例。
1.2.6 CMV载体对雄性小鼠细胞的X1靶位点突变效率的检测 根据实验方法1.2.4中的细胞转染方法用CMV载体转染雄性小鼠细胞MLTC-1,将转染后的细胞悬液稀释到合适浓度,均匀铺在10 cm细胞培养皿中培养数天,待到一个细胞团在显微镜40×倍视野中细胞个数约为6个且周围无杂细胞时挑取单克隆细胞团,将其转移至48孔板中培养,而后依据细胞生长情况依次传代至12孔板、6孔板、6 cm细胞培养皿中,待细胞长满6 cm培养皿时,收集细胞提取DNA。PCR扩增X1的部分靶位点序列,引物如表3所示。扩增产物进行琼脂糖凝胶电泳后切胶回收,纯化后进行TA克隆,将X1的靶位点片段克隆到pEASY-T5 Zero克隆载体中;经大肠杆菌感受态转化后,获得的菌液送华大基因公司使用通用引物M13进行测序;将测序结果与靶片段的理论序列进行比对,寻找突变位点,统计突变效率。
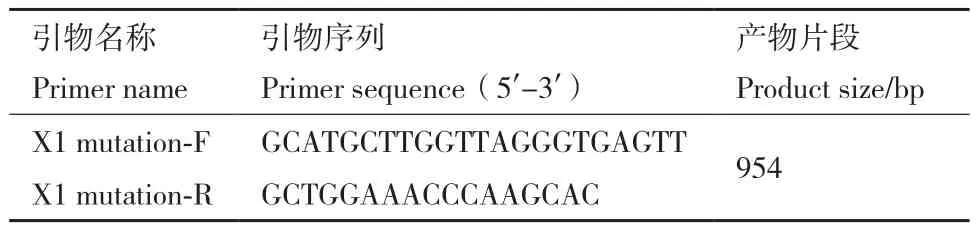
表3 X1靶位点扩增引物Table 3 Primers for amplification of the X1 target site
1.2.7 注射CMV载体对小鼠孤雌胚胎体外发育的影响 选取6周龄左右性成熟的C57BL/6雌鼠,腹腔内注射5 IU的孕马血清促性腺激(PMSG),48 h后使用5 IU的人绒毛膜促性腺激素(hCG)对同一小鼠再次进行腹腔注射,注射完成12 h后雌鼠便可诱发超数排卵。处死超数排卵的雌鼠,收集其卵母细胞,用含有5 μm/mL CB的10 mmol/L的SrCl2激活液处理2 h,接着继续培养3-4 h后观察细胞是否被成功激活。采用无内毒素质粒小提试剂盒抽提空载体质粒和CMV载体质粒,稀释至15 ng/μL备用。然后,将激活成功的孤雌胚胎分为两组,将稀释好的质粒分别注射入孤雌胚的原核内。注射空载体的为对照组,注射CMV载体的为实验组。最后,将注射后的孤雌胚胎培养至囊胚,分别计数两组孤雌胚胎发生卵裂的和发育到囊胚的比例。同时,分别取部分囊胚用染料Hoechst33342进行染色,拍照并记录每个囊胚的细胞数。
2 结果
2.1 靶向小鼠X染色体多拷贝基因的sgRNA设计
根据在线软件的分析结果,结合最小脱靶效率,本实验选择了两个多拷贝基因X1和X3作为靶位点,其对应的sgRNA具体信息如表4。

表4 靶向小鼠X染色体多拷贝基因的sgRNA序列Table 4 Sequences of sgRNA targeting mouse X chromosome multi-copy genes
2.2 靶向小鼠X染色体多拷贝基因的sgRNA和Cas9蛋白共表达载体的构建
实验将载体一中sgRNA相关元件序列替换成可以表达靶向小鼠X染色体上X1、X3位点的sgRNA序列,构建了靶向小鼠X染色体多拷贝基因的sgRNA和Cas9蛋白共表达载体,即CMV载体,其构建示意图详见图1-A所示。载体一与sgRNA片段合成质粒双酶切的结果见图1-B。
2.3 sgRNA X1和sgRNA X3介导Cas9蛋白在体外切割靶序列的效率验证
sgRNA体外切割验证结果如图2所示。将成像结果进行灰度分析,结果显示sgRNA X1和sgRNA X3分别介导的Cas9蛋白对其靶序列的切割效率分别为60.0%和75.0%,表明两个sgRNA介导的CRISPR/Cas9系统均具有较高的切割效率。
2.4 CMV载体转染后对MLTC-1细胞致死效率的检测
MLTC-1细胞为小鼠雄性细胞,基因型为XY,如果切割并删除X染色体,变成OY型细胞,则不能存活。MTLC-1细胞分别转染CMV载体与空载体后不同时间点于显微镜下观察细胞变化(图3-A),结果显示在转染后48 h内两组的绿色荧光细胞数量均逐渐增加,而后实验组的荧光细胞数则大量减少。为了能够更直观的展现绿色荧光细胞比例的变化,用流式细胞仪精确计算两组荧光细胞的比例(图3-B),结果显示两组的绿色荧光细胞比例均在转染后约48 h达到最大值,到转染后60 h,转染CMV载体的实验组绿色荧光细胞比例下降37.5%,转染空载体的对照组绿色荧光细胞比例仅下降1.5%,两组对比差异显著。该结果说明了在成功转染CMV载体后,大部分细胞因其中X染色体被删除而死亡。
2.5 CMV载体转染后对MLTC-1细胞的X1靶位点突变效率的检测
基于基因组的自我修复机制,CMV载体即使对转染后的MLTC-1细胞X染色体进行了切割,有一部分细胞也可能成功自我修复而存活下来,但这部分细胞的基因很可能在靶位点附近形成突变。CMV载体转染MLTC-1细胞后共挑取192个单克隆细胞团,检测了其中36个克隆细胞的突变情况。其中4个单克隆细胞团寻找到突变位点,测序比对结果如图4所示。结果表明,CMV载体对雄性小鼠细胞X1靶位点的突变效率约为11.1%,突变类型以点突变为主。

图1 CMV载体的构建及鉴定Fig.1 Construction and identification of CMV vector

图2 sgRNA X1和sgRNA X3介导Cas9蛋白在体外切割靶序列效率验证的电泳图Fig.2 Electrophoresis diagram of verifying the efficiency of sgRNA X1 and sgRNA X3 mediated Cas9 protein cleaving target sequence in vitro
2.6 小鼠孤雌胚胎注射CMV载体后对其卵裂率、囊胚率及囊胚细胞数的影响
小鼠孤雌胚胎注射CMV载体组和注射空载体组的卵裂胚数、囊胚数统计结果见表5,结果显示两组的卵裂率没有显著差异。注射CMV载体组的囊胚率低于注射空载体组的囊胚率,但两组差异不显著。然而,囊胚染色的结果显示,注射CMV载体组平均囊胚细胞数为33.93个,注射空载体组平均囊胚细胞数为44.66个,两组的囊胚细胞数差异达到显著水平(P<0.01)。这表明在部分囊胚细胞中实现了Cas9对细胞X染色体的切割和删除,并且造成了部分细胞的死亡,从而使得注射CMV载体组和注射空载体组囊胚细胞数出现差异。
3 讨论
CRISPR/Cas9技术是现今最为热门的基因编辑技术,可以实现基因敲除、基因沉默、基因敲入以及各种目的的基因编辑,且具有高效的切割效率,已被广泛应用于多个物种的基因组研究中。研究表明,CRISPR的切割效率在某些物种中可高达80%以上[12]。但是,该效率同时也会受到许多因素的影响,如sgRNA的GC含量、sgRNA与Cas9蛋白的表达剂量与表达模式、SSA报告载体的应用、切割环境(体内、体外)等[13-15]。本实验构建的CMV载体为共表达载体,其体外切割实验结果显示sgRNA X1和sgRNA X3介导的Cas9蛋白切割靶序列的效率分别为60.0%和75.0%,表明了两个sgRNA在体外介导的CRISPR/Cas9系统均具有较高的切割效率。
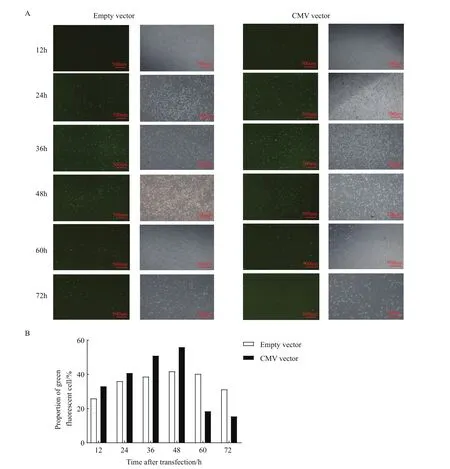
图3 CMV载体、空载体转染MLTC-1细胞不同时间的荧光细胞数比较结果Fig.3 Comparison results of the number of fluorescent cells in MLTC-1 cells at different time after transfecting with CMV vector and empty vector
Zuo等[16]采用具有两种基因型的小鼠胚胎干细胞进行染色体删除实验,获得了X染色体缺失的小鼠。但是其使用了DNA FISH和WGS两种方法进行检验,过程复杂且技术要求较高。为了方便检测细胞内X染色体是否被删除,我们采用小鼠睾丸间作用可致使X染色体整体失活,最终导致细胞死亡。
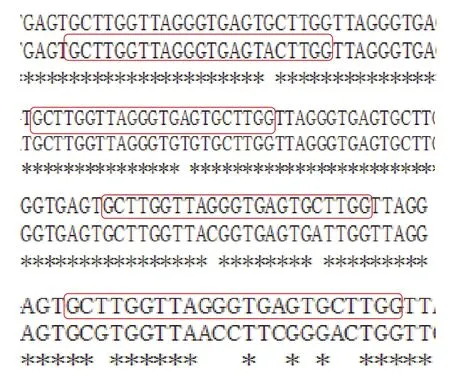
图4 CMV载体转染后对MLTC-1细胞的单克隆细胞团X1靶位点处测序结果Fig.4 Sequencing results of the X1 target site of the monoclonal cell mass of MLTC-1 cells after CMV vector transfection
哺乳动物细胞对CRISPR系统造成的双链断裂具有一定的修复作用,其中主要的修复方式为非同源末端连接[17-18],这种修复方式的错误率较高,会导致染色体缺失、插入和点突变等频率增加[19]。本实验对转染CMV载体后的MLTC-1细胞进行X1靶位点的突变效率检测,间接验证CMV载体在细胞水平上的切割效率。实验结果进一步证实了CMV载体可以删除雄性细胞内X染色体的推断。同样地,有研究构建了靶向小鼠Y染色体上Rbmy基因的CRISPR/Cas9系统表达载体,成功删除了Y染色体,且其在细胞内对Rbmy基因的突变效率为15.4%[20]。然而,本实验设计的CMV载体对X1靶位点的突变效率只有11.1%,可能是由于部分细胞的X染色体被切割后失活,细胞死亡,无法检测突变率。另外,由于X3基因在X染色体上分布十分分散,实验仅检测了CMV载体对X1靶位点的突变率,未检测CMV载体对X3靶位点的突变率,因此CMV载体对转染后的细胞X染色体整体的实际突变效率很有可质瘤细胞MLTC-1进行实验,其基因型全为XY型,X染色体被删除后,细胞即死亡。实验结果显示,CMV载体成功转染MLTC-1细胞后,细胞死亡率显著提高。据此可以推断CMV载体对X染色体的切割能是高于11.1%的。

表6 CMV载体和空载体注射孤雌胚体外发育效率比较Table 6 Comparison of in vitro development efficiency of parthenogenetic embryos injected with CMV vector and empty vector
实验用CMV载体和空载体质粒分别注射小鼠的孤雌胚胎,注射CMV载体组的囊胚率为58.1%,注射空载体组的囊胚率为69.5%。两组对比分析,实验组的囊胚率虽然低于对照组,但并未达到显著水平,这可能与注射质粒在胚胎中的表达水平有关。胚胎内的基因表达需要经历合子基因组激活过程,即从母型调控向配型调控的,然后胚胎开始自行转录、翻译合成蛋白质[21]。合子基因组激活过程通常发生在二细胞期到四细胞期,注射的质粒不能第一时间表达而发挥切割作用;同时因为细胞分裂注射的质粒被稀释,部分卵裂球中sgRNA和Cas9基因无法表达或者表达水平极低而不足以实现切割作用,无法导致胚胎死亡。本研究通过检测部分囊胚的细胞数发现,注射CMV载体组的囊胚细胞数显著低于注射空载体组,这一结果从侧面证实前述的猜想。另一方面,小鼠孤雌胚胎存在多种不同的激活类型,不仅存在单倍体、二倍体,甚至可能存在四倍体[22]。四倍体胚胎中存在多条X染色体,即使CMV载体发挥了切割作用,但无法完全删除所有的X染色体,胚胎仍然有可能存活,所以注射CMV载体组和注射空载体组的囊胚率没有显著性差异。
本研究结果表明,CMV载体可以对小鼠的X染色体进行有效切割。后续实验可以结合超数排卵技术,显微注射CMV载体至小鼠胚胎,致死雄性胎儿,以获得更多的雌性后代;此外,也可以用于制作转基因公鼠,通过控制载体的作用时间,使其只生产Y精子,从而提高后代雄性比例。
4 结论
本研究设计了两个靶向小鼠X染色体上多拷贝基因的sgRNA,构建了切割X染色体的CRISPR/Cas9表达载体:CMV载体,通过体外切割实验、细胞转染实验和孤雌胚胎注射实验证实了该载体在体外、细胞和胚胎水平上均具有较高的切割效率,可以成功删除X染色体。