春兰miR396过表达对拟南芥叶片生长、光合及叶绿素荧光特性的影响
2021-06-23徐子涵刘倩苗大鹏陈跃胡凤荣
徐子涵 刘倩 苗大鹏 陈跃 胡凤荣
(1.南京林业大学风景园林学院,南京 210037;2.浙江省农业科学院园艺所,杭州 310021)
叶片是植物最重要的器官之一,同时也是植物进行光合作用的主要场所,叶片的形态、大小、数目均在植物的生长发育中起着至关重要的作用。在现代的分子育种研究中,模式植物具有生长迅速、结构简单、表型明显等众多优点,从中获取叶片发育特性的定量信息较为容易[1],对植物发育研究具有一定的实际意义。春兰(Cymbidium goeringii)是兰科(Orchidaceae)兰属的一类地生兰,是国兰中最具代表性的品种之一,其叶线条优美,花朵素雅、花型各异,兼具观赏和药用价值[2]。目前对于国兰的研究主要集中于形态观察、生理生化和组织培养方面,对其生长发育的分子研究较少,且包括春兰在内的兰科植物基本全为喜阴植物,栽培养护较为困难。因此,通过模式植物研究春兰叶片发育及光合特性的分子调控机理,对探究其营养生长和品质形成十分必要。
miR396是植物体内的一类保守的miRNA,与植物生长发育密切相关,其主要靶向一类重要的生长调控因子(growth-regulating factor,GRF),在拟南芥、水稻、玉米等不同物种中均发现其保守序列的存在[3-4]。已有众多研究发现,miR396通过调控GRF转录因子,对叶片、茎、种子和心皮等组织和器官的生长发育发挥着重要的作用,尤其对叶片的研究报道居多,参与调控叶片的大小、细胞增殖、叶片衰老、叶绿素合成及光合作用等一系列过程[5-6]。但目前来看,miR396在兰科植物中的研究极少,其对兰科植物叶片发育和其他性能的影响也尚不清楚。鉴于此,本研究将春兰miR396基因前体cgo-MIR396在拟南芥(Arabidopsis thaliana)中过表达,观察其叶片的生长表型变化及其光合相关指标的响应,结合对其在生长不同时期表达模式的分析,为春兰的栽培应用及优良品种选育提供科学依据。
1 材料与方法
1.1 材料
试验所用春兰“宋梅”种植于浙江省农科院园艺所兰花组实验室,选择生长健壮的品种“宋梅”植株,分别剪取营养生长期和生殖生长期两个阶段的叶片,用于分析miR396在不同叶发育时期的特异性表达,并进行其前体基因的克隆和超表达载体构建。材料取好后装入已标记的干净离心管中,立即置于液氮中,随后转移至-80℃冰箱保存。
转基因所用拟南芥为本实验室自存的野生型哥伦比亚(Columbia,Col),在培养箱中进行培育,生长条件为:温度(22±1)℃,湿度70%,光周期16 h光照/8 h黑暗,光照强度6 000-8 000 lx。
1.2 方法
1.2.1 基因表达量的测定 将春兰营养生长时期的幼叶、成熟叶及生殖生长时期的成熟叶片在液氮中研磨成粉末,用MiniBEST Universal RNA提取试剂盒(TaKaRa,上海)提取各样本的Total Small RNA,再以800 ng上述各样品的RNA为模板,用HiScriptⅢ 1stStrand cDNA反转录试剂盒(诺维赞,南京)茎环法进行反转录,得到miR396成熟体cDNA第一链,反转录引物为:5′-GTCGTATCCAGTGCAGGGT CCGAGGTATTCGCACTGGATACGACAGTTCA-3′。以该cDNA为模板,用ChamQTMUniversal SYBR qPCR Master Mix试剂盒(诺维赞,南京)进行反应溶液的配制,在Applied Biosystems 型实时荧光定量分析仪上运行PCR程序,以检测春兰miR396在不同生长时期叶片中的表达量。根据基因序列,用miRNA Design软件(诺维赞,南京)设计引物,上游引物 :5′-GCGCGTTCCACAGCTTTCT-3′,下游引物 :5′-AGTGCAGGGTCCGAGGTATT-3′,反应条件 :95℃ 5 min;95℃ 10 s,60℃ 30 s,循环 40 次 ;95℃15 s,60℃ 1 min,95℃ 15 s。反应结束通过StepOne Software v2.3导出数据,以春兰18S基因为内参,根据CT值用2-△△Cq相对定量法计算相对表达量。每个时期的叶片设置3次生物学重复,3次技术重复。
1.2.2 基因转化与转基因株系筛选 将春兰叶片用液氮研磨呈粉末,用MiniBEST Plant Genomic DNA提取试剂盒(TaKaRa,上海)提取gDNA,以其为模板克隆得到miR396前体cgo-MIR396的全长,连接pBI121植物表达载体,测序成功后转入农杆菌GV3101(酶普利斯,南京)。将含有重组质粒pBI121- MIR396的农杆菌,对野生型拟南芥Col(WT)进行转化,记为T0代,待其种子成熟收取后,均匀播种在含卡那霉素的MS培养基上,筛选得到T1代转基因植株,待小苗长出4片真叶后移栽入盆土(营养土与育苗基质1∶1混合)中继续培养,单株收取种子,继续进行抗性筛选,直至获得T3代转基因纯合株系。
1.2.3 转基因拟南芥检测及形态指标测定 选取生长时期相同的拟南芥野生型Col及筛选得到的miR396过表达植株,取其移栽后状态稳定植株的叶片组织剪碎,采用2×T5 Direct PCR试剂盒(擎科,南京)的加热裂解法进行转基因拟南芥的DNA鉴定。另外选取生长时期一致的转基因与野生型植株,分别在移栽后第20天和40天时统计叶片数目,并测量位于相同部位的叶片长度、宽度、叶面积、叶片数目等,第60天高度生长基本停止时测量株高。每个株系取5个植株进行测量,每株植株测量3片叶片,下同。
1.2.4 叶绿素含量的测定 选取与测量生长指标相同位置和发育阶段(生殖生长阶段,下同)的野生型及转基因叶片,称取0.05 g,采用无水乙醇与无水丙酮1∶1混合液浸提法,利用分光光度计测定663 nm、646 nm和470 nm下的OD值,根据公式求出叶绿素的含量。计算公式:叶绿素a含量(mg/g)=(12.21 A663- 2.81 A646)·Vt/ 1 000W;叶绿素b含量(mg/g)=(20.13 A646- 5.03A663)·Vt/ 1 000 W ;叶绿素总量(mg/g)= 叶绿素a含量 + 叶绿素b含量。其中,A663、A646分别为叶绿素溶液在波长663和646 nm时的吸光度;Vt是总提取液体积,为10 mL;W为叶片重量,即0.05g。
1.2.5 光合指标及叶绿素荧光参数的测定 用CIRAS-3(PP-system,英国)便携式光合仪进行叶片光合指标的测定。测定时,设置光合有效辐射强度为80 μmol·m-2·s-1,与培养箱内光照基本一致,控制叶室温度为25℃,CO2浓度为420-450 μmol/mol,相对湿度为(50±10)%,记录净光合速率(Pn)、气孔导度(gs)等光合生理参数。
使用Handy PEA(Hansatech,英国)进行叶绿素荧光参数的测定。将叶片平展夹在荧光夹4 mm2的暗测试孔中,暗反应20 min后进行测定,获得OJIP荧光诱导曲线及初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、PSⅡ最大光化学效率(Fv/Fm)、及性能指数(PI)等一系列参数。
1.2.6 数据分析 采用Excel 2010和SPSS 26.0软件对数据进行统计分析。采用单因素(one-way ANOVA)和Duncan法进行方差分析和多重比较(α=0.05),Pearson法进行相关性分析。图表中数据为平均值±标准差。
2 结果
2.1 春兰miR396在不同叶发育时期中的表达
采用实时荧光定量PCR对春兰营养生长时期的幼嫩叶片、成熟叶片,以及花期成熟叶片中miR396基因的表达进行分析,结果(图1)显示该基因在花期叶片中表达量最高,营养生长时期叶片的表达量均较低。

图1 春兰miR396在不同叶发育时期的相对表达量Fig.1 Relative expression of cgo-miR396 in different leaf development stages
2.2 春兰miR396过表达株系的检测
过表达载体构建完成并通过农杆菌转化拟南芥中后,以含Kana抗生素的MS培养基对三代转基因拟南芥进行阳性筛选,得到纯合的T3代阳性株系,然后以植物基因组DNA为模板,利用来自35S启动子和MIR396的筛选引物初步鉴定转基因株系(图2)。结果表明,MIR396基因已成功转入拟南芥植株中。
2.3 转基因拟南芥形态指标的变化
从MS培养基移至土壤中第20天,植株尚未抽茎开花时,对野生型Col和过表达miR396拟南芥幼苗植株的冠幅、叶片数、叶长和叶宽进行观察发现,转基因植株的某些形态指标虽相较野生型(WT)有小幅度的增加,但总体来看,二者之间尚未出现明显差异(图3)。
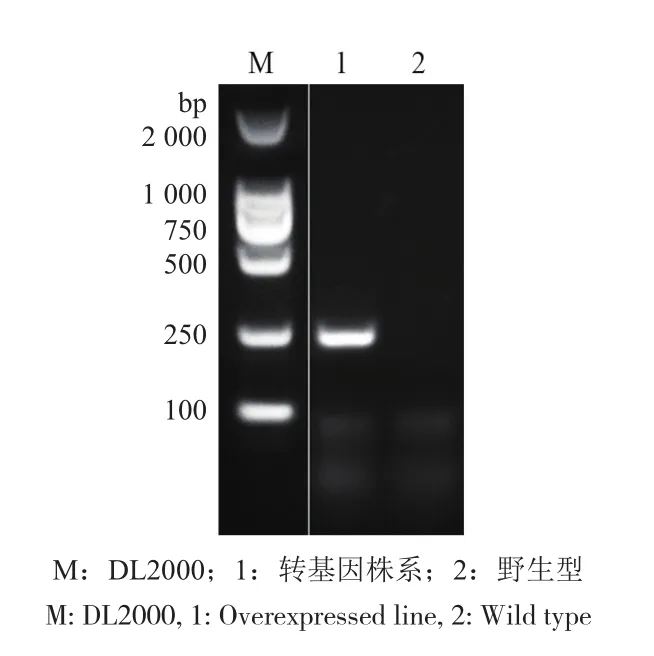
图2 过表达株系DNA检测Fig.2 DNA detection of overexpressed line
而在植株处于生殖生长阶段时的观测结果则表明,miR396过表达后,拟南芥株高增加,叶面积、叶长和叶宽乃至基生叶片数目均增大(图4),而茎生叶片数目未发现明显的改变。在这些形态指标中,叶面积的变化最为明显,经测量的野生型拟南芥平均叶面积为330.57 mm2,而不同的转基因株系Line1、Line 2、Line3和Line4的平均叶面积分别为558.35、527.45、533.24和600.31 mm2,均与野生型的该项指标呈现显著性变化。
2.4 转基因拟南芥叶绿素含量的变化

图3 营养生长期形态指标观测(Bar=1 cm)Fig.3 Morphological index observation during vegetative growth period
MIR396过表达显著降低了叶绿素a、叶绿素b和叶绿素总含量,其中与野生型对照相比,Line1到Line4株系叶绿素总量分别下降了27.79%、29.11%、27.66%、16.50%,在Line2株系处出现最小值,而叶绿素a与b的比值未发生明显变化(表1)。
2.5 转基因拟南芥光合指标的变化
图5显示,转基因拟南芥的净光合速率(Pn)较野生型高出8.50%-19.52%,但尚未构成显著差异。而从气孔导度(gs)和蒸腾速率(Tr)两个指标来看,各转基因株系间未发现明显区别,但均显著低于野生型,气孔导度下降幅度最大,在Line2株系处出现最小值,比野生型下降了74.8%;蒸腾速率则在Line1处出现最小值,平均值比野生型低46.75%。与之不同的是,随着气孔导度的减小,在过表达植株与对照的胞间二氧化碳浓度(Ci)的比较中,只Line2株系显著低于野生型,但仅下降了9.58%。同时还发现,MIR396过表达后,叶片的水分利用效率(WUE)增大,在Line1与Line2株系处呈现显著差异。
2.6 转基因拟南芥叶绿素荧光参数的变化
由表2可知,野生型与各转基因株系间的叶绿素荧光参数虽略有差异,如Line2和Line3株系的PSⅡ最大光化学效率(Fv/Fm)、PSⅡ的潜在光化学效率(Fv/Fo)相对较低,但均未达到统计显著水平,表明过表达CgMIR396后,拟南芥叶片的捕光及光能转化能力未发生明显变化。

图4 生殖生长期形态指标观测(Bar=1 cm)Fig.4 Morphological index observation during reproductive growth period
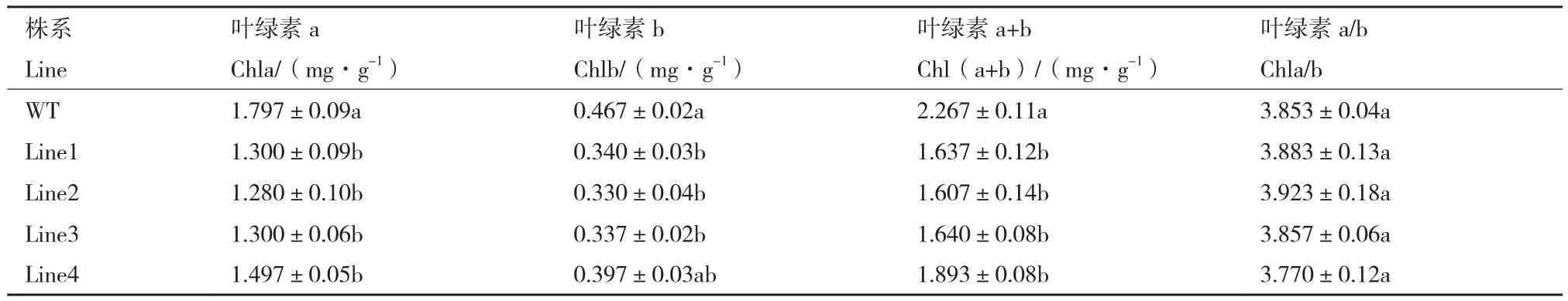
表1 叶绿素含量的测定Table 1 Determination of chlorophyll content

图5 叶片光合指标的测定Fig.5 Determination of photosynthetic indexes in leaves

表2 快速叶绿素荧光参数的测定Table 2 Rapid determination of chlorophyll fluorescence parameters
2.7 转基因拟南芥叶片能量分配比率的变化
拟南芥转基因后量子产额和能量分配比率的变化趋势,如图6所示,其暗适应后的最大光化学效率(φPo)并未发生较大变化;而在反应中心捕获的激子中,用来推动电子传递到电子传递链中超过QA的其他电子受体的激子占用来推动QA还原激子的比率(ψo)在转基因后略有减小,其中Line2株系与野生型呈现显著差异,即照光2 ms时有活性的反应中心开放程度显著变小;另外,Line2与Line3株系反应中心吸收的光能用于电子传递的量子产额(φEo)也显著降低,下降比例分别为10.01%和8.29%。

图6 叶片量子产额和能量分配比率的变化Fig.6 Variations of leaf quantum yield and energy distribution ratio
2.8 转基因拟南芥PS Ⅱ反应中心活性参数的变化
通过对光合机构比活性的分析发现,转基因株系在单位反应中心吸收的光能(ABS/RC)及耗散掉的能量(DIo/RC,在t=0时)仅在Line3株系处出现较明显的变化,分别高出野生型6.25%和14.45%;但单位反应中心捕获的用于还原QA的能量(TRo/RC,在t=0时)和用于电子传递的能量(ETo/RC,在t=0时)未发生明显变化(图7)。

图7 叶片比活性参数的变化Fig.7 Variations of specific activity parameters in leaves
2.9 转基因拟南芥性能指数及推动力的变化
以吸收光能为基础的性能指数(PIABS)和推动力(DFABS)能够更为准确地反映植物叶片光合机构的状态,在图8中可以看出,转基因株系的PIABS及DFABS均呈现下降趋势,其中在DFABS中反应的变化更为明显,Line1到Line4株系分别较野生型下降了18.06%、60.22%、54.95%和7.18%,在Line2和Line3处呈现显著差异,并在Line2株系处达到最小值。

图8 叶片性能指数及推动力的变化Fig.8 Variations of performance index and driving force
2.10 转基因拟南芥形态、光合及叶绿素荧光指标的相关性分析
传统Pearson相关分析结果显示,拟南芥叶面积、叶长和叶宽之间的相关性呈现极显著水平,这三者均与气孔导度(gs)之间呈显著相关;胞间二氧化碳浓度(Ci)、气孔导度(gs)和水分利用效率(WUE)三者之间也达到极显著相关水平,净光合速率(Pn)则与其他光合指标间无明显相关性;而叶绿素荧光各项指标之间大多均存在一定的相关性,尤其是快速荧光参数Fo、Fm与Fv及其比值,与DIo/RC、φPo、φEo、PIABS、DFABS之间多数达到显著相关甚至极显著相关(表3)。
3 讨论
miR396及其靶基因GRF对植物各组织器官的发育都具有显著的调控作用,尤其以控制叶片发育方面的研究居多[5]。目前的研究结果表明,该模块主要是通过控制细胞增殖来调节叶细胞形态乃至叶片的表观形态。本研究中发现,春兰miR396基因在拟南芥中的过量表达能够促进生殖生长时期的叶片生长、降低叶绿素含量,进而影响其光合、叶绿素荧光等一系列参数的变化。

表3各单项指标的相关系数矩阵Table 3 Correlation coefficient matrix of each single index
在对叶片形态的观测中,cgo-miR396基因过表达株系的叶片发育受到促进,呈现出与拟南芥、番茄、欧洲油菜等双子叶植物在miR396-GRF模块中不一致的研究趋势;但Wu等[7]在玉米中对ZmGRF10的研究结果则表明,该基因的过量表达导致了玉米叶面积和株高的减小,这与本研究的结果较为相似。通过前期对春兰miR396的生物信息学分析发现,其与高粱、甘蔗等单子叶植物的同源性最高,因此,单双子叶植物之间基因功能的差异,以及兰科植物自身的特异性,均暗示着该作用模块可能发挥的特殊功能。
光合作用是植物最为重要的物质和能量来源,春兰作为一种重要的观赏和药用植物,探究光合作用不仅能够更好的保障其生长和发育所需的优质物质来源,还可对其栽培所需环境、叶片形态发育及观赏价值等方面的研究提供指导。在本研究中,随着转基因植株叶片面积和长宽的增加,叶绿素a、叶绿素b和叶绿素总量均呈下降趋势。从前人的分析来看,miR396导致叶片增大的主要原因是由于细胞增殖导致叶细胞数目的增多或体积的增大[8-9],本研究结果可能与周厚君等[10]的研究结果相似,即miR396导致了细胞体积的扩张,且可能并未增加叶绿体的数目,从而使得叶绿素分布较为分散,单位重量的叶绿素含量明显下降、且叶绿素a/b的比值保持不变。从光合指标来看,相较野生型来说,cgo-miR396的过表达虽导致气孔导度显著下降,乃至蒸腾速率降低,但其Ci指标表明其用于光合作用的CO2仍能达到饱和状态,水分利用效率也上升,最终使净光合效率呈上升趋势,促进了拟南芥的生长。另外,本研究中光合各项指标的组内标准偏差较大,参考张治平等[11]对于烟草转基因叶片光合作用的研究来看,不同叶位间光合指标的差异,是导致该因素产生的主要原因。
本研究的4个转基因株系相较野生型来看,虽PSⅡ最大光化学效率及潜在光化学效率等叶绿素荧光参数未发生显著变化,但Appenroth等[12]和Heerden等[13]的研究表明,性能指数和推动力能够更准确的反映植物光合机构的状态,通过图8中对二者的分析来看,miR396的过表达很可能对拟南芥叶片的光合机构造成了一定程度的破坏,尤其体现在Line2与Line3株系中。且对量子产额和能量分配比率的分析也表明,转基因株系的能量在PSII反应中心中的分配比率发生了变化,照光2ms时有活性反应中心的开放程度也相应减小,说明PSⅡ受体侧发生了改变[14]。
最后,通过对这24个指标进行的Pearson相关性分析来看,各指标间均存在一定的相关性,一些指标间呈现显著相关,有的甚至达到极显著相关。从形态指标来看,叶面积与叶长、叶宽均呈极显著相关,且与叶宽的相关性更高,表明miR396主要是通过增大叶宽来增大叶片大小;这三者也与气孔导度(gs)呈现一定的相关性,结合上述分析来看,推测叶片细胞的增殖或许导致了气孔数目的增多,但因光合所需CO2已达饱和状态,因此气孔开合程度遵循自主调节机制而显著下降,在后续研究中可对叶片表皮结构进一步观察以得出结论。各光合指标分析表明,净光合速率与其他因素并无显著相关性,表明叶面积、气孔及水分可能不是影响光合速率的主要原因,因此在这些转基因植株中,叶片中各种光合酶的活性或其他内部因子可能已经发生了改变。另外,虽然叶绿素与类胡萝卜素是植物吸收光能的基础,但相关性分析表明,叶绿素与光合能力的变化也并不存在正相关,这与叶子飘等[15]的研究结果一致,说明植物电子传递的速率不仅与叶绿素含量有关,还与捕光色素分子的特性,如光能吸收截面、激子传递效率等密切相关[16]。
4 结论
春兰miR396的过表达对拟南芥生殖生长时期叶片生长发育的形态指标和光合指标均产生了一定的影响,与前人在双子叶植物中的研究存在较大差异,并在此基础上对其叶绿素荧光参数进行了分析发现,该基因在保证植物净光合效率、促进叶片生长的同时,适当降低了植物叶片的气孔导度及PSII受体侧的部分性能。