玉米转录因子NAC78的克隆及表达特性分析
2021-06-23何姗王智康杨阳牟玥薇黄玉碧余国武
何姗 王智康 杨阳 牟玥薇 黄玉碧 余国武
(作物科学国家级实验示范中心 四川农业大学农学院,成都 611130)
NAC(NAM,ATAF1/2,CUC2)是植物中最大的转录因子家族之一,NAC的命名由最早发现的矮牵牛(Petunia hybrida Vilm.)NAM基因、拟南芥ATAF1/2基因和CUC1/2基因首字母组成[1-3]。NAC蛋白的N端含有一段与NAM蛋白高度同源的保守氨基酸序列,被称为NAC结构域,这一结构域起着结合DNA或蛋白的功能。不同NAC蛋白的C端则表现出高度的变异[4]。目前已在拟南芥中发现了超过110个的NAC蛋白,在水稻中发现了超过150个,在玉米中发现了超过130个[5-7]。这些NAC转录因子参与了植物生长发育、环境胁迫以及激素信号传导等多种生命活动[8-10]。
NAC蛋白广泛存在于陆地植物中,但近年来也在水生的绿藻中发现了NAC蛋白,意味着在陆地植物出现前,NAC蛋白已经出现并发挥作用[11]。陆生植物与水生植物的最大区别之一在于,陆生植物进化出了专门用于水分传导和储存的细胞,许多NAC蛋白调控植物筛管和导管分子的形成,对保障陆生植物正常水分供需极其重要[12-13]。苔藓PpVNS家族蛋白功能缺失突变体的导水细胞发育异常、孢子畸形,严重阻碍了植物的正常发育和繁衍,而在苔藓和拟南芥中过表达PpVNS促进了导水细胞的分化。且PpVNS在苔藓和拟南芥中调控相似的基因网络,这一基因在不同的物种中功能保守性高,意味着NAC转录因子可能参与了植物对陆地适应过程中导水细胞和支持细胞的进化[14]。不仅如此,植物在复杂的陆地自然环境中,常常遭遇高温、干旱等非生物胁迫的挑战,研究发现25%以上的NAC蛋白至少参与了植物对一种胁迫的响应[15]。白杨BpNAC012能够对植物的次生壁形成及非生物胁迫响应起到积极的作用,过表达BpNAC012的植株次生壁明显增厚,对盐胁迫和渗透胁迫的抵抗能力明显增强[16]。水稻 SNAC1(stress-responsive NAC1)的过表达使得水稻表现出明显的抗旱性和耐盐性,并且能显著提高过表达植株的产量,在作物育种方面具有重要的意义[17]。另外,一些NAC蛋白表现出对生物胁迫和非生物胁迫的双重功能。棉花GhATAF1的过表达激活了包括ABA的应答基因GhABI4在内的多个胁迫响应基因,增强了转基因植株对盐的耐受性,但过表达植株对黄萎病病毒(Verticillium dahliae Kleb.)和灰酶(Botrytis cinerea)更加敏感,同时抑制了茉莉酸(JA)和水杨酸(SA)介导的信号转导[18]。由此可见,NAC蛋白对逆境的响应可能是影响多种激素信号网络协同作用的结果。
脱落酸(abscisic acid,ABA)在植物的多种发育过程中和环境胁迫响应中起着重要作用。模式植物拟南芥中有将近10%的编码蛋白质的基因受到ABA的调节,远高于其他的植物激素[19-20]。目前,已经发现许多NAC蛋白能够响应ABA,如玉米ZmNAC071能抑制胁迫响应基因表达进而使得过表达拟南芥对ABA和渗透胁迫的敏感性增强[21]。ZmNAC84的表达受到H2O2的诱导,通过响应H2O2信号参与到ABA诱导的抗氧化防御进程,过表达ZmNAC84的烟草株系具有更强的抗旱能力,并且在干旱条件下具有更少的氧化损伤[22]。水稻OsNAC2通过结合非生物胁迫和ABA响应通路的标记基因OsLEA3(LATE EMBRYOGENESIS ABUNDANT 3)和 OsSAPK1(Stress-Activated Protein Kinases 1)基因的启动子,同时调节非生物胁迫反应和ABA介导的反应,并在ABA和非生物胁迫途径之间起作用[23]。
玉米是第三大粮食作物,是食物和工业原料的重要来源,玉米灌浆期遭受干旱或盐胁迫将导致产量下降[24-26]。而ABA对于玉米籽粒发育的影响更为复杂,施用外源ABA对产量的影响与施用的时间和剂量有关[27]。本研究对授粉后20 d的Mo17玉米胚乳蛋白进行质谱分析,筛选得到了一个表达水平较高的转录因子NAC78,通过克隆了NAC78的开放阅读框(ORF),并通过荧光定量PCR技术对NAC78的组织表达特性和对ABA、NaCl、PEG的响应进行了分析,为深入研究NAC78在玉米对非生物胁迫的响应和玉米胚乳发育过程中的功能奠定基础。
1 材料与方法
1.1 材料
本试验使用的植物材料为玉米骨干自交系Mo17,由四川农业大学农学院提供,取Mo17的根、茎、叶、花丝、花药、授粉后15 d玉米棒中部的籽粒、胚及授粉后5-30 d胚乳用液氮迅速冷冻,置于-80℃超低温冰箱中保存备用。取自交授粉后15 d的玉米棒中部籽粒置于含有50 μmol/L ABA的液体MS培养基中缓慢震荡(50 r/min)培养48 h,同时以在不含有ABA的MS培养基中培养的籽粒作为对照,每12 h取出部分籽粒用液氮迅速冷冻并保存备用。在培养室中种植Mo17玉米,待植株长至三叶期时选取长势旺盛,生长状态一致的玉米苗浇灌NaCl(200 mmol/L)和PEG(25%)进行胁迫处理,处理后0 h,1 h、6 h、12 h和24 h,取相同部位叶片用液氮迅速冷冻保存备用。
大肠杆菌感受态DH5α、BL21(DE3)购自宝生物生物技术(北京)有限公司。
本试验中使用的总RNA提取试剂盒、琼脂糖凝胶回收试剂盒、质粒提取试剂盒、重组克隆试剂盒、高保真DNA聚合酶购自南京诺维赞生物科技有限公司。反转录试剂盒、质粒载体pMD19-T、限制性内切酶BamH Ⅰ和EcoR Ⅰ、SYBR染料购自宝生物生物技术(北京)有限公司。引物(表1)合成及测序由成都擎科梓熙科技技术有限公司完成。
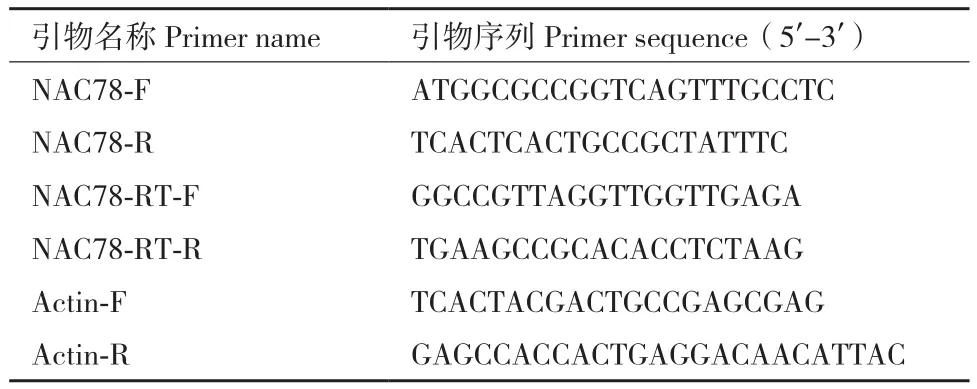
表1 试验所用引物Table 1 Primers used in the experiment
1.2 方法
1.2.1 NAC78的克隆 提取授粉后15 d的Mo17胚乳总RNA并进行反转录获得cDNA,以此为模版进行PCR扩增。扩增后的产物电泳回收后连接克隆载体pMD19-T,提取阳性克隆的质粒并测序验证序列是否为目的序列。
1.2.2 NAC78的生物信息学分析 使用SMART(http://smart.embl-heidelberg.de/)分 析 NAC78的结构域;利用Prot Scale程序(https://expasy.org/cgibin/protscale.pl)分析蛋白质疏水性;利用Prot-Param分析蛋白的理化性质;利用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测NAC78的三维结构;用MEGA6.0软件构建进化树;用 ESPript3.0(http://espript.ibcp.fr/ESPript/cgibin/ESPript.cgi)进行氨基酸序列的多重比对;利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子的顺式作用元件。
1.2.3 NAC78的转录水平表达分析 实时荧光定量仪器为伯乐CFX96。依照SYBR Green PCR Master Mix说明书加入试剂、模版、引物和ddH2O。运行条件:95℃预变性1 min;95℃变性15 s;55℃退火15 s;72℃延伸10 s;此过程45个循环,每个样品设置3个平行重复。以玉米Actin基因作为内参,试验均进行了3次生物学重复。
2 结果
2.1 NAC78基因的克隆
提取Mo17的胚乳总RNA,以Mo17自交授粉后15 d的玉米胚乳cDNA作为模版,利用RT-PCR技术扩增得到约1 800 bp的片段,挑取阳性克隆测序后得到NAC78开放阅读框的核苷酸序列。测序得到的NAC78核苷酸序列长度为1 830 bp,编码609个氨基酸,预测蛋白的分子量为67.45 kD,等电点为5.19,为亲水性蛋白(图1-A)。预测NAC78蛋白氨基酸序列7-133位氨基酸序列为NAM结构域(图1-B),这一结构域起着结合DNA的作用。使用Phyre2对NAC78蛋白的三维结构进行预测,预测模型N端为α螺旋环绕平行的β片层构成的立体结构,C端为无序结构(图1-C)。多序列比对结果显示,玉米NAC78与其在水稻、高粱、拟南芥等植物中的同源基因相比,蛋白的N端是高度保守的,由8个α螺旋和7个β片层构成,分为A-E 5个亚结构域(图2)。选取拟南芥、水稻、普通小麦、马铃薯、番茄、烟草等17种植物中NAC78的同源序基因的氨基酸序列,通过邻接法(1 000 bootstrap)进行系统发育树的构建。结果显示,玉米与谷子、高粱、水稻、普通小麦、香蕉聚为一支,它们均属于禾本科单子叶植物,亲缘关系较近,且玉米NAC78与谷子NAC86的亲缘关系最为接近(图3)。
2.2 NAC78组织表达模式分析
为了解NAC78的表达模式,本试验提取了玉米不同组织的RNA,通过荧光定量PCR技术探究了NAC78在Mo17玉米的根、茎、叶、花丝、花药、胚、胚乳、籽粒及自花授粉后5-30 d的胚乳中的表达情况。结果显示,NAC78在玉米各个组织均有表达,自交授粉后15 d胚乳中的表达量显著高于其他的组织。由于NAC78在胚乳中的表达量最高,因此本试验检测了发育不同时期胚乳中NAC78的表达情况,结果显示,NAC78的相对表达量呈现出先升高后降低的变化趋势,授粉后15 d的相对表达量较第5天增加52.52倍(图4)。Chen等[28]的转录组测序结果显示在授粉后6-28 d NAC78相对表达量的变化情况也呈现出先升高后降低的趋势。由此推测NAC78在胚乳的发育过程中起着重要作用。
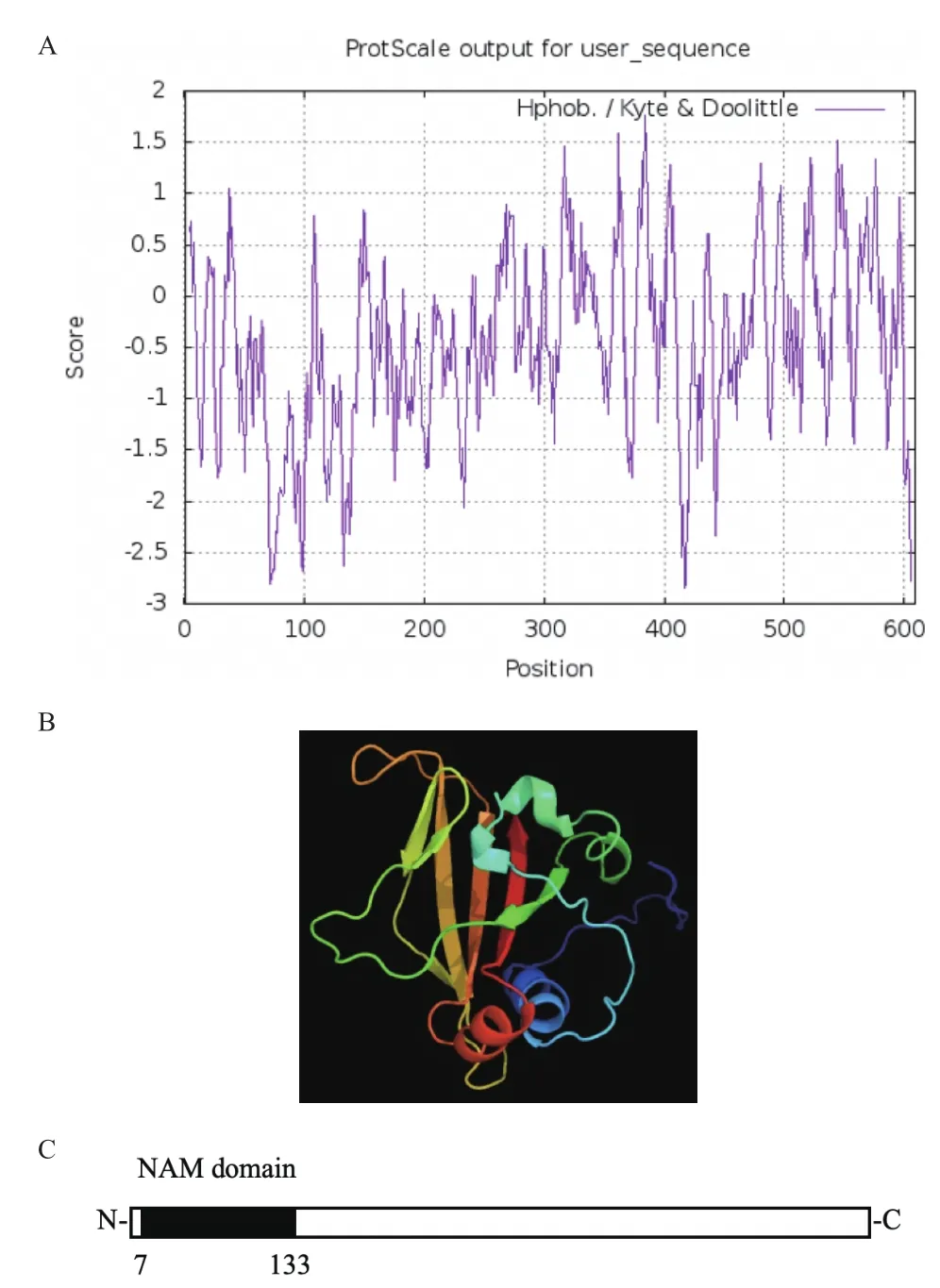
图1 NAC78蛋白的生物信息学分析Fig.1 Bioinformatics analysis of NAC78 protein
2.3 NAC78对非生物胁迫的响应
根据Maize GDB数据库中的信息,对NAC78翻译起始位点ATG上游1 500 bp的启动子序列进行了顺式作用元件的预测和分析。预测结果显示,NAC78基因上游多个光响应元件、激素响应元件及转录因子结合位点(表2)。预测结果中含有7个ARBE类响应ABA的顺式元件,因此本试验使用50 μmol/L ABA处理Mo17自花授粉后15 d的玉米籽粒,检测处理不同时间的玉米籽粒中NAC78的转录水平表达情况。结果显示,NAC78的表达受到ABA的诱导,其表达水平在ABA处理后显著升高,在ABA处理籽粒6 h后相对表达量较0 h增加了11.4倍(图5)。ABA与植物对逆境胁迫的响应有密切联系,为探究NAC78是否与逆境响应相关,对三叶期幼苗进行NaCl和PEG处理,荧光定量结果表明,NAC78的表达受到NaCl与PEG的诱导,相对表达量呈现出先升高后降低的趋势,NaCl和PEG处理植株6 h后在叶片中的相对表达量分别增加了1.87和2.69倍(图6)。
3 讨论
本试验从Mo17玉米胚乳中克隆得到了NAC78基因,其N端具有的典型的NAM结构域,属于NAC转录因子家族。Phyre2三维结构预测结果显示NAC78的N端结构是由α螺旋环绕反向平行的β片层构成的,与ANAC019蛋白N端的结构相类似,推测NAC78的N端与ANAC019等许多NAC转录因子N端的功能相似,能够识别结合特定的靶基因序列、结合互作蛋白,但还需要进一步的试验证明[29]。多序列比对的结果表明,选取的20种植物中的NAC蛋白N端高度保守,推测这些转录因子可能具有相似的生物学功能。NAC蛋白的N端含有保守的NAC结构域,典型的NAC结构域又分为A-E 5个亚结构域,不同的亚结构域起着识别、结合DNA或蛋白质的功能,在亚结构域D中含有核定位信号,亚结构域C是DNA结合结构域,结合位点(WKATGTDK)在不同的NAC转录因子中高度保守[30]。而玉米NAC78与其在高粱、谷子、水稻、普通小麦、香蕉、毛果杨、木薯、棉花、马铃薯、番茄、烟草、猕猴桃、向日葵、黄瓜、拟南芥中的同源序列相应位点为(WKATGKDR),第6和第8位的氨基酸残基被碱性的赖氨酸(K)和精氨酸(R)替代,由此推测NAC78的靶基因与已知的拟南芥ANAC019等识别的DNA序列不同,或参与了植物中不同的调控途径[31]。本试验以各个物种中NAC78同源序列构建的系统发育树显示,玉米与谷子、高粱、水稻、普通小麦和香蕉聚为一大支,并且与谷子的亲缘关系最近。Pereira-Santana等[32]基于隐马尔可夫模型(HMM)鉴定了24种陆生植物的系统发育关系和NAC蛋白的分布,本试验得到的结果与其相似。
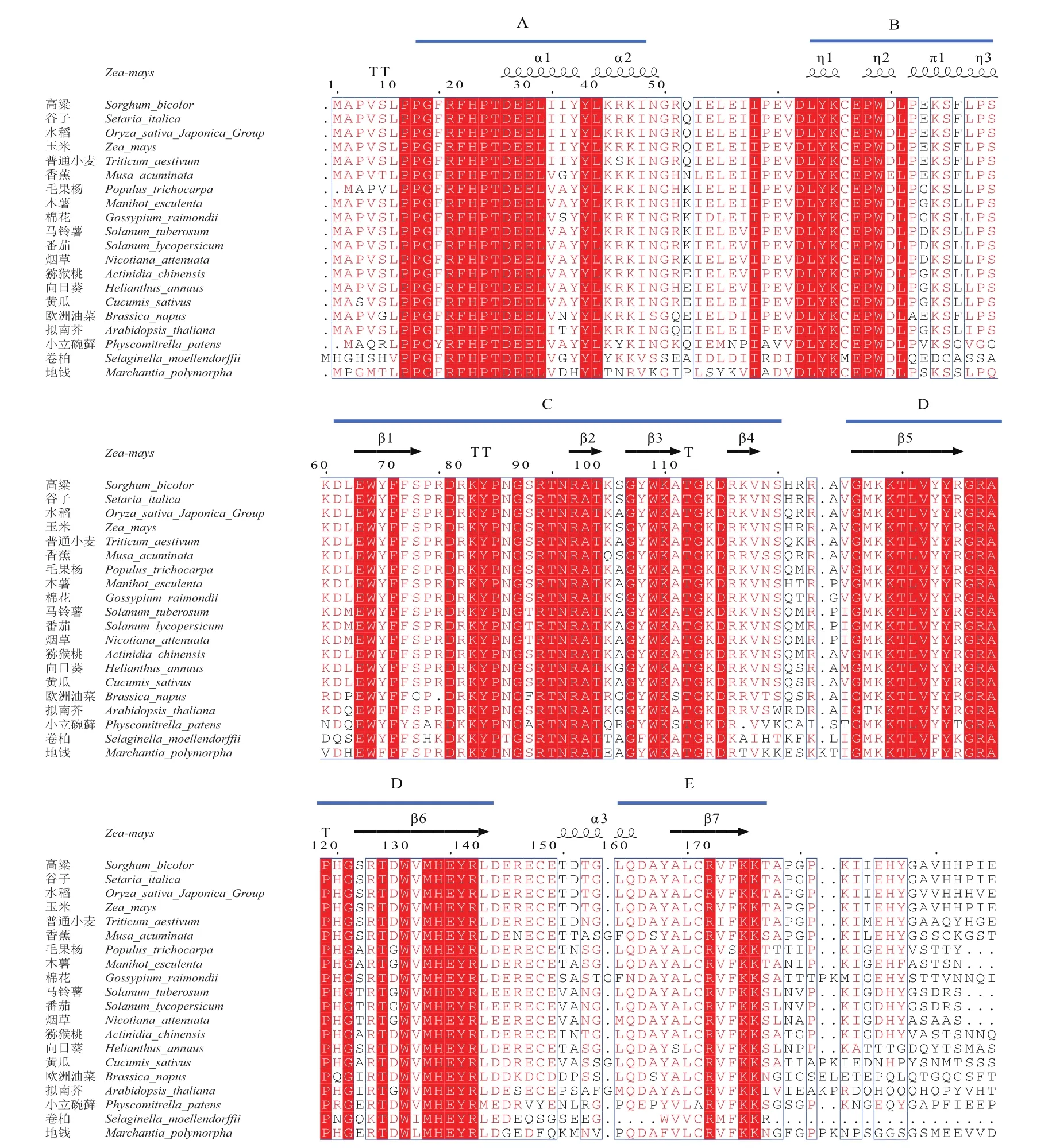
图2 不同物种NAC78同源基因多序列比对Fig.2 Multiple sequence alignment of NAC78 homologous genes in different species
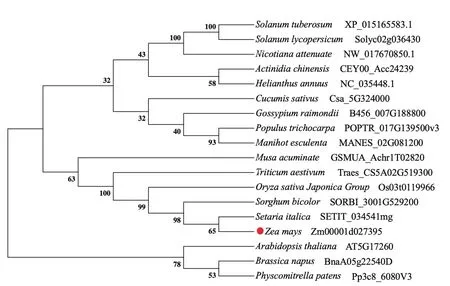
图3 NAC78同源基因的进化分析Fig.3 Evolutionary analysis of NAC78 homologous genes
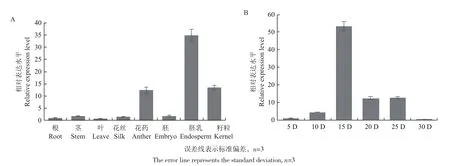
图4 NAC78在不同组织(A)及授粉后不同时期(B)胚乳中的相对表达量Fig.4 Relative expression of NAC78 in different tissues (A) and endosperm at different stages after pollination (B)
NAC78的表达具有组织特异性,对NAC78的转录水平表达情况的检测表明,NAC78在玉米的各个组织中均有表达,在胚乳中的表达量显著高于其他组织,由此可推知NAC78可能在胚乳发育的过程中起着重要的作用。NAC45/86是NAC78在拟南芥中的同源基因,Kaori等已证明NAC45/86在拟南芥筛管发育的过程中起着至关重要的作用,这两个转录因子通过对下游基因的调控使筛管分子的去核化过程正常进行[33]。筛管的发育与胚乳的发育都是特殊的细胞程序化死亡(programmed cell death,PCD)现象,筛管分子在细胞核降解之后仍然行使运输物质的功能[34-35]。同样,玉米胚乳细胞核在授粉后15-20 d开始降解,无核的胚乳细胞仍然具有活性并开始大量积累淀粉蛋白质,这一时期也是产量形成的重要阶段[36-37]。NAC78在胚乳中的表达变化呈现出先升高后降低的趋势,授粉后15 d的相对表达量较第5天增加52.52倍,据此推测NAC78可能参与胚乳细胞PCD过程的调控,其具体生物的功能有待进一步的深入研究。
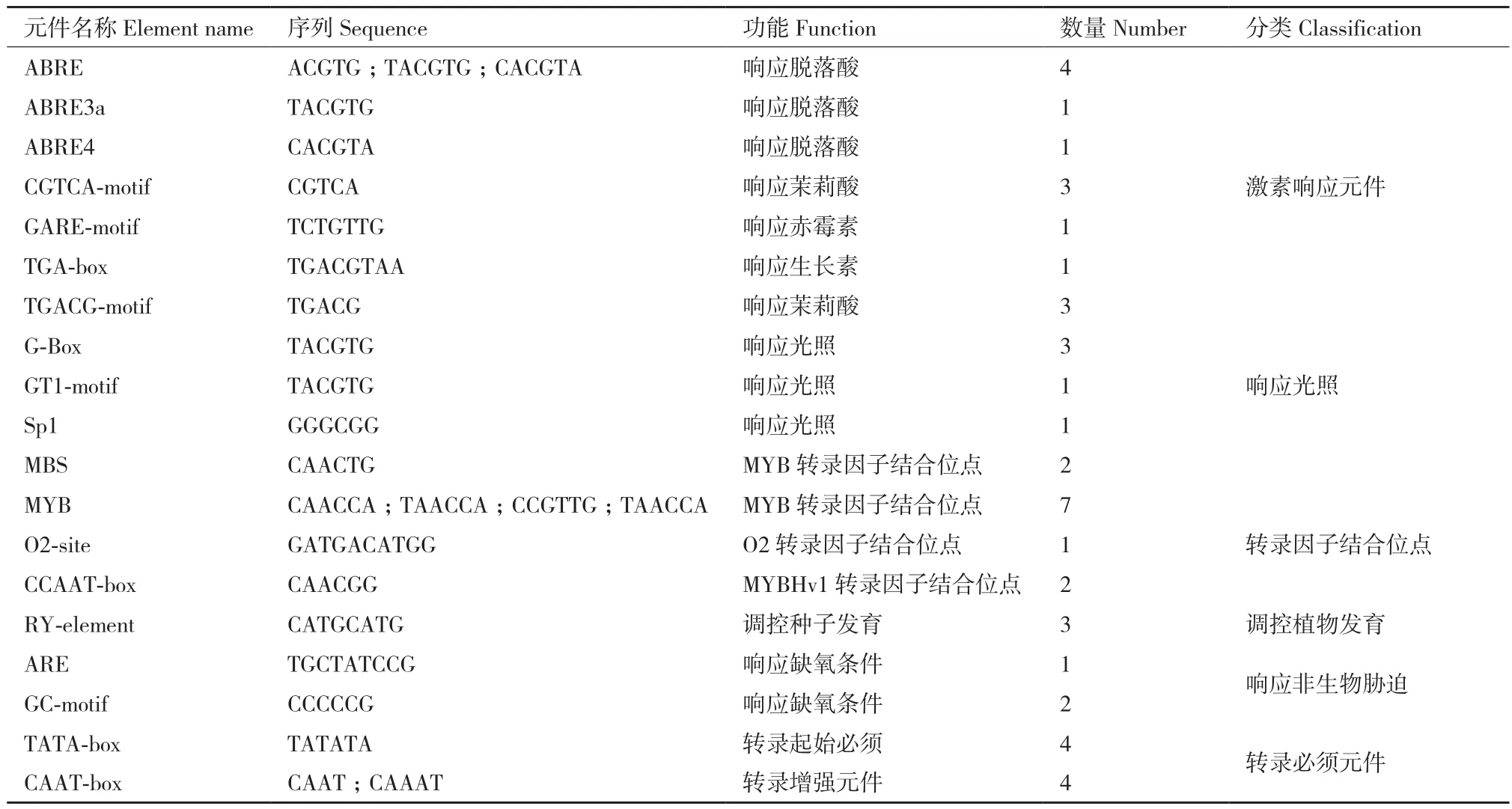
表2 NAC78启动子中的顺式作用元件Table 2 Cis-elements in the promoter of NAC78
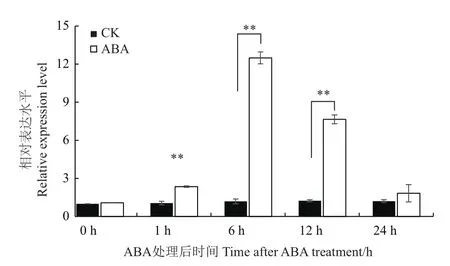
图5 ABA处理对玉米籽粒中NAC78表达的影响Fig.5 Effect of ABA treatment on NAC78 expression in maize kernel
ABA是一种重要的植物激素,在植物对逆境胁迫响应、生长发育等多个过程中起着重要的作用。ABA含量的增加能够诱导多种基因表达量上调,施用外源ABA能够增强植物对与干旱、低温等多种非生物胁迫的抵抗能力[38]。另外,在对水稻、小麦、玉米的研究中发现,ABA能够促进籽粒灌浆以及光合同化产物向籽粒的转运过程,使得产量增加[39-40]。前期的研究已发现多种转录因子能够响应ABA信号并调控植物的生命活动[41],拟南芥中的转录因子ABI4、ABI5能够响应ABA信号,进而调控种子的发育以及淀粉的合成[42-43]。NAC78上游顺式作用元件中含有7个AREB类的motif,AREB是响应ABA的顺式元件。为了探究NAC78的表达是否受到ABA的诱导,本试验使用ABA对玉米籽粒进行处理。结果显示,在ABA处理12 h后,NAC78的表达水平显著上升,表明NAC78的表达受到ABA信号的诱导。后续的胁迫处理结果表明NAC78的表达也受到NaCl和PEG和诱导。自然状态下,玉米灌浆期往往处于高温干旱天气,在这一条件下玉米需要多种复杂的机制调控自身适应环境胁迫,由本试验结果可推测,NAC78可能通过参与ABA调控途径影响相关基因的表达。
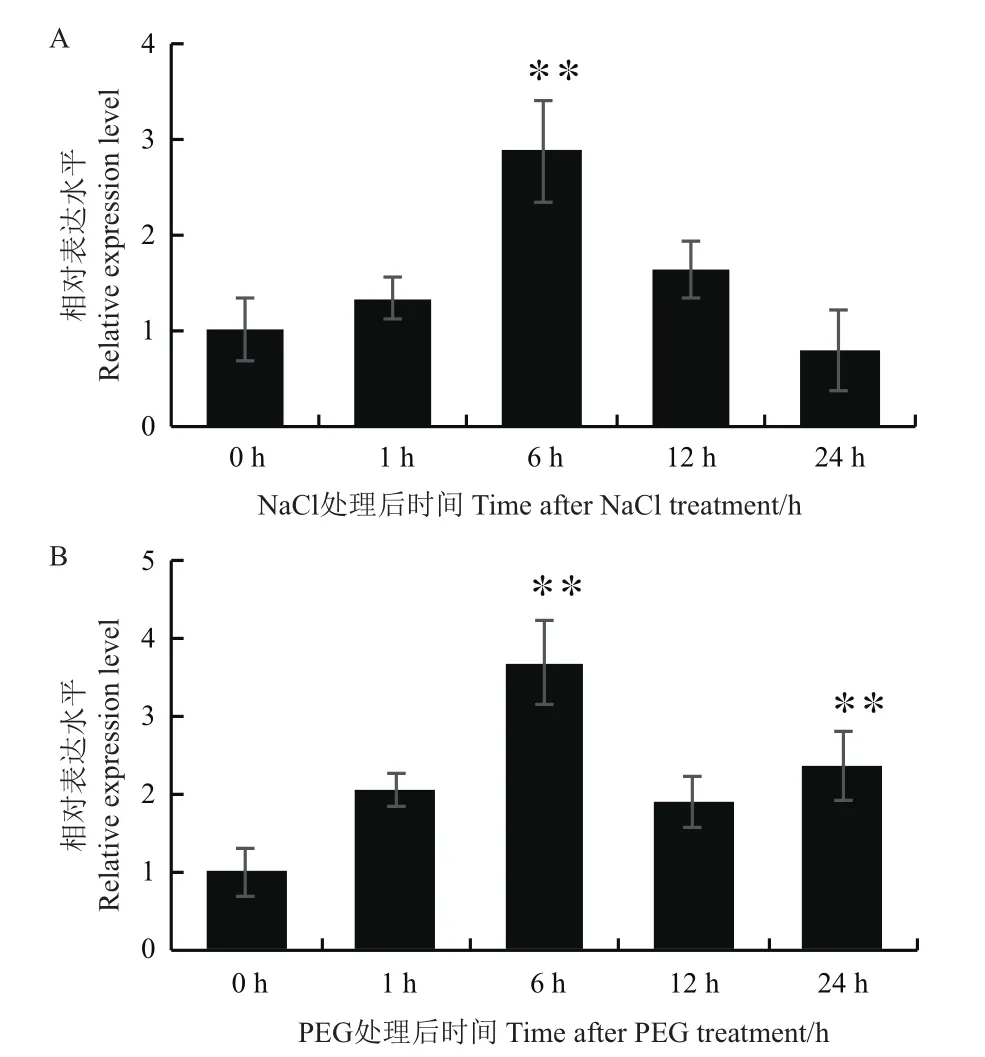
图6 NaCl和PEG处理对叶片中NAC78表达的影响Fig.6 Effects of NaCl and PEG treatment on NAC78 expression in leaves
4 结论
本试验克隆得到了一个新的转录因子NAC78,具有典型的NAM结构域,属于NAC转录因子家族。NAC78在胚乳中表达量显著高于其他组织,推测其可能参与胚乳发育过程的调控。此外,ABA,NaCl和PEG均能够诱导NAC78的表达,NAC78可能在玉米响应和抵抗非生物胁迫的过程中发挥作用。