马铃薯StSN2的克隆、定位及表达分析
2021-06-23彭洁邓孟胜张杰刘石锋罗李飞王西瑶
彭洁 邓孟胜 张杰 刘石锋 罗李飞 王西瑶
(1.四川农业大学,成都 611130;2.乐山市种子管理站,乐山 614000)
马铃薯(Solanum tuberosum)是茄科茄属植物,适应性广、产量高、营养价值丰富,是继水稻、小麦、玉米后的全球第四大粮食作物,在保障我国粮食可持续供给中扮演着十分重要的角色[1-3]。马铃薯贮藏是马铃薯产业发展的关键环节,每年因贮藏造成的损失高达25%,严重制约着马铃薯产业的发展以及贫困地区的脱贫致富。休眠是贮藏调控的关键生理环节,对休眠的调控直接影响着贮藏效率的高低。研究马铃薯块茎休眠的分子机理对于控制马铃薯块茎休眠和马铃薯块茎贮藏至关重要[4]。
研究表明,马铃薯休眠和发芽受多种激素的共同调控,尤其是ABA(abscisic acid)/GA(gibberellin)的平衡是决定块茎休眠到萌芽转变的关键,而油菜素内酯(brassinolide,BR)、乙烯(ethylene,ETH)以及细胞分裂素(cytokinin,CTK)等激素主要通过影响该平衡,进而调控休眠[5-6]。ABA是马铃薯块茎休眠的主要调控因子,人为去除内源ABA可以打破马铃薯的休眠[7],提高内源ABA含量显著抑制马铃薯发芽,而增强SnRK2s、ABI5、ABF等信号转导同样能延长休眠期[8-10]。GA、BR等激素能够拮抗ABA维持种子休眠的作用,外源GA处理抑制ABA水平,并且GA促进RGL2降解进而抑制ABI5的体内积累,BR也能通过调控ABI5的稳定性拮抗ABA的信号转导[9]。
Snakin/GASA(Gibberellic Acid-Stimulated in Arabidopsis)是一类受赤霉素诱导的基因,但也发现部分基因受到ABA的调控,在成花诱导、根的形成与生长、果实成熟等多种器官的发育过程中发挥作用[11]。每个植物中均含有多个GASA蛋白,拟南芥中共有15个GASA成员,玉米中有13个GASA蛋白,水稻中有11个[12]。GASA蛋白氨基酸组成一般是80-120个,GASA主要由12个高度保守的半胱氨基酸残基构成(C末端),N末端的18-29个氨基酸残基组成信号肽,而中间由7-31个极性氨基酸组成的可变化亲水区[11]。大多数GASA蛋白定位于细胞壁或质外体,如牵牛GIP2、GIP5定于细胞壁[13],拟南芥GASA5定位于细胞壁或者胞外基质[14],但水稻GSR1却定位在质膜、细胞质和细胞核中[15],马铃薯SN1在质膜上发挥功能[16]。
StSN2属于Snakin/GASA家族,前人研究表明其在防御病害中表现出重要作用。Nahirnak等[16]发现Snakin1、Snakin2、Snakin3的表达受细菌和外界伤害的影响,Berrocal-Lobo等[17]也证明StSN2可以抑制细菌的生长。近期研究表明,马铃薯Snakin调控植物生长发育,Northern杂交表明StSN1在茎和花芽中表达量最高,而StSN2在块茎和心皮中表达量最高。通过地上部特异表达StSN2导致茎段变粗变高、叶面积增加,而沉默StSN21后组培苗矮小白化、最终致死[18-20],并推测该基因是马铃薯生长的关键基因,在马铃薯细胞结构组成中起重要作用。SN2同源蛋白SN1在调控马铃薯细胞分裂、植株高度等发育表现出作用,且已有研究发现GASA成员GASA6参与ABA、GA对拟南芥种子萌发的调控[21],但关于StSN2在调控马铃薯休眠与萌芽的研究未见报道。四川农业大学农学院马铃薯研究与开发中心课题组前期转录组与蛋白质组研究表明,块茎休眠时StSN2表达量最高,而萌芽时表达量最低,表明StSN2可能在块茎休眠上具有作用。
本研究以“川芋10号”为材料,克隆StSN2编码序列,运用生物信息学的方法对其理化性质、结构、进化关系等进行分析,结合qRT-PCR分析StSN2在马铃薯各组织表达特异性,并检测StSN2对休眠萌芽相关激素的响应情况,旨为进一步探究StSN2与马铃薯块茎休眠的关系提供理论依据。
1 材料与方法
1.1 材料
供试材料为“川芋10号”,TRIzol试剂、反转录试剂盒Revert Aid First Strand cDNA ynthesis购自Thermo公 司, 高 保 真Prime STAR® Max DNA Polymerase酶、SYBR Green Master mix购自宝生物公司,DNA凝胶纯化回收试剂盒、质粒提取试剂盒、pMD19-T载体购自天根生化科技有限公司,大肠杆菌DH5α购自博迈德基因技术有限公司,引物合成、测序由擎科梓熙生物科技有限公司完成,其余试剂均为国产分析纯或者化学纯。
1.2 方法
1.2.1 取样 播种后第2周开始,分别提取马铃薯“川芋10号”块茎不同时期新鲜组织(幼薯、休眠块茎、萌芽块茎、芽,以及花蕾、幼叶、成熟叶、叶柄、茎和根)的总RNA,按照First Strand cDNA Synthesis Kit Revertra Acc逆转录的方法合成cDNA。
1.2.2 StSN2的克隆 从马铃薯基因组数据库(Potato genome sequencing consortium public data release,PGSC)中找到StSN2的CDS序列,利用primer 5.0软件设计引物并由成都擎科梓熙生物科技有限公司合 成 引 物(StSN2-F:5′-GGATCCAATGGCCATTCGAAAGCTCT-3′,StSN2-R :5′-CCCGGGTTAAGGGCATTTACGTT TGT-3′)。以cDNA为模板,进行PCR扩增,反应体系为2×PrimeSTAR Max Premix 25 μL、上下游引物(10 μmol/L)各 1.5 μL、cDNA 2 μL 和ddH2O 20 μL;反应程序为 98℃ 3 min;98℃ 30 s;58℃ 30 s;72℃ 2min,35个循环;72℃ 7 min。回收目的条带,并与pMD19-T载体连接后转化至大肠杆菌DH5α,挑取阳性单克隆进行菌落PCR检测,然后送测序。
1.2.3 StSN2的生物信息学分析 将测得的序列通过NCBI的BLAST比对同源序列(http://blast.ncbi.nlm.nih.gov/);利 用 ProtParam 程 序(http://web.expasy.org/protparam/)在线预测氨基酸序列分子量、理论等电点(pI)、不稳定系数等;通过SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线预测蛋白质二级结构,运用SWISS-MODEL(https://www.swissmodel.expasy.org/interactive)进行三维建模,使用在线工具MEG7软件进行系统进化树的构建。
1.2.4 StSN2的亚细胞定位 将之前扩增的StSN2与PBWA(V)HS-codb-GLosgfp载体酶切连接,PCR检测阳性菌落,测序,转化到GV3101农杆菌中,注射烟草叶片,处理48 h后,用激光共聚焦显微镜对处理的烟草叶片进行直接观察,并拍照记录。
1.2.5 qRT-PCR分析马铃薯不同组织的StSN2表达量 利用之前提取的马铃薯“川芋10号”茎块不同时期的CDNA,选择EF1αL作为内参,qRT-PCR法测StSN2表达量。根据马铃薯数据库(PGSC)设计引物。EF1αL-F:5′-CTTGTACACCACGTAAGGAG-3′,EF1αL-R :5′-GTCAATGCAAACCATTCCTTG-3′,StSN2定量引物设计根据全场CDNA序列来设计 :qStSN2-F :5′-CTCCTTGCTCCTTCTCCG-3′,qStSN2-R :5′-TAGCAAGGGCAAGTCTCAG-3′。荧 光定量PCR反应体系为2×Ssofast Eva Green 5 μL、上下游引物(10 μmol/L)各 0.4 μL、cDNA 4.2 μL ;反应程序为 95℃ 3 min;95℃ 5 s,56℃ 30 s,35 个循环;95℃ 15 s,65-95℃ 1 min做熔解曲线,各温度以0.5℃上升,并停5 s。每个试验样品设置3个重复,基因表达量用2-△△Ct方法计算相对表达量。
数据采用Microsoft Office Excel 2013整理和作图,Data Processing System 7.05统计分析软件进行数据分析,并用LSD法进行差异显著性检验,显著性水平设定为P<0.05。
2 结果
2.1 StSN2的克隆
对块茎总RNA琼脂糖凝胶电泳检测显示(图1-A),28S和18S条带明亮清晰,且亮度接近2∶1,表明总RNA质量好,可以用于后续试验。以新合成的cDNA为模板,扩增获得全长CDS序列300 bp左右(图1-B),并构建T载体(图1-C),测序结果显示StSN2的CDS总长为315 bp(图2)。

图1 马铃薯总RNA的提取和StSN2的扩增Fig.1 Extraction of total RNA and amplification of StSN2 in S.tuberosum
2.2 生物信息学分析
2.2.1 StSN2氨基酸序列分析 StSN2编码104个氨基酸(图2),结构域分析显示,StSN2包括12个高度保守的半胱氨酸残基区域,典型的Snakin/GASA超家族结构。
2.2.2 蛋白质理化性质分析 使用ProtParam软件对StSN2蛋白进行在线分析可知,StSN2蛋白的分子式为C461H767N141O146S13,原子总数为1 528个,相对分子质量为11.034 kD,推测该蛋白应该是一个比较稳定的、呈弱碱性的蛋白,主要是依据其理论的等电点和不稳定的系数分别为8.91及39.73,根据其平均亲水系数为-0.031,可知这一蛋白质应该属于亲水性的蛋白质。

图2 StSN2的编码序列及氨基酸序列分析Fig.2 Coding sequence and amino acid sequence analysis of StSN2
2.2.3 蛋白质结构分析 对StSN2蛋白的二级结构在线分析可知,该蛋白质的二级结构主要为α-螺旋和无规则卷曲2种(图3),且占的比例分别达到了35.5%及60.5%,然后是β-折叠,但其所占比例较小,仅为3.85%。并以马铃薯SN1为模型,构建SN2三维结构模型图(图4-A),与StSN1序列一致性为40.32%,其结果与二级结构较为一致。
2.2.4 跨膜区、亚细胞定位预测 通过TMHMMServerv.2.0 在线网站对StSN2 蛋白进行跨膜区域分析(图4-B),从预测的结果来看,该蛋白为分泌蛋白,作用于膜外,亚细胞定位通过lncLocator(http://www.csbio.sjtu.edu.cn/bioinf/lncLocator/)在线软件预测,结果表明,StSN2 蛋白主要存在于细胞核(73%)和细胞质(21%),利用 SignalP5.0 信号肽预测的结果显示StSN2蛋白存在信号肽的可能性为0.996,这和跨膜分析相一致,该蛋白是分泌蛋白的可能性极大。
2.2.5 系统进化分析 运用MEGA7.0软件构建系统进化树(图5),结果表明马铃薯StSN2与番茄、辣椒、烟草等茄科植物亲缘关系较近,而与番薯、黄瓜等植物次之,与菊科向日葵、葫芦科南瓜等亲缘关系最远,以上系统进化的亲缘关系与物种进化基本一致。
2.2.6 StSN2蛋白的亚细胞定位 以Pbwa(v)hsccdb-Glosgfp载体,构建StSN2-GFP融合表达载体,利用农杆菌介导法在烟草叶片中瞬时表达,结果显示(图6),StSN2-GFP和GFP均在叶片中成功表达,进一步观察发现StSN2-GFP主要分布在细胞核和细胞膜上,而空白对照荧光主要在细胞质膜,表明StSN2蛋白亚细胞定位于细胞核,但在细胞膜上可能也有定位。
2.2.7 StSN2组织的表达分析 基因的组织表达与功能密切相关,如StSN1在茎中表达量最高,而下调期表达显著矮化了植株。本试验通过qRT-PCR分析发现,StSN2在各组织具有表达(图7),以块茎、叶片、根等组织表达量最高,其次是叶片、根,在茎、花蕾、叶柄最低,尤其是在块茎中,StSN2表达量是茎、花蕾表达量的100倍以上,即使是在表达量第二的成熟叶片中,StSN2表达量也只有块茎的19.6%,表明StSN2可能在块茎以及叶片中表现出显著作用。
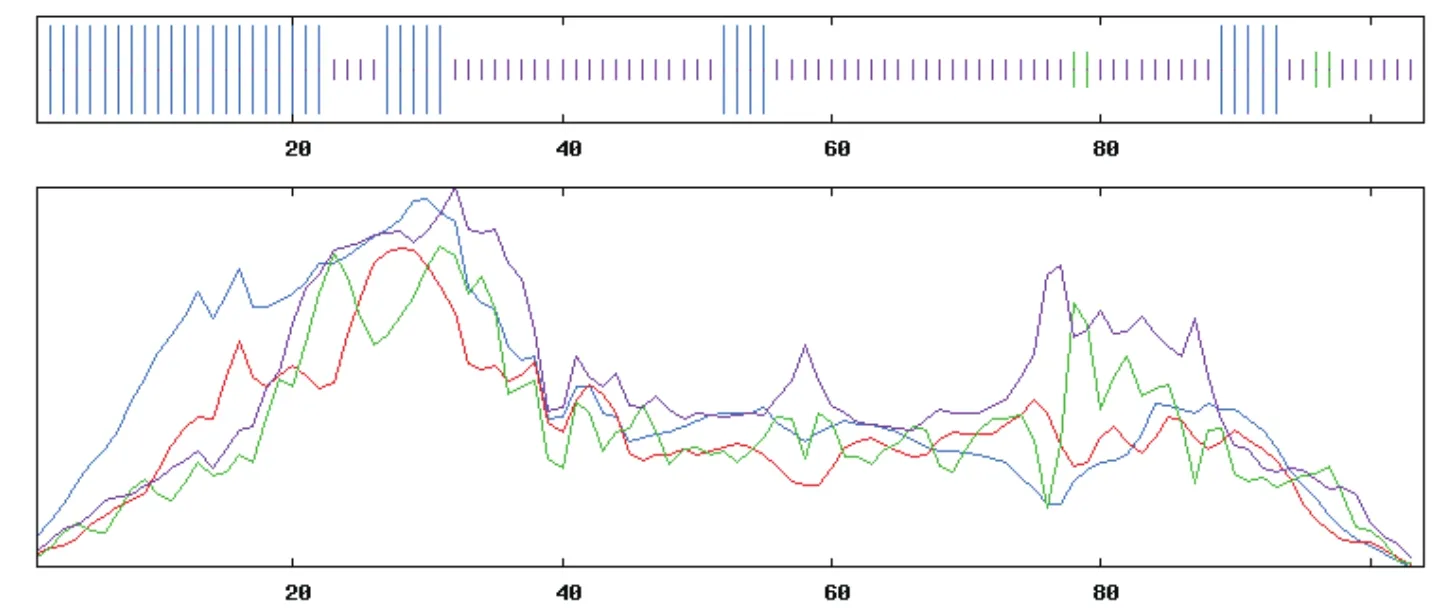
图3 StSN2蛋白二级结构预测Fig.3 Prediction of secondary structure of StSN2 protein

图4 StSN2蛋白三级结构预测Fig.4 Prediction of tertiary structure of StSN2 protein
2.2.8 激素调控块茎StSN2的表达 用20 mg/L GA3、250 nmol/L BR和4 mg/L ABA处理马铃薯块茎,结果发现,20 mg/L GA3、250 nmol/L BR都能提高马铃薯的发芽率,以GA3的效果最为明显,而ABA显著抑制了块茎的萌发(图8-A)。为进一步分析StSN2表达量对休眠萌芽激素的响应情况,qRT-PCR分析了不同时期StSN2的表达水平。结果表明,ABA、GA3以及BR影响了块茎中StSN2的表达,GA3、BR处理能够促进块茎休眠的打破,同时也下调了StSN2水平;值得注意的是,4 mg/L ABA明显的改变了块茎中StSN2原有的表达水平,在7、14和28 d时ABA处理下,StSN2表达量提高了50%左右,表明StSN2表达受到ABA上调,并且很可能参与ABA对块茎休眠的维持。

图5 StSN2系统进化树Fig.5 StSN2 phylogenetic tree

图6 亚细胞定位图Fig.6 Subcellular localization
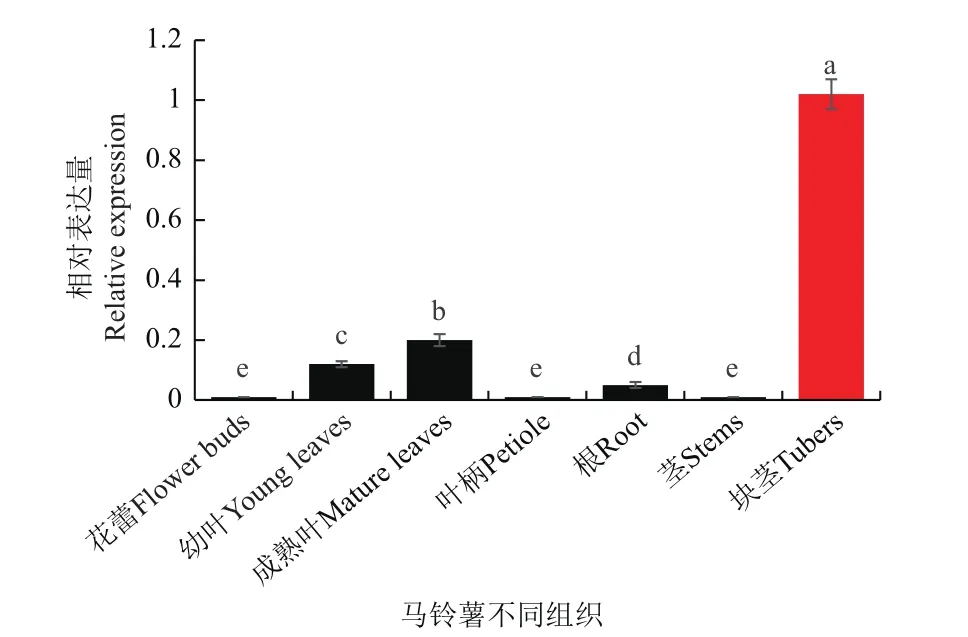
图7 马铃薯不同组织中StSN2的表达分析Fig.7 Analysis of StSN2 expression in different tissues of S.tuberosun
3 讨论
马铃薯块茎从休眠到休眠解除的过程十分复杂,受到基因、激素和环境的共同调节作用。马铃薯休眠难调控的问题长期制约着其产业的发展,目前主要是利用物理、化学的方法进行马铃薯的贮藏调控,过度使用催芽剂和抑芽剂,不但会造成环境污染,而且残存在马铃薯块茎的化学试剂对人体也有副作用,不利于人体健康。对马铃薯块茎休眠的分子机制进行研究,对于马铃薯产后贮藏以及调控种薯发芽具有重要的科学价值。
GASA(gibberellic acid stimulated Arabidopsis)蛋白对植物生长和抗逆发挥着关键作用,参与种子萌发、侧根的产生、茎的伸长以及开花等。近期研究表明,马铃薯Snakin调控植物生长发育,地上部特异表达StSN2导致茎段变粗变高、叶面积增加,而沉默StSN2后组培苗矮小白化、最终致死,SN1在调控马铃薯细胞分裂、植株高度等发育表现出作用[21-22]。因此,本研究通过克隆马铃薯“川芋10号”StSN2并分析其表达的特性,对后续休眠萌芽研究具有重要作用。本研究克隆到StSN2开放阅读框315 bp,编码104个氨基酸,与前期马铃薯全基因组和转录组研究一致。氨基酸序列结构分析发现,StSN2具有Snakin/GASA家族共有的12个高度保守的半胱氨酸残基,表明克隆到的StSN2序列属于Snakin/GASA家族。理化性质分析表明StSN2等电点为8.91,而前期研究鉴定到的StSN2等电点为9.6,可能存在不同品种间的差异。二级结构预测表明,StSN2主要以无规卷曲和α-螺旋为主,这与前期研究结果是一致的。系统进化树分析表明,马铃薯块茎中StSN2蛋白和辣椒、番茄、茄子等茄科中的进化关系最近,具有高度相似的保守结构域,预示着马铃薯SN2可能与番茄等近缘物种基因在功能上存在相似性,且已有研究报道StSN2与SlSN2同样在调控植物抗菌抗病性上表现出作用;而与黑麦、笋瓜亲缘关系较远,符合植物在进化中的关系,对多物种的SN2功能研究为丰富和完善SN2的功能提供了基础支撑。
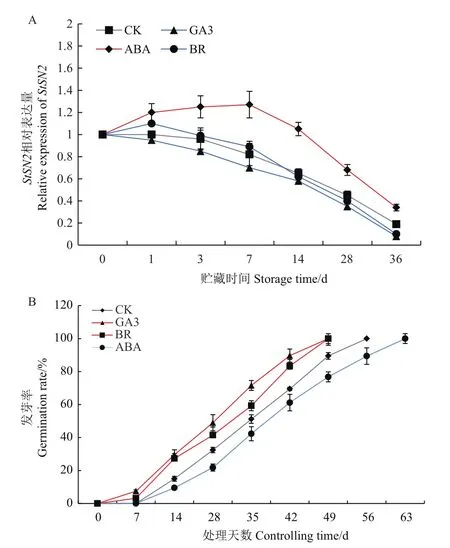
图8 3种不同的激素处理下马铃薯的发芽率及StSN2的表达分析Fig.8 Germination rate and StSN2 expression analysis of S.tuberosun treated with three different hormones
大多数GASA蛋白定位于细胞质膜或质外体,如牵牛GIP2、GIP5、拟南芥GASA5等,但本实验亚细胞定位显示StSN2定位在细胞核中,在质膜上也可能定位信号,与大部分Snakin/GASA家族蛋白定位是不同的。但在野生大豆中发现GsGASA1定位于细胞壁、细胞质以及细胞核[23];同样地,水稻GSR1也定位在质膜、细胞质和细胞核中,可能StSN2与GsGASA、OsGSR1在定位于细胞核中表现出相似地功能。本研究中,与空载体荧光(细胞膜周围)对照发现,StSN2同样在细胞膜位置有荧光信号,并且StSN2-GFP荧光信号显著强于空载荧光信号,表明StSN2在细胞膜上可能也存在荧光信号。且已有研究报道,拟南芥GASA14定位于质膜[16,24];在马铃薯中,StSN1就是定位在质膜,且StSN2与StSN1同属于马铃薯中的Snakin蛋白,可能存在某些功能的相似性,但究竟StSN2蛋白是否定位到质膜上还需要进一步验证。
马铃薯Snakin调控植物生长发育,在Northern杂交表明StSN1在茎和花芽中表达量最高,沉默StSN1显著影响了细胞的分裂和大小,并造成了叶面积的改变;但StSN2与StSN1组织表达特异性不同的是,StSN2在块茎和心皮中mRNA水平最高,这与我们的研究结果是一致的,表明StSN2可能在块茎中作用更大。更值得一提的是,不同的块茎发育时期StSN2表达量也存在较大差异,尤其是在休眠期块茎中StSN2最高,表明StSN2可能在调控块茎休眠中具有一定作用;而在茎、叶柄等组织表达量低,Oliveira-Lima等[12]研究结果发现在心皮中StSN2丰度较高,而本研究发现StSN2花蕾中几乎不表达,但这可能存在一定的组织差异,是否在心皮中表达有待深入分析。
激素是决定块茎休眠及其释放的关键因子,ABA、ETH等维持休眠,GA、BR等激素促进休眠的释放[6,25-26],本试验也证明4 mg/L ABA显著维持了块茎休眠,而20 mg/L GA3和250 nmol/L BR均显著促进了块茎休眠的释放,这与前期研究结果较为接近。也有研究表明4 mg/L ABA只能在处理前期降低块茎发芽率,而对休眠期的影响不显著。前期研究表明,Snakin/GASA受GA、ABA等激素调控,拟南芥GASA6参与GA、ABA对种子休眠的调控[12,18],但马铃薯Snakin是否调控块茎休眠仍有待进一步研究,本试验发现StSN2受到以上激素的显著影响,尤其是4 mg/L ABA显著诱导了块茎中StSN2的表达,这与Marta等[27]研究发现的ABA诱导StSN2的表达,而GA抑制StSN2的表达结果一致。250 nmol/L BR对StSN2的表达具有双向调控的作用,这也可能与BR在调控块茎萌芽上表现出多面性。综上表明,StSN2在调控马铃薯块茎休眠中具有重要作用,并可能参与休眠萌芽激素信号转导影响休眠期。
4 结论
从马铃薯品种“川芋10号”中克隆到StSN2,其全长315 bp,编码104个氨基酸,含有Snakin/GASA家族高度保守的12个半胱氨酸残基,与番茄、辣椒、烟草等茄科植物亲缘关系较近。StSN2受ABA等休眠激素诱导,可能参与马铃薯的休眠。