2型糖尿病患者血清IL-33水平与颈动脉内膜中层厚度的相关性研究
2021-06-22张岚谭泳梅周波唐云云
张岚,谭泳梅,周波,唐云云
珠海高新技术产业开发区人民医院内一科,广东珠海 519085
2型糖尿病是以血糖功能紊乱为主要特征的内分泌代谢性疾病,患者胰岛素分泌相对不足导致血糖急剧升高,出现多食多饮多尿和体重降低症状,对患者的生命健康和生活质量产生严重的负面影响[1]。近年来T2DM的发病率逐年升高,已成为危害人类健康的社会性问题,我国T2DM也有着较高的发病率,约为10%~20%[2]。糖尿病的发病过程中由于血糖的持续升高会引发诸多的并发症,最严重的慢性并发症是大血管病变,其病理基础是动脉粥样硬化,若糖尿病合并高血压将加重血管的动脉粥样硬化[3]。动脉粥样硬化最早期的影像学改变是内膜增厚,颈动脉内膜中层厚度(carotid intima-media thickness,IMT)可作为反映动脉粥样硬化进程中形态学的明确依据,间接地反映糖尿病大血管病变的程度[4-5]。白介素-33(interleukin-33,IL-33)被研究证实广泛分布和表达于各细胞及组织中,被认为是一种具有抗炎作用的细胞因子,可参与机体的体液免疫、细胞免疫以及部分心血管疾病的发病过程[6]。因此,该研究对2019年7月—2020年9月期间该院收治100例T2DM患者的血清IL-33水平进行检测,并探讨其与患者IMT的相关性。现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治100例T2DM患者为研究对象。纳入标准:①患者确诊为T2DM,符合《中国2型糖尿病防治指南(2017年版)》中相关诊断标准[7];②患者年龄35~70岁;③患者基础资料、临床检测资料完整;④自愿参与该项研究;⑤研究方案无伦理学争议。排除标准:①妊娠及哺乳期妇女;②全身恶性疾病患者;③炎症性疾病患者。患者入院后根据彩色多普勒超声检测患者IMT值,将其分为IMT正常组(IMT<1.0mm)33例、IMT增厚组(1.0mm≤IMT≤1.2mm)36例和斑块组(IMT>1.2mm)31例。该研究经该院伦理学委员会批准开展实施,患者或其家属均知情同意。
1.2 检测方法
3组患者入院后采集空腹静脉血约3mL,分离血清,以酶联免疫吸附试验法检测患者的血清IL-33水平,检测试剂盒由BIO-Legend公司提供。采用瑞士罗氏cobas c501型全自动生化分析仪及配套试剂检测患者的血糖指标和血脂指标包括空腹血糖(FPG)、糖化血红蛋白(HbA1c),三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)和C肽、同型半胱氨酸(homocysteine,Hcy)。
1.3 统计方法
2 结果
2.1 3组患者一般资料比较
3组患者的年龄、性别对比差异无统计学意义(P>0.05),斑块组身体质量指数(BMI)高于IMT增厚组,且高于IMT正常组,差异有统计学意义(P<0.05),见表1。

表1 3组患者一般资料比较
2.2 3组患者IL-33、IMT、C肽和Hcy水平比较
斑块组患者IL-33、C肽水平低于IMT增厚组和IMT正常组,而斑块组患者的IMT、Hcy高于IMT增厚组和IMT正常组,差异有统计学意义(P<0.05),见表2。
表2 3组患者IL-33、IMT、C肽和Hcy水平比较(±s)

表2 3组患者IL-33、IMT、C肽和Hcy水平比较(±s)
注:与IMT正常组比较,a P<0.05;与IMT增厚组比较,b P<0.05
组别 IL-33(pg/mL) IMT(mm) C肽(ng/mL) Hcy(μmol/L)IMT正常组(n=33)IMT增厚组(n=36)斑块组(n=31)F值P值98.28±11.92(72.18±9.22)a(49.12±7.10)ab 0.76±0.19(1.09±0.09)a(1.34±0.11)ab 2.87±0.56(2.11±0.45)a(1.67±0.50)ab 5.28±1.87(7.72±2.21)a(10.23±3.92)ab 208.026<0.001146.240<0.00146.788<0.00125.540<0.001
2.3 3组患者血糖指标比较
斑块组患者FPG、HbA1c高于IMT增厚组和IMT正常组,差异有统计学意义(P<0.05),见表3。
表3 3组患者血糖指标比较(±s)
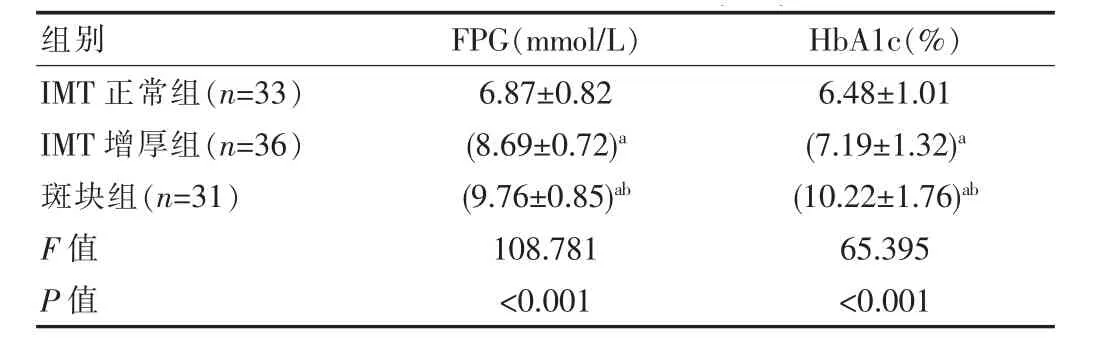
表3 3组患者血糖指标比较(±s)
注:与IMT正常组比较,a P<0.05;与IMT增厚组比较,b P<0.05
组别FPG(mmol/L) HbA1c(%)IMT正常组(n=33)IMT增厚组(n=36)斑块组(n=31)F值P值6.87±0.82(8.69±0.72)a(9.76±0.85)ab 6.48±1.01(7.19±1.32)a(10.22±1.76)ab 108.781<0.00165.395<0.001
2.4 3组患者血脂指标比较
斑块组患者的TG、TC、LDL-C高于IMT增厚组和IMT正常组,差异有统计学意义(P<0.05),见表4。
表4 3组患者血脂指标比较[(±s),mmol/L]

表4 3组患者血脂指标比较[(±s),mmol/L]
注:与IMT增厚组比较,a P<0.05;与IMT正常组比较,b P<0.05
组别 TG TC LDL-C IMT正常组(n=33)IMT增厚组(n=36)斑块组(n=31)F值P值1.88±1.02(2.41±1.10)a(6.62±1.26)ab 4.83±1.10(5.24±1.07)a(6.38±1.23)ab 2.09±0.46(2.67±0.51)a(3.37±0.58)ab 169.567<0.00116.044<0.00148.984<0.001
2.5 血清IL-33与临床各指标水平相关性分析
经Pearson检验分析,血清IL-33与C肽水平呈正相关性(r=0.498,P=0.001),与IMT、BMI、FPG、HbA1c、TG、TC、LDL-C、Hcy水平呈负相关性(r=-0.522、-0.481、-0.513、-0.508、-0.463、-0.474、-0.515、-0.491,P<0.005)。
3 讨论
糖尿病对机体的危害性不仅仅体现在三多一少方面,还体现在由于机体持续的高血糖的影响,可导致诸多并发症的出现,其中高血糖会导致患者的血流发生改变,出现动脉粥样硬化,进而引发机体的大血管病变。IMT是反映机体动脉粥样硬化的一个重要指标,也是大血管病变发生的一个重要预测因子[8]。但在具体的临床实践中IMT的测量受到主观性的影响较大,在应用过程中仍然存在着一定的不确定性,因此寻找反映动脉粥样硬化早期的客观依据依然是目前研究的主要方向。 IL-33于2005年被发现,随后的研究证实其基因广泛分布和表达于各细胞及组织中,IL-33又名IL-1F11,由Th2细胞,肥大细胞和先天性的淋巴细胞产生,主要参与Th2细胞介导的免疫应答、调节肥大细胞的功能,还作为一种细胞内核因子,调节基因转录[9]。IL-33可引起并调控多种炎症反应。
该研究表明,随着患者IMT增厚BMI水平也依次递增。在各组临床指标比较中,随着IMT的升高,IL-33水平降低,其他血糖、血脂指标则呈现升高或降低的规律性变化。初步表明IL-33可能在T2DM患者颈动脉粥样硬化的形成过程中发挥着重要作用,具有明显的抗炎和抗动脉粥样硬化的特性。因为IL-33是白细胞介素家族中的一员,广泛存在于机体的各组织细胞中,主要参与Th2细胞介导的免疫应答、调节肥大细胞的功能,有效调节基因转录。IL-33可通过对巨噬细胞、肥大细胞等免疫细胞功能的调节作用,发挥对机体各种炎症因子的抑制作用,从而抑制机体血管内的血栓生成,增加斑块的稳定性[10-11]。在进一步的相关性分析中显示,IL-33与C肽水平呈正相关性,与IMT、BMI、FPG、HbA1c、TG、TC、LDL-C、Hcy水平呈负相关性。表明IL-33与T2DM病情进展过程及血脂、血糖指标的变化有一定的相关性。也进一步表明了IL-33作为一种抗炎因子在T2DM患者颈动脉粥样硬化的形成过程中发挥着积极的调控作用,因此IL-33可作为一种新的靶点在糖尿病患者颈动脉粥样硬化斑块并发症的检测、预防和治疗中发挥重要作用。
综上所述,T2DM患者中血清IL-33水平处于低表达,并与IMT呈现负相关性,提示IL-33可能参与T2DM动脉粥样硬化的发生发展过程。因此,检测IL-33有助于评估T2DM动脉粥样硬化。
