富集钙乳酸菌的筛选及培养条件对富集效果的影响
2021-06-21王金厢李学鹏励建荣李婷婷郭晓华黄建联丁浩宸
石 月,王金厢,李学鹏,2,*,励建荣,李婷婷,郭晓华,黄建联,丁浩宸
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,国家鱼糜及鱼糜制品加工技术研发分中心,辽宁锦州 121013;2.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁大连 116034;3.大连民族大学生命科学学院,辽宁大连 116600;4.山东美佳集团有限公司,山东日照 276800;5.辽宁安井食品有限公司,辽宁鞍山 361003)
钙是地壳矿质元素中第五丰富的元素,也是人体必需营养素之一。人体内含钙量约为1000~1300 g,其中99%存在于骨骼和牙齿中,其余的1%分布在血液、细胞外液、软组织中,用于维持细胞正常生理功能,与骨钙保持动态平衡。目前,缺钙是人类的普遍现象。钙缺乏可导致佝偻病、骨质疏松症等,严重者可导致肌肉痉挛、心脏衰竭。传统补钙制剂主要分为无机钙和有机钙,无机钙主要来源于碳酸钙、动物鲜骨、贝壳等,价格低廉,来源广泛,但吸收效率低,溶解性差;有机钙主要包括葡萄糖酸钙、乳酸钙、醋酸钙等,这类钙较无机钙容易吸收,但成本较高,氨基酸螯合钙在一定程度上可以提高生物利用度,但易造成脂肪氧化[1]。近年来,有益微生物对于钙的富集和转化成为该领域的研究热点。
Tang 等[2]通过对草鱼骨的酶解、发酵,发现经过发酵的草鱼骨液能够促进大鼠的生长发育,钙能够在大鼠体内得到良好的吸收利用。韩克光等[3]对羊骨进行发酵,发酵后的骨液释放出更多的钙,体外抗氧化活性显著提高。Hu 等[4]利用嗜热链球菌和保加利亚乳杆菌共同发酵猪骨,发现经发酵后骨液中钙的含量提高到0.9942%。徐颖等[5]研究了乳酸菌富集硒的效果,张青松[6]研究了乳酸菌富集锌的特性,翟齐啸[7]研究了乳酸菌吸附镉以减除危害作用。乳酸菌具有良好的吸附金属离子能力,可以增强有益金属的作用,降低有害金属的毒性。利用乳酸菌富集钙,可以克服传统无机钙不易吸收、吸收量低等问题。
鱼骨是鱼类水产品加工过程中产生的主要副产物之一,通常与内脏等其他下脚料一起被简单加工成鱼粉等低值饲料,经济效益低[8]。鱼骨中钙含量丰富(高达20%~30%),是一种天然优质的钙源,因此可通过深加工制成补钙制剂、膳食营养强化剂和高钙食品等高附加值产品,为水产品加工副产物的综合利用提供可行路径[9]。但鱼骨中的钙质一般以羟基磷灰石结晶形式存在,且羟基磷灰石钙与胶原纤维有机结合,导致骨钙自然溶出量甚微,钙元素的利用率低。采用益生菌发酵可将鱼骨中的无机钙转化为有机钙,对于有效利用鱼骨中的钙具有重要意义。鉴于此,本文研究筛选富集钙能力强的乳酸菌,提高钙富集量,并优化钙富集条件,初步探索结合机制,为进一步将乳酸菌用于鱼骨发酵制备有机钙提供理论依据。
1 材料与方法
1.1 材料与仪器
植物乳杆菌CY1-1、植物乳杆菌Z7、戊糖片球菌DBY2-5-1、干酪乳杆菌D400、米酒乳杆菌DL10、嗜酸乳杆菌DL12、清酒乳杆菌YP4-5 以上菌株由本实验室保藏。MRS 肉汤 青岛海博生物技术有限公司;乙二胺四乙酸、氯化钙 均为分析纯,国药集团化学试剂有限公司。
THERMO 高速冷冻离心机 美国Thermo 公司;DL-CJ-2N 超级洁净工作台 北京市东联哈尔仪器制造有限公司;CHA-S 恒温振荡器 上海梅香仪器制造有限公司;SPX-25 生化培养箱 宁波海曙赛福实验仪器厂;GI54DS 立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;XE-70 原子力显微镜 韩国Park Systems公司;MS105UD 电子分析天平 瑞士梅特勒-托利多有限公司;Imark 酶标仪 美国BIORAD 公司。
1.2 实验方法
1.2.1 乳酸菌的活化与培养 取冻存于甘油中的乳酸菌,在MRS 肉汤培养基中接种2%进行活化,在37 ℃恒温培养24 h,连续培养三代,用于后续实验。
1.2.2 生长曲线的测定 参考吉莉莉等[10]的方法略有修改,将活化后的乳酸菌按2%的接种量接种于MRS 肉汤中,在37 ℃恒温培养24 h,每隔2 h 取样,将菌液取200 μL 置于96 孔板中,以空白培养基为对照,用酶标仪测定吸光值OD595,根据OD595绘制生长曲线。
1.2.3 产酸能力的测定 参考陈铭[11]的方法略有修改,将活化后的乳酸菌按 2%的接种量接种于MRS 肉汤中,在37 ℃条件下恒温培养24 h,每隔6 h进行取样测定乳酸含量。取发酵液3 mL 置于锥形瓶中,按1:3 的比例加入蒸馏水,用标定的0.1 mol/L的氢氧化钠溶液进行滴定,将总的可滴定酸转换成乳酸含量:
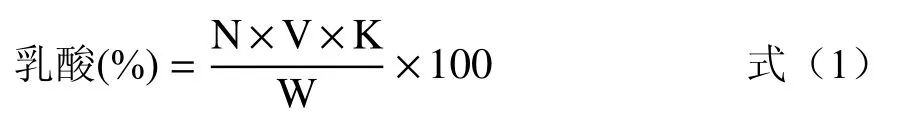
式中:W,发酵液含量,mL;N,NaOH 标准溶液浓度,mol/L;V,NaOH 消耗量,mL;K,0.09 为乳酸转化系数。
1.2.4 乳酸菌对钙的富集实验 参考陈宇凌等[12]和张付云等[13]的方法略有修改,将发酵物8000 r/min离心20 min 收集菌体,再用超纯水将菌体洗涤两次,获得湿菌体备用。将湿菌体重悬于灭菌后钙离子浓度为1.2 mg/mL 的氯化钙溶液中进行富集,37 ℃重悬2 h,再经8000 r/min,20 min 离心除去菌体,利用EDTA 滴定法测定上清液中钙离子的含量[13],每个样品重复测定三次。

式中:钙富集量,mg/g;钙离子总量、上清液中钙离子含量,mg;菌体质量,g。
1.2.5 乳酸菌对钙富集条件的优化 将乳酸菌活化三代,单一菌株按2%接种量接入培养基中,37 ℃下恒温培养24 h;复合菌株按1:1 的比例、2%接种量接入培养基中,37 ℃恒温培养24 h。在4 ℃条件下,8000 r/min,离心20 min 获得菌体,再用超纯水洗涤两次,获得湿菌体备用。
1.2.5.1 培养时间对乳酸菌富集钙的影响 将乳酸菌活化三代,单一菌株按2%的接种量接入钙离子浓度为1.2 mg/mL 的MRS 液体培养基中,37 ℃恒温培养24 h;复合菌株按1:1 的比例、2%接种量接入钙离子浓度为1.2 mg/mL 的MRS 液体培养基中,37 ℃恒温培养24 h。测定菌株的生长曲线,按照生长曲线选取对数期和稳定期。
对各乳酸菌进行扩培,在对数期和稳定期进行钙富集量的测定。取一定量的乳酸菌,在1.2 mg/mL的氯化钙溶液中37 ℃重悬2 h,在4 ℃条件下,8000 r/min,离心20 min 去除菌体,利用EDTA 滴定法测定上清液中的钙离子浓度,钙富集量的计算同1.2.4。
1.2.5.2 钙离子浓度对乳酸菌富集钙的影响 将乳酸菌活化三代,单一菌株按2%的接种量接入钙离子浓度为0、0.6、1.2、1.8 mg/mL 的MRS 液体培养基中,37 ℃恒温培养24 h;复合菌株按1:1 的比例、2%接种量接入不同钙离子浓度的MRS 液体培养基中,37 ℃恒温培养24 h。以空白培养基为对照,用酶标仪测定吸光值OD595,根据OD595绘制生长曲线,观察含钙离子的培养基对乳酸菌生长情况的影响。
称取一定量的氯化钙,溶于超纯水,调节溶液中钙离子浓度分别为0.6、1.2、1.8 mg/mL,将于正常培养基中培养的湿菌体重悬于不同浓度氯化钙溶液中,以菌体重悬于超纯水中作为空白对照,37 ℃重悬2 h;再经离心去除菌体,利用EDTA 滴定法测定上清液中的钙离子浓度,并计算出乳酸菌的钙富集量及钙转化率。
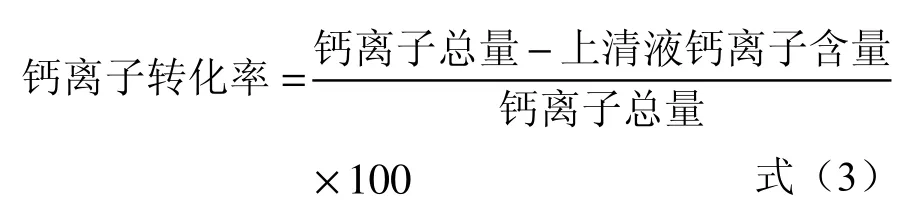
式中:钙离子转化率,%;钙离子总量、上清液中钙离子含量,mg。
1.2.5.3 不同pH 对乳酸菌富集钙的影响 配制钙离子浓度为1.2 mg/mL 的氯化钙溶液,初始pH 为7.2,利用HCl 调节pH 为6、5、4、3,将湿菌体重悬于不同pH 的氯化钙溶液中,37 ℃重悬2 h;再经离心去除菌体,测定上清液中的钙离子浓度,并计算出乳酸菌的钙富集量。
1.2.5.4 培养温度对乳酸菌富集钙的影响 配制钙离子浓度为1.2 mg/mL 的氯化钙溶液,将湿菌体重悬于不同温度的氯化钙溶液中,35、37、40、42 ℃重悬2 h;再经离心去除菌体,利用EDTA 滴定法测定上清液中的钙离子浓度,并计算出乳酸菌的钙富集量。
1.2.6 原子力显微镜观察微观结构 以植物乳杆菌CY1-1 为实验菌株,将湿菌体在钙离子浓度为1.2 mg/mL 和空白试剂中37 ℃重悬2 h,重悬后离心收集菌体。将获得的湿菌体稀释200 倍,取1 滴置于盖玻片中央,自然干燥后在原子力显微镜下检测,扫描范围为2.5 μm×2.5 μm。
1.3 数据统计分析
所有实验均重复3 次,采用SPSS19.0 软件进行方差分析,以Duncan’s 法进行检验,利用 Origin 2018进行作图,Gwyddion 2.53 对图片进行处理。
2 结果与分析
2.1 乳酸菌的生长曲线
图1 为七种乳酸菌的生长曲线。由图可以看出,七种乳酸菌的生长趋势大致相同,均呈先上升后平缓的趋势。在对数生长期(4~12 h)生长情况较好的是嗜酸乳杆菌,干酪乳杆菌的生长情况滞后于其余乳酸菌。进入稳定期后各乳酸菌的差异逐渐缩小,此阶段生长情况最好的是植物乳杆菌CY1-1,这可能是由于植物乳杆菌具有广泛性、普遍性,生长稳定,干酪乳杆菌生长情况较其余菌株差。
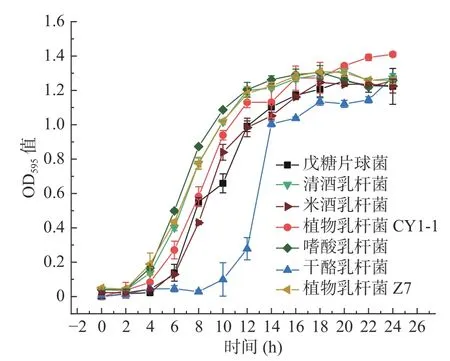
图1 七种乳酸菌的生长曲线图Fig.1 Growth curve of seven kinds of lactic acid bacteria
2.2 乳酸菌的产酸能力测定
产酸能力是衡量乳酸菌品质的重要指标,优良的乳酸菌应兼具有良好的生长能力与产酸能力,从而提高发酵的产品风味与营养价值[14]。本研究对七种乳酸菌的产酸能力进行测定,结果如图2。根据图2可知,随着培养时间的延长,各乳酸菌产酸量逐渐上升,培养24 h 后七种乳酸菌产酸量由大到小依次为:嗜酸乳杆菌DL12>植物乳杆菌CY1-1>米酒乳杆菌DL10>清酒乳杆菌YP4-5>植物乳杆菌Z7>戊糖片球菌DBY2-5-1>干酪乳杆菌D400。乳酸菌的产酸速率与生长速率具有一致性,嗜酸乳杆菌具有较强的产酸和耐酸能力,产酸量较高;戊糖片球菌及干酪乳杆菌的生长情况滞后于其余菌株,产酸能力亦稍低于其余菌株。
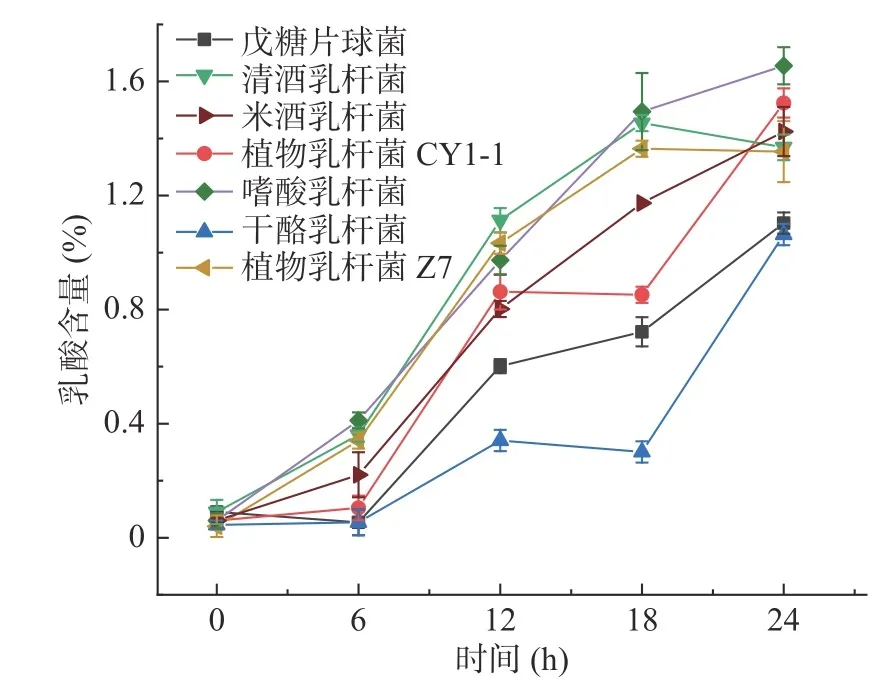
图2 七种乳酸菌的产酸曲线Fig.2 Acid production curve of seven kinds of lactic acid bacteria
2.3 乳酸菌富集钙能力的测定
将七种乳酸菌在钙离子浓度为1.2 mg/mL 的氯化钙溶液中进行培养,以溶液中钙离子浓度差与乳酸菌浓度之比显示为钙富集的差异。从图3 可以看出,各菌株对钙的富集有明显差异,钙富集量在17.01 到45.41 mg/g 间不等,之前亦有实验表明,乳酸菌对金属离子的富集有差异[15-16]。七种乳酸菌中钙富集量最高的是植物乳杆菌CY1-1,其钙富集量为45.41 mg/g,其次为植物乳杆菌Z7,钙富集量为37.9 mg/g。为探讨乳酸菌复合发酵对钙富集能力的影响,选取以上两种乳酸菌与其余五株菌进行复合,研究复合菌株的钙富集能力。
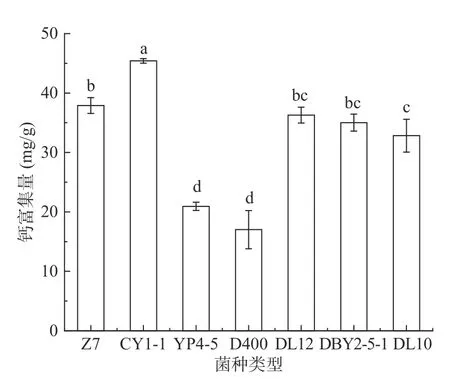
图3 七种乳酸菌钙富集量Fig.3 Calcium enrichment of seven lactic acid bacteria
2.4 复合菌株富集钙能力及产酸能力的测定
复合菌株的富集钙能力与产酸量如图4 所示。从图3 中可以看出植物乳杆菌Z7 的钙富集量为37.9 mg/g,经复合后,Z7+DL12 组合低于单菌富集量,其余组均高于单一菌种富集量。植物乳杆菌CY1-1 钙富集量45.4 mg/g,经复合后,CY1-1+DL10、CY1-1+YP4-5 组合低于单一菌种富集量,其余组钙富集量均得到提升。文献表明,乳酸菌复合可能存在竞争抑制,产生负相互作用,使复合菌体浓度下降[17]。而植物乳杆菌CY1-1 和嗜酸乳杆菌DL12 复合菌株,植物乳杆菌Z7 和清酒乳杆菌YP4-5 复合菌株,在钙富集量和乳酸含量上均有提升。因此,接下来的试验,选择植物乳杆菌CY1-1、植物乳杆菌Z7、植物乳杆菌CY1-1 和嗜酸乳杆菌DL12 复合、植物乳杆菌Z7 和清酒乳杆菌YP4-5 复合菌株作为试验菌株进行钙富集条件的优化。
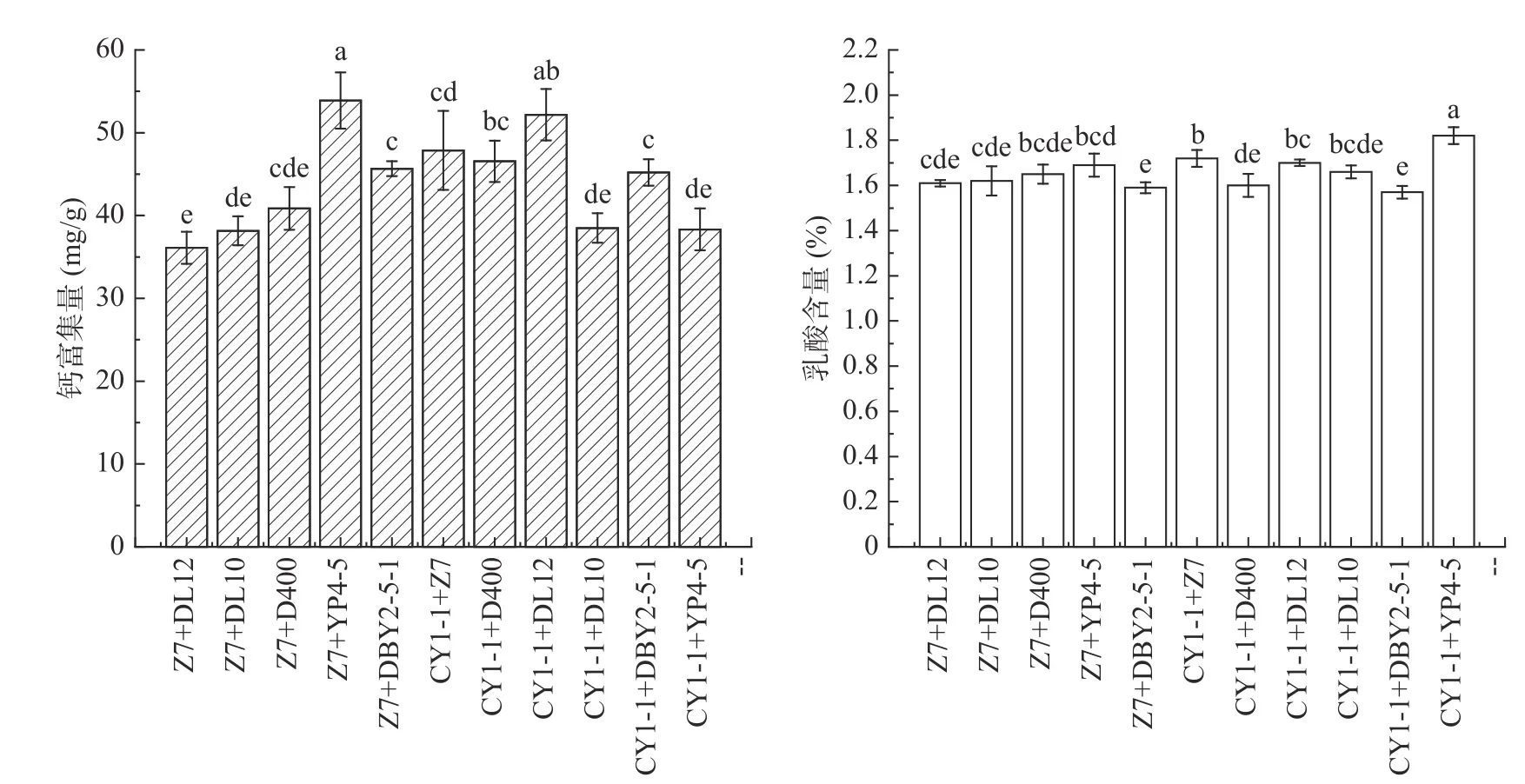
图4 复合菌种富集钙能力及乳酸产量Fig.4 Calcium enrichment capacity and lactic acid production of composite strains
2.5 乳酸菌富集钙的影响因素研究
2.5.1 培养时间对乳酸菌富集钙的影响 为了研究时间对乳酸菌富集钙的影响,将四组实验菌株(CY1-1、CY1-1+DL12、Z7、Z7+P4-5)接种于含Ca2+含量为 1.2 mg/mL 的MRS 培养基中,37 ℃恒温培养24 h,每隔2 h 进行取样测定生长曲线。根据生长曲线(图5),各组乳酸菌在4~10 h 生长迅速,在14~24 h生长趋势基本平缓,故选取8 和22 h 为时间点进行实验,研究对数期、稳定期的菌株富集钙的差异。将乳酸菌培养8 和22 h,收集并洗涤菌体,将菌体重悬于氯化钙溶液中进行钙富集实验,测定结果如图6所示,可以看出对数期的菌株富集钙含量要低于稳定期。对数期钙富集量约占稳定期的80%~90%,这可能是在细胞增殖过程中,钙与细胞器结合,蛋白质和多糖等物质含有的氨基、羧基、羟基等基团,能与金属离子发生相互作用[18],而在稳定期乳酸菌生长稳定、生物累积量较大,钙离子通过载体进入细胞或与特定物质结合[19],从而完成钙的富集作用,因此钙富集量要高于对数期。
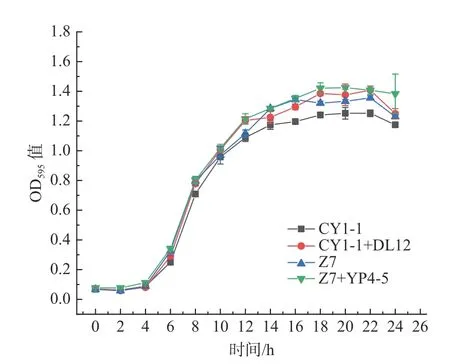
图5 单菌、复合菌株生长曲线Fig.5 Growth curves of single and composite strains
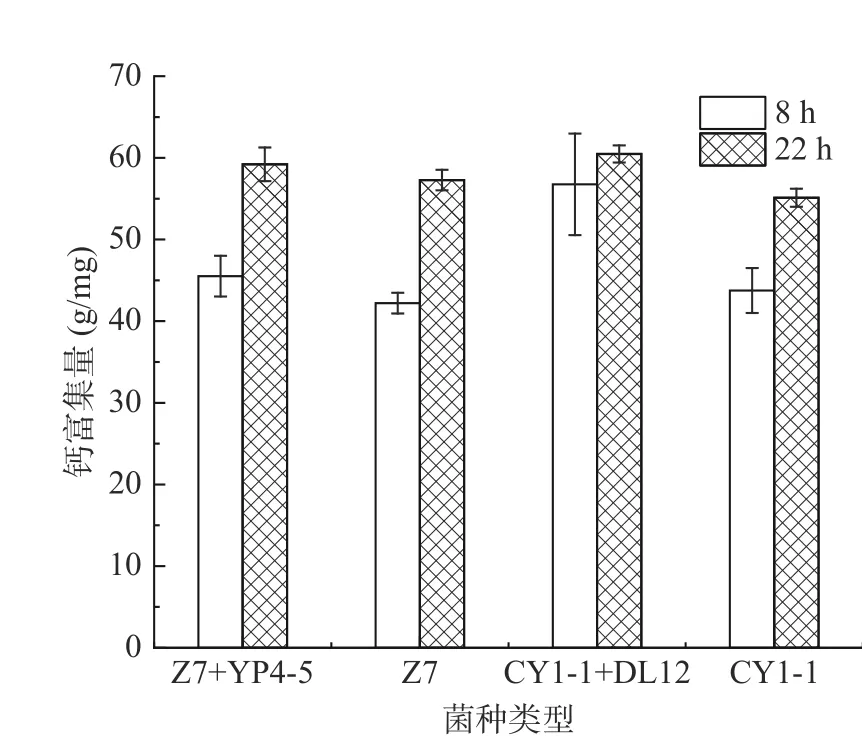
图6 培养时间对钙富集量的影响Fig.6 Effect of incubation time on calcium enrichment
2.5.2 钙离子浓度对乳酸菌富集钙的影响 将四组乳酸菌分别接种在钙离子浓度为0、0.6、1.2、1.8 mg/mL的培养基中,对四种乳酸菌的生长曲线进行测定。从图7 可以看出,各菌株随着钙离子浓度的升高,乳酸菌的生长能力均有所降低。这可能是由于培养基中成分比较复杂,含有K+、Na+、Mg2+等金属离子,而高浓度钙离子的存在,阻碍乳酸菌与其他金属阳离子结合[20-21],导致生长能力下降。另外高浓度的金属离子可能对菌体产生毒害或抑制作用,从而使生长量降低[22-23]。根据图8 可知,随着钙离子浓度的升高,钙富集量有所提升。这是因为在氯化钙溶液中进行富集,溶液中仅有一种金属阳离子——钙离子,不存在其他金属离子竞争,菌体的基团结合位点基本上都被钙离子占据,所以富集量较高。植物乳杆菌CY1-1+嗜酸乳杆菌DL12 组富集量在钙离子含量为1.8 mg/mL 时低于1.2 mg/mL 组,这可能是由于钙离子浓度过高,抑制了该复合菌株的离子富集,导致富集量降低。根据钙转化率来看,只有植物乳杆菌Z7+清酒乳杆菌YP4-5 组合的转化率和钙离子浓度成正比,这可能是菌株复合后吸附钙离子能力提高,没有因为浓度增大而出现富集量的降低,且该组的钙富集量远高于其余组合,故转化率有所提升。其余三组钙转化率最高的均为钙离子含量为1.2 mg/mL组。结合乳酸菌生长趋势、钙富集量、钙转化率得出,适合乳酸菌富集的钙离子浓度为1.2 mg/mL。
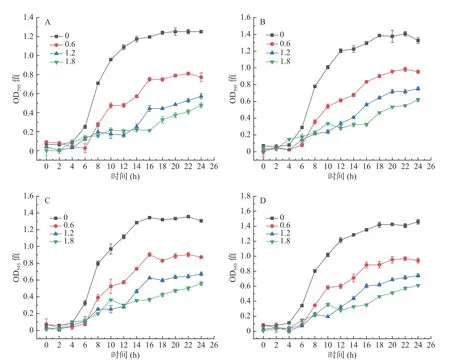
图7 乳酸菌在不同钙离子浓度下的生长曲线Fig.7 Growth curves of lactic acid bacteria at different calcium ion concentrations
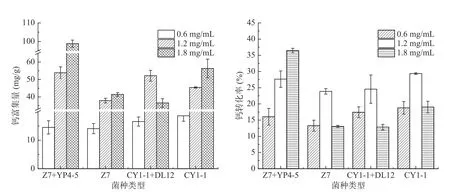
图8 乳酸菌在不同钙离子浓度下的钙富集量和转化率Fig.8 Calcium enrichment and conversion rate of lactic acid bacteria at different calcium ion concentrations
2.5.3 不同pH 对乳酸菌富集钙的影响 pH 是影响生物吸附金属离子的重要因素之一[24-25],在较低的pH 下,由于氢离子竞争结合位点,导致乳酸菌与其他离子的结合数量下降。随着pH 的升高,细胞表面官能团的负电荷增加,从而有利于离子与乳酸菌的结合。如图9 所示,Z7 和CY1-1+DL12 组中,pH 在3~5 范围内的趋势是pH 越小,钙富集量越多,这可能是由于酸性条件下有利于钙离子的溶出,使钙离子更多的暴露在溶液中与乳酸菌进行富集。从四组菌株整体看,最优富集量出现在pH 为5、6 和初始的pH(7.2),这是因为植物乳杆菌的最适pH 在6.2~6.6 的范围内[26]。从图中可以看出,Z7 的最适pH 为6,CY1-1+DL12组的最适pH 为7.2,Z7+YP4-5和CY1-1 组在pH 为5 和7.2 相差不多。
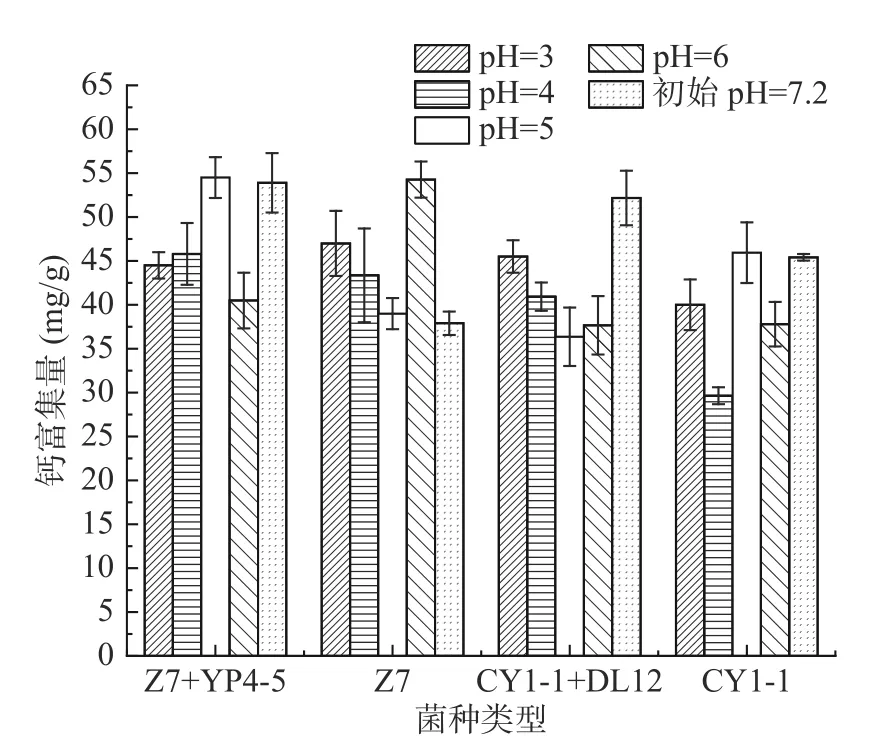
图9 pH 对乳酸菌钙富集量的影响Fig.9 Effect of pH on calcium enrichment of lactic acid bacteria
2.5.4 培养温度对乳酸菌富集钙的影响 乳酸菌最适发酵产酸温度是40~42 ℃,而最适生长温度是35~37 ℃[27]。实验选择35、37、40、42 ℃培养实验菌株,在钙离子含量为1.2 mg/mL 中的氯化钙溶液中进行富集,比较富集钙效果。从图10 可以看出,温度对于各组间钙富集量的影响具有一定差异,四组乳酸菌总体趋势为随着温度升高钙富集量呈先上升后下降趋势。其中Z7+YP4-5 组的最适温度为37 ℃,其余三组的最适温度为40 ℃。Mrvčic 等[28]研究温度对于乳酸菌富集锌的影响,结果显示乳酸菌富集锌的能力随着温度的升高而提高,原因可能是温度影响了菌体的活性或乳酸菌与金属结合物的稳定性。
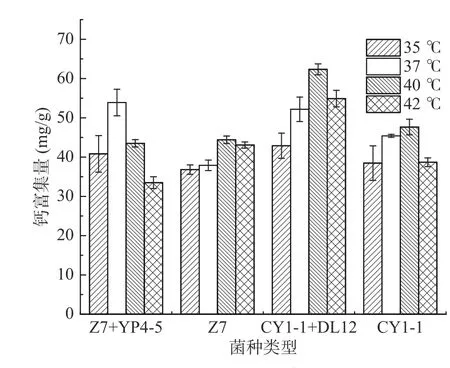
图10 培养温度对钙富集量的影响Fig.10 Effect of culture temperature on the enrichment of calcium
2.6 原子力显微镜观察富集前后菌体变化
原子力显微镜(AFM)可以在接近生理条件的溶剂体系中直接观测生物分子的表面特征,可用于表征不同软度的生物样品甚至活体细胞,并且具有样品处理简单、图像重复性强、力学灵敏度高和空间分辨率高的优势,是研究生物学的有力工具[29-31]。以植物乳杆菌CY1-1 为观察对象,观察乳酸菌富集钙前后菌体细胞变化。图11 显示的是植物乳杆菌富集钙前后原子力显微镜微观结构的影响,在三维形貌图中,较暗的区域为表面较低的部分,较亮的区域为表面较高的部分[32],可以看出,乳酸菌富集钙后的颜色差异较大,细胞表面高度差较大;正常乳酸菌表面凸起形状平坦圆滑,富集后的凸起形状尖锐,说明乳酸菌在与钙结合后聚集颗粒大且多。综上所述,乳酸菌富集钙离子后,菌体表面聚集了大量钙离子,致使细胞形态与正常菌株差异较大。

图11 原子力显微镜观察乳酸菌富集钙前后菌体细胞变化Fig.11 Atomic force microscopy observation of changes in bacterial cells before and after calcium enrichment by lactic acid bacteria
3 结论
本文对七种乳酸菌的生长能力、产酸能力、富集钙能力进行了测定,筛选出钙富集量最高的是植物乳杆菌CY1-1,富集量为45.41 mg/g;其次为植物乳杆菌Z7,富集量为37.9 mg/g。将以上两种菌株与其他乳酸菌菌株复合,结果表明植物乳杆菌Z7+清酒乳杆菌YP4-5 复合菌株,植物乳杆菌CY1-1+嗜酸乳杆菌DL12 复合菌株在钙富集量和乳酸含量上均有提升。选取以上四种组合进行富集条件优化,分别考察了培养时间、钙离子浓度、pH、温度对钙富集量的影响,结果显示在稳定期进行富集,最适钙离子浓度为1.2 mg/mL,Z7 的最适pH 为6,Z7+YP4-5、CY1-1、CY1-1+DL12 组的最适pH 为7.2,Z7+YP4-5 组的最适温度为37 ℃,其余各组的最适温度为40 ℃。利用原子力显微镜观察乳酸菌富集钙前后菌体细胞,结果表明乳酸菌富集钙前后细胞形态差异较大,是钙离子在乳酸菌中的富集导致的。后续可将筛选出的钙富集能力强的乳酸菌用于鱼骨等天然富钙原料的发酵,提取其中的钙离子,用于制备新型补钙制剂。
