左卡尼汀联合血液透析治疗尿毒症患者的安全性分析
2021-06-20徐亮徐延国
徐亮,徐延国
(1.沈阳小净血液透析有限公司血液透析室,辽宁 沈阳 110000;2.沈阳经济技术开发区人民医院肾内科,辽宁 沈阳 110000)
尿毒症包含了晚期肾功能衰竭的体征和症状。以纳差、水肿、意识障碍、呕吐等为主要临床表现,且尿毒症阶段,不仅会使水电解质代谢出现紊乱及酸碱失衡,患者还会出现心、肺、肌肉、血液、神经等中毒症状,对患者身体健康造成严重影响[1]。对于尿毒症的治疗多采用血液透析治疗,通过此治疗方案将血液中的代谢废物排除,从而维持机体正常的水电解质水平及酸碱水平[2]。血液透析是通过人工帮助达到对血液净化的目的,但是在此过程中,血液中的水分、电解质及营养成分也被排出,从而尿毒症患者容易出现营养不良[3]。因此寻找能更好地治疗尿毒症的方法至关重要。近几年临床在治疗该疾病的相关研究[4-5]中采用左卡尼汀联合血液透析治疗尿毒症,可以帮助患者改善临床症状,临床疗效显著,不良反应较少,安全性高。但临床对于这种治疗方法所产生的其他方面的结果没有大量严格的试验进行验证。本文在以往研究的基础上,将2018年6月—2020年6月于该院治疗的200例尿毒症患者均分为观察组和对照组,其中100例患者在对照组血液透析的基础上联合左卡尼汀治疗,旨在探究左卡尼汀对于治疗尿毒症患者免疫功能、贫血时间方面、血浆蛋白等的效果,现报道如下。
1 资料与方法
1.1 一般资料
将2018年6月—2020年6月于该院治疗的200例尿毒症患者均分为观察组和对照组,各100例。观察组中性别比例为男∶女=66∶34;年龄26~78岁,平均年龄为(52.09±1.39)岁;尿毒症时长7~21周,平均时长(14.21±1.11)周;血液透析时间为34~52个月,平均血液透析时间为(42.87±3.08)个月;疾病类型:慢性肾小球肾炎32例、慢性间质性肾炎14例、糖尿病肾病10例、多囊肾22例、良性小动脉肾硬化17例、狼疮肾炎5例。对照组中性别比例为男∶女=63∶37;年龄25~79岁,平均年龄为(52.01±1.28)岁;尿毒症时长7~21周,平均时长(14.21±1.11)周;血液透析时间为32~54个月,平均血液透析时间为(42.98±3.10)个月;疾病类型:慢性肾小球肾炎34例、慢性间质性肾炎15例、糖尿病肾病9例、多囊肾20例、良性小动脉肾硬化16例、狼疮肾炎6例。
纳入标准:①符合诊断尿毒症的标准[6];②血液透析时间≥3个月;③治疗前1个月内没有应用过铁剂者;④患者及家属知情同意,并签署知情同意书;⑤该研究经医学伦理委员会批准。
排除标准:①对药物过敏的患者;②不配合该次研究或者中途退出的患者;③存在精神障碍患者;④试验前存在大出血或者感染的患者;⑤恶性肿瘤患者。
1.2 方法
对照组患者采用血液透析治疗。采用血液透析机(品牌:费森尤斯4008S型;产地:国外·德国;产品注册号:国械注进20183451981)对患者进行血液透析,透析速度310 mL/min,透析液流速度为500 mL/min,每隔4 h为患者透析1次,每周需进行3次,连续治疗6个月。
观察组在对照组的基础上联合左卡尼汀治疗。将1支左卡尼汀注射液(山东齐都药业有限公司;国药准字H20113540;规格:1 g/支)混合于20 mL的生理盐水中,然后进行静脉注射,每周需进行3次,连续治疗6个月。
1.3 观察指标及评价标准
观察并分析两组患者的临床疗效、不良反应、NIHSS和ADL评分、免疫功能(CD4+、CD8+、CD4+/CD8+)、血红蛋白、红细胞比容、血清总蛋白、血清蛋白指标水平,贫血方面的指标(贫血症状改善时间、白蛋白高于30 g/L的时间、红细胞比容增加10%以上的时间),血浆蛋白(转铁蛋白、总蛋白和白蛋白水平)等方面的指标水平。
①临床疗效分为显效、有效和无效。显效为患者病情稳定,按时血液透析按量服用药物;有效为患者病情偶有症状,按时血液透析按量服用药物;无效为患者病情没有改善甚至加重[7-8]。
②不良反应包括头晕、恶心、嗜睡、口干。
③NIHSS[9-10]和ADL评分[11]:NIHSS评分分数越低,患者状态越好。ADL评分分数越高患者状态越好。
④免疫功能[12]:包括CD4+、CD8+、CD4+/CD8+。采集患者治疗前和治疗6个月后2 mL空腹肘静脉血,采用碱性磷酸酶染色法测定。
1.4 统计方法
采用 SPSS 24.0统计学软件分析处理数据,符合正态分布的计量资料以(±s)表示,组间差异比较采用t检验;计数资料以[n(%)]表示,组间差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
临床疗效方面比较,观察组相较于对照组差异更大(χ2=18.882,P<0.05),见表1。
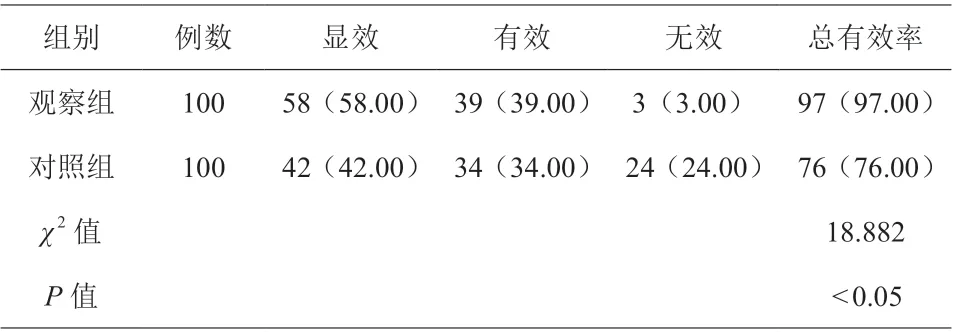
表1 两组患者临床疗效比较[n(%)]
2.2 不良反应
不良反应方面比较,观察组与对照组相近,差异无统计学意义(χ2=0.421,P=0.516),见表2。
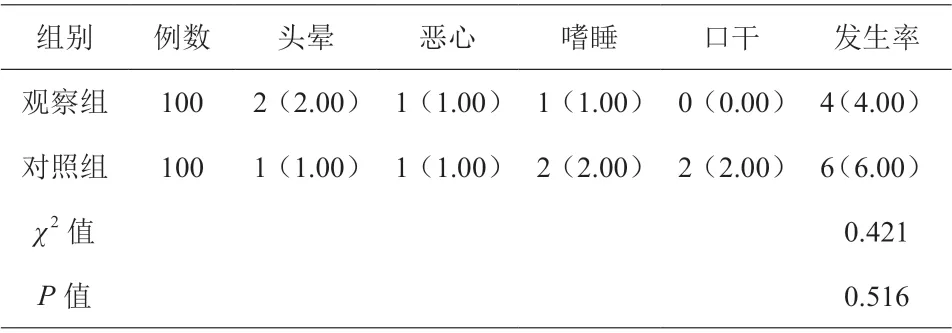
表2 两组患者不良反应比较[n(%)]
2.3 NIHSS和ADL评分
NIHSS和ADL评分方面比较,观察组相较于对照组差异更大(t=14.776、5.858,P<0.05),见表3。
表3 两组患者NIHSS和ADL评分比较[(±s),分]
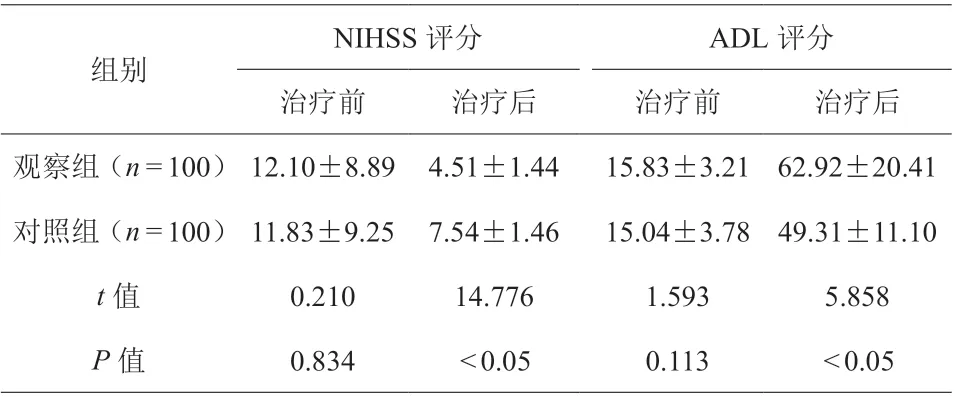
表3 两组患者NIHSS和ADL评分比较[(±s),分]
组别NIHSS评分 ADL评分治疗前 治疗后 治疗前 治疗后观察组(n=100)12.10±8.89 4.51±1.44 15.83±3.21 62.92±20.41对照组(n=100)11.83±9.25 7.54±1.46 15.04±3.78 49.31±11.10 t值 0.210 14.776 1.593 5.858 P值 0.834 <0.05 0.113 <0.05
2.4 免疫功能
免疫功能方面比较,治疗后观察组CD4+、CD4+/CD8+相较于对照组差异更大(t=25.927、3.074,P<0.05),见表4。
2.5 血红蛋白、红细胞比容、血清总蛋白、血清蛋白指标水平
血红蛋白、红细胞比容、血清总蛋白、血清蛋白指标水平方面比较,观察组各方面相较于对照组更高,差异有统计学意义(t=11.876、13.690、4.457、10.401,P<0.05),见表5。
2.6 贫血症状改善时间、白蛋白高于30 g/L的时间、红细胞比容增加10%以上的时间
贫血指标方面比较,观察组贫血症状改善时间、白蛋白高于30 g/L的时间、红细胞比容增加10%以上的时间相较于对照组更短,差异有统计学意义(t=19.507、8.554、23.904,P<0.05),见表6。
2.7 转铁蛋白、总蛋白和白蛋白水平
转铁蛋白、总蛋白和白蛋白水平方面比较,治疗后观察组各方面相较于对照组更优,差异有统计学意义(P<0.05),见表7。
表4 两组患者免疫功能比较(±s)
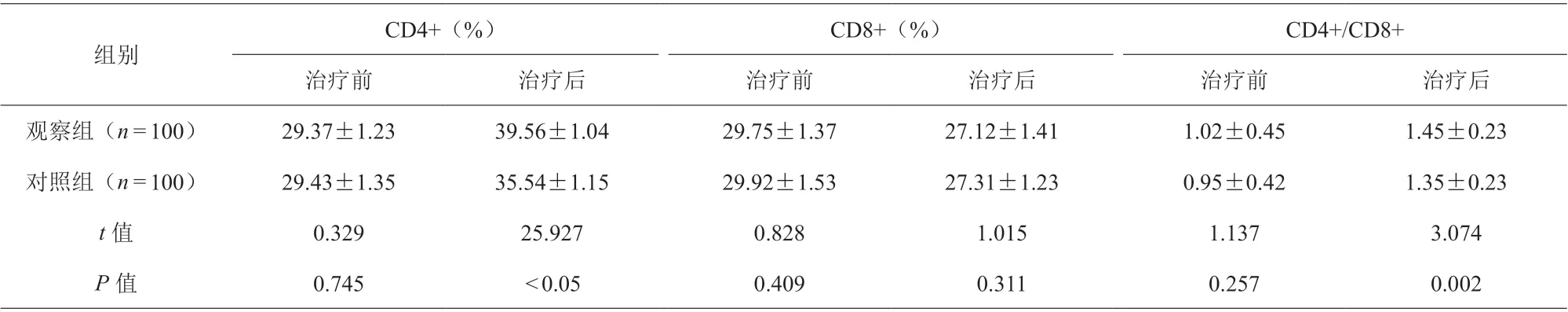
表4 两组患者免疫功能比较(±s)
CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=100) 29.37±1.23 39.56±1.04 29.75±1.37 27.12±1.41 1.02±0.45 1.45±0.23对照组(n=100) 29.43±1.35 35.54±1.15 29.92±1.53 27.31±1.23 0.95±0.42 1.35±0.23 t值 0.329 25.927 0.828 1.015 1.137 3.074 P值 0.745 <0.05 0.409 0.311 0.257 0.002组别
表5 两组患者血红蛋白、红细胞比容、血清总蛋白、血清蛋白指标水平比较(±s)

表5 两组患者血红蛋白、红细胞比容、血清总蛋白、血清蛋白指标水平比较(±s)
血红蛋白(g/L) 红细胞比容(%) 血清总蛋白(g/L) 血清蛋白(g/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=100) 63.45±10.63 99.16±12.84 19.25±3.84 33.67±6.84 62.44±7.95 70.45±8.80 37.25±3.20 42.65±4.94对照组(n=100) 64.54±10.36 78.57±11.65 19.64±2.73 22.66±4.23 62.65±8.57 65.14±8.03 37.22±2.61 36.43±3.37 t值 0.734 11.876 0.828 13.690 0.180 4.457 0.073 10.401 P值 0.464 <0.05 0.409 <0.05 0.858 <0.05 0.942 <0.05组别
表6 两组患者贫血指标方面比较[(±s),d]

表6 两组患者贫血指标方面比较[(±s),d]
组别 贫血症状改善时间 白蛋白高于30 g/L的时间 红细胞比容增加10%以上的时间观察组(n=100) 11.13±1.43 12.14±1.54 11.43±0.21对照组(n=100) 16.38±2.28 14.34±2.06 15.24±1.58 t值 19.507 8.554 23.904 P值 <0.05 <0.05 <0.05
表7 两组患者血浆蛋白水平比较(±s)

表7 两组患者血浆蛋白水平比较(±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,*P<0.05
组别 时间 转铁蛋白(mg/L) 总蛋白(g/L) 白蛋白(g/L)观察组(n=100)治疗前 1 166.15±76.98 65.14±6.94 34.26±3.21治疗后 (2 278.59±123.26)* (78.59±13.24)* (45.21±5.34)*对照组(n=100)治疗前 1 166.21±76.26 65.17±6.56 34.24±3.20治疗后 (1 678.25±83.30)* 67.75±6.54 (37.12±3.10)*
3 讨论
早期尿毒症的症状(如疲劳)是非特异性的,因此难以确定病情。目前,可以减缓肾衰竭的进展,但只能通过替代肾脏功能来治疗尿毒症。尿毒症的治疗主要由血液透析进行治疗,这在很大程度上是因为供体肾脏供不应求。但血液透析治疗的总体治疗效果不佳,接受透析治疗的患者生活质量通常很低[13]。因此寻找能更好的治疗尿毒症,减缓患者的痛苦,改善其生活质量至关重要。池炳芳[14]学者在其研究中得出左卡尼汀治疗尿毒症疗效显著,具有较好的应用价值。
左卡尼汀是人体中的一种天然物质,可以改善人体的心肌功能、提高机体免疫功能。在人体中注射左卡尼汀,不良反应较小,可以随人体尿液排出[15]。左卡尼汀可以降低贫血症状改善时间、白蛋白高于30 g/L的时间、红细胞比容增加10%以上的时间,可以改善贫血状况[16]。
以往研究中重点描述了左卡尼汀联合血液透析治疗尿毒症的临床治疗总有效率、不良反应方面,研究内容具有一定的局限性。本研究在以往的研究基础上,采用血液透析联合左卡尼汀治疗尿毒症,扩大了研究范围,重点研究了提高免疫机能、改善生活质量、贫血情况改善、血浆蛋白等,更加全面。
本研究中采用血液透析联合左卡尼汀治疗,观察组相较于对照组临床疗效方面更高(P<0.05)。王佳波[17]学者在其研究中观察组的治疗有效率为95.56%,对照组的治疗有效率为77.78%,观察组相较于对照组治疗有效率更高(P<0.05),与本研究的结果相近。由此可知,血液透析治疗联合左卡尼汀治疗尿毒症相比于单用血液透析治疗尿毒症的疗效显著。本研究中治疗后观察组CD4+、CD4+/CD8+相较于对照组更高(P<0.05)。南昭玭等[18]学者在其研究中观察组CD4+、CD4+/CD8+相较于对照组更高(P<0.05)。可见左卡尼汀有增强患者机体免疫功能的作用,可以改善患者的生活质量。但是该研究在血液透析联合左卡尼汀治疗尿毒症患者的不良反应研究的方面较少,在今后的研究中会扩大研究范围,深入研究血液透析联合左卡尼汀治疗尿毒症患者的不良反应或其安全性,以期为临床护理提供更全面的理论基础。
综上所述,对尿毒症患者采用血液透析治疗联合左卡尼汀治疗可以改善患者的生活质量,疗效显著,安全性高,具有应用意义。
