5种金属离子对紫色红曲霉主要次生代谢物谱的调节作用
2021-06-18黄胜男高梦祥刘应保
黄胜男,高梦祥,刘应保
(长江大学生命科学学院,湖北荆州 434025)
红曲霉(Monascus)可以产生多种次生代谢物,其中研究最多的是红曲色素(Monascuspigment,MP)、莫纳克林K(Monacolin K,MK)、γ-氨基丁酸(γ-aminobutyric acid,GABA)和麦角固醇等有益代谢物[1]。红曲霉的有益代谢物主要用于食品着色和医疗保健等领域,比如红曲色素具有着色和抗氧化、抗炎症、抗癌等功能,莫纳克林K、γ-氨基丁酸具有降血脂、降血压、降血糖和抗癌等功效[2]。此外,红曲霉还产生一种真菌毒素桔霉素(Citrinin,CTN),因其具有肾毒性而严重影响了红曲霉上述代谢物的开发应用。不过学术界从菌种培育和改造、优化发酵环境等方面,辅以理化和分子生物学手段可将其在发酵过程中控制在安全范围内[3-6]。其中,培养基的化学组成,尤其是金属离子不仅能显著影响次生代谢物的合成,而且还能激活沉默的或隐蔽的次生代谢物的合成[7-9]。
除了作为营养成分,金属离子还对微生物的次生代谢合成具有重要的调节作用。关于金属离子对红曲霉次生代谢物的调节作用,已有不少报道。在红曲霉(Monascussp.ZK、ZH、S、M.anka、M.purpureusNIIS)的研究中发现,Zn2+可以显著提升红曲色素的合成[10-13]。相反,Zn2+则抑制M.purpureusATCC 16365红曲色素的合成[14]。适量的Mn2+、Mg2+均能促进M.sp S和M.anka黄色素的合成[11-12],而Fe2+则抑制M.sp S红曲色素的合成[12]。然而,在M.rubber和M.purpureusATCC 16365中,Fe2+则可以促进红曲色素的合成[14-16]。在M.FJ3中Na+、Fe2+、Cu2+和Mn2+可以协同促进黄色素的产量,而对桔霉素没有影响[17]。相反,Cu2+则抑制M.anka、M.rubber红曲色素的合成[15-16,18]。对于MK而言,适量的Zn2+可以促进红曲霉MK的合成[19-21]。Mg2+能促进红曲霉桔霉素的合成[4],而Na+则抑制桔霉素的合成[22]。而金属离子对红曲霉其他次生代谢产物的研究则鲜有报道。
从上述的研究结果中可以发现,一些研究结论截然相反。可能原因在于,金属离子对红曲色素的调控作用存在菌种特异性和菌株特异性,同时存在剂量效应,不当的剂量则对次生代谢物合成不具有正调节作用,甚至是负效应[9]。此外,在不同的培养条件(培养基成分、培养容器和培养环境等)下,金属离子对次生代谢物的调节作用不同[9,23]。而且,多数研究仅关注于金属离子对红曲霉的某个代谢物的效应,而很少对多个代谢物同时进行观察。基于此,本研究以紫色红曲霉为研究对象,采用实验室常用的马铃薯葡萄糖培养基,通过5种金属离子处理,结合金属离子螯合实验,揭示不同离子对紫色红曲霉主要次生代谢物谱的调控作用。
1 材料与方法
1.1 材料与仪器
紫色红曲霉(Monascus purpureus) 本实验菌种;乙醇、甲酸、甲苯、乙酸乙酯、苯、8-羟基喹啉和金属离子等试剂 均为分析纯,购自国药集团化学试剂有限公司;马铃薯葡萄糖肉汤培养基(Potato Dextrose Broth,PDB):200 g去皮土豆,20 g葡萄糖,加去离子水煮沸20~30 min,经纱布过滤后滤液补加去离子水至1000 mL,121 ℃灭菌20 min;马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA):在PDB基础上加15 g琼脂粉;查氏酵母膏琼脂(Czapek yeast exatract agar,CYA):1.0 g K2HPO4,0.5 g MgSO4·7H2O,0.5 g KCl,3.0 g NaNO3,0.01 g FeSO4·7H2O,30 g蔗糖,5.0 g酵母粉,15 g琼脂,加去离子水搅拌,煮沸后加去离子水至1000 mL,分装至锥形瓶中,121 ℃灭菌20 min。
MJ-54A高压自动灭菌锅 上海博迅实业有限公司医疗设备厂;SPX-II系列生化培养箱 赛多利斯科学仪器(北京)有限公司;HH-4数显恒温水浴锅 金坛市杰瑞尔电器有限公司;UV-2600紫外分光光度计 岛津企业管理(中国)有限公司;Agilent 1260高效液相色谱仪 北京京科瑞达科技有限公司;SW-CJ-2FD双人单面洁净工作台 浙江苏净净化设备有限公司;FSH-II型高速电动匀浆机 江苏金坛市环宇科学仪器厂;KQ-600DE型数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 红曲霉孢子培养 将保存的菌种接到CYA培养基斜面上,30 ℃培养5~7 d,用适量去离子无菌水洗斜面,将液体过滤到含玻璃珠的锥形瓶中,充分振荡打散孢子液后,采用血球计数板法计算孢子数。
1.2.2 金属离子处理方法 固体培养:取PDA培养基,高温融化后,分别添加不同浓度的ZnSO4、MnCl2、MgSO4、CuSO4、CoCl2等金属离子,制作固体平板,待其凝固后,点接紫色红曲霉孢子。倒置放于30 ℃恒温培养箱培养,培养8 d后,拍照。
液体培养:取PDB培养基,分别添加不同浓度的ZnSO4、MnCl2、MgSO4、CuSO4、CoCl2等金属离子,不加金属离子的为对照,然后分别接种紫色红曲霉孢子(1×104个/mL),放于30 ℃,200 r/min的恒温摇床培养。
1.2.3 金属离子螯合实验 固体培养:方法同1.2.2,制备含不同浓度的8-羟基喹啉(0、10、20 μmol/L)的固体平板,培养后观察、拍照。
液体培养:方法同1.2.2,不同浓度的8-羟基喹啉(0、10、20 μmol/L),然后分别接种紫色红曲霉孢子恒温摇床培养。
1.2.4 次生代谢产物的测定 红曲色素的测定:测定方法参照文献[22],将发酵液连同菌体一起匀浆,取适量的匀浆液于60 ℃萃取1 h后,离心取上清即为水溶总色素;取300 μL匀浆液,加入700 μL无水乙醇,于60 ℃萃取1 h后,离心取上清即为醇溶总色素。然后用紫外分光光度计在410、46、500 nm下测得OD值,色素含量(U/g)=OD×稀释倍数(U)/生物量(g)。
莫纳克林K的测定:测定方法参照文献[22],将发酵液连同菌丝体用高速匀浆机捣碎后取500 μL匀浆液,加入等体积的乙酸乙酯剧烈震荡后高速冷冻离心,取上清放真空干燥箱中干燥,加入0.5 mL苯除杂,放置60 ℃烘箱烘干,加入1 mL 95%乙醇溶解,用紫外分光光度计在238 nm处测吸光值。根据标准品制作的标准曲线方程y=0.051x+0.003,计算其含量(mg/L)。
桔霉素的测定:测定方法参照文献[22],取发酵液上清,加入等体积萃取剂(甲苯:乙酸乙酯:甲酸=7:3:1,V:V:V),剧烈震荡后,离心取最上层,用0.45 μm有机溶剂滤膜过滤后采用HLPC测其浓度。使用的柱子为C18(5 μm,250 mmol/L×4.6 mmol/L)。检测条件:流动相为乙腈(色谱纯加入0.05%的三氟乙酸):超纯水(加入0.05%三氟乙酸)=3:1,使用二极管阵列检测器(Agilent),流速为1 mL/min,柱温为30 ℃,在330 nm波长下检测桔霉素含量。根据标准品制作的标准曲线方程y=66.456x+45.782,计算其含量(mg/L)。
γ-GABA的测定:测定方法参考文献[24],将发酵好的菌体烘干,充分研磨成粉末,准确称取一定量的粉末溶解于适量的蒸馏水,摇匀后超声提取1 h(20 kHz、90 W、30 ℃),2400×g,离心15 min,取上清1 mL,用紫外分光光度计在640 nm处测定其吸光值,并代入回归方程算出浓度,计算菌体γ-GABA的产量(mg/g)。产量(mg/g)=浓度×稀释倍数/菌体质量。
生物量的测定:测定方法参照文献[22],将发酵液收集到离心管中离心(9600×g,10 min),收集沉淀,用去离子水洗涤沉淀3遍后,将其置于60 ℃烘箱烘至恒重(g)。
1.3 数据处理
实验数据采用软件Graphpad prism 8.01进行作图及统计分析,以mean±SD表示计量资料,组间分析采用multiple t tests-one per row方法。所有实验均重复操作三次。
2 结果与分析
2.1 Cu2+对紫色红曲霉生长和次生代谢的影响
固态培养条件下,随着CuSO4浓度(1、2、5 mmol/L)的增加,紫色红曲霉的生长逐渐受到抑制(图1),5 mmol/L时对菌体生长抑制最明显,气生菌丝明显减少。而不同浓度的CuSO4均能明显改变紫色红曲霉的色素合成(图1),与对照相比,CuSO4处理的菌体颜色明显加深,表明色素含量高。即CuSO4能显著刺激紫色红曲霉色素合成,且高浓度情况下明显抑制菌体生长。
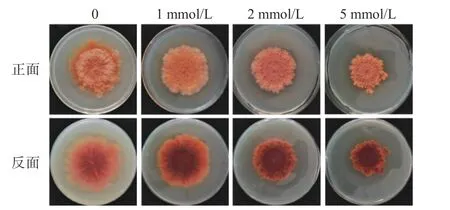
图1 不同浓度的CuSO4对紫色红曲霉固态培养时生长和色素合成的影响Fig.1 Influence of CuSO4 on growth and pigments of M.purpureus in solid-state fermentation(SSF)
在液体培养条件下,CuSO4(0.5、1、2、5 mmol/L)对紫色红曲霉生长和次生代谢的影响与固态培养的结果差异悬殊(图2)。在低浓度下,CuSO4对紫色红曲霉的生长无影响(图2a),而在高浓度(2、5 mmol/L)时,则完全抑制菌体生长。低浓度的CuSO4(0.5 mmol/L)能显著刺激红曲色素的合成(图2b、图2c),其中水溶红(OD500)、橙(OD465)、黄(OD410)色素产量分别提高了2.01、2.07和1.73倍,差异极显著(P<0.01);醇溶红、橙、黄色素产量分别提高了2.83、1.74和1.95倍,差异显著(P<0.05)。相对于对照,CuSO4(0.5、1 mmol/L)处理,导致莫纳克林K产量分别提升了1.78和1.58倍(图2d),差异显著(P<0.05)。对于真菌毒素桔霉素而言,CuSO4(0.5、1 mmol/L)对其合成的促进效果最为显著,相较于对照,处理组的桔霉素含量分别提高了5.53和2.61倍(图2e)。然而,与上述代谢物相反的是,γ-氨基丁酸(GABA)的合成则被CuSO4(0.5、1 mmol/L)严重抑制,其产量分别下降了81.5%和62.7%(图2f)。上述结果表明,Cu2+对红曲色素、莫纳克林K和桔霉素的合成具有明显刺激作用,而对GABA合成则存在强烈抑制效应。
2.2 Zn2+对紫色红曲霉生长和次生代谢的作用
与CuSO4的效应类似,随着ZnSO4浓度(0.5、1、5 mmol/L)的增加,紫色红曲霉的生长逐渐受到抑制(图3),5 mmol/L时对菌体生长抑制最明显。对于次生代谢物红曲色素的合成,ZnSO4具有明显的促进效应。
ZnSO4(0.25、0.5 mmol/L)对液态培养条件下紫色红曲霉生长和次生代谢合成的作用也类似于CuSO4,低浓度下对菌体生长无显著影响(图4a)。对于次生代谢物而言,高浓度ZnSO4(0.5 mmol/L)对红曲色素、莫纳克林K和桔霉素的合成具有强烈的刺激作用。其中,水溶红、橙、黄色素的产量较对照菌分别提高了93.3%、78.6%、57.6%,差异显著(P<0.05)(图4b);醇溶红、橙、黄色素产量分别提高了3.9、2.54和1.54倍(图4c)。相对于对照,ZnSO4(0.5 mmol/L)处理导致莫纳克林K和桔霉素的产量分别提升了92.2%和6.91倍(图4d、图4e),差异显著(P<0.05)。同样,ZnSO4也显著(P<0.05)抑制GABA的合成,高浓度条件下抑制效应更明显(图4f)。综上所述,高浓度Zn2+显著(P<0.05)促进红曲色素、莫纳克林K和桔霉素的合成,严重抑制GABA的合成。
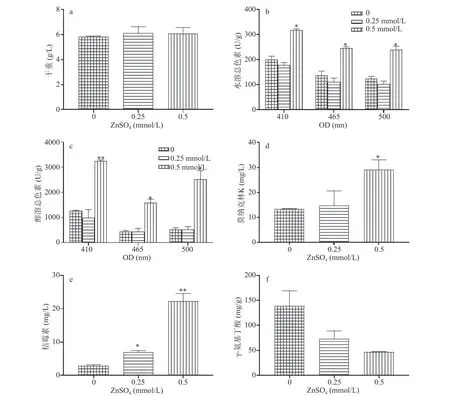
图2 CuSO4(mmol/L)对紫色红曲霉液态培养时生长和次生代谢物合成的影响Fig.2 Influence of CuSO4 on growth and secondary metabolite of M.purpureus in submerged fermentation (SMF)
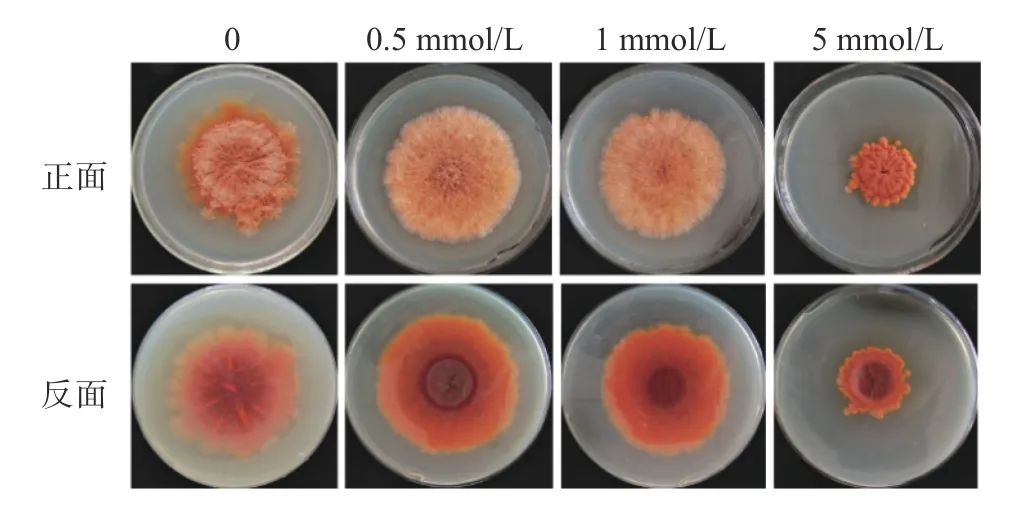
图3 ZnSO4对固态培养时紫色红曲霉生长和色素合成的作用Fig.3 Influence of ZnSO4 on growth and pigments of M.purpureusin SSF
2.3 Mg2+调控紫色红曲霉生长和次生代谢物合成
MgSO4处理的结果表明,0.25 mmol/L浓度可以促进红曲霉的气生菌丝生长,而高浓度(0.5 mmol/L)条件对菌丝生长具有一定抑制作用(图5,正面)。同时,MgSO4处理能加深菌体颜色(图5,反面),相对于对照菌,处理的菌体呈深红色,表明MgSO4促进了红曲色素的合成。
MgSO4(0.25、0.5 mmol/L)对液态培养条件下紫色红曲霉生长无显著影响(图6a)。对于次生代谢物而言,MgSO4(0.5 mmol/L)对红曲色素、莫纳克林K合成具有强烈的刺激作用。其中,水溶红、橙、黄色素的产量较对照菌分别提高了2.68、2.25和2.02倍,差异显著(图6b)(P<0.05);醇溶红、橙、黄色素产量分别提高了1.26、1.23和1.82倍(图6c)。低浓度MgSO4(0.25 mmol/L)可显著促进水溶色素的合成,分别提高了1.04、1.05和1.01倍。相对于对照,MgSO4(0.5 mmol/L)处理导致莫纳克林K产量提升了51.8%(图6d),差异显著(P<0.05)。低浓度MgSO4能显著提升桔霉素的产量,相对于对照,其产量增加了1.79倍(图6e)。同样,MgSO4也明显抑制GABA的合成,高浓度条件下抑制效应更明显(图6f)。综上所述,适宜浓度的Mg2+能显著(P<0.05)促进红曲色素、莫纳克林K和桔霉素的合成,而高浓度Mg2+则严重抑制GABA的合成。
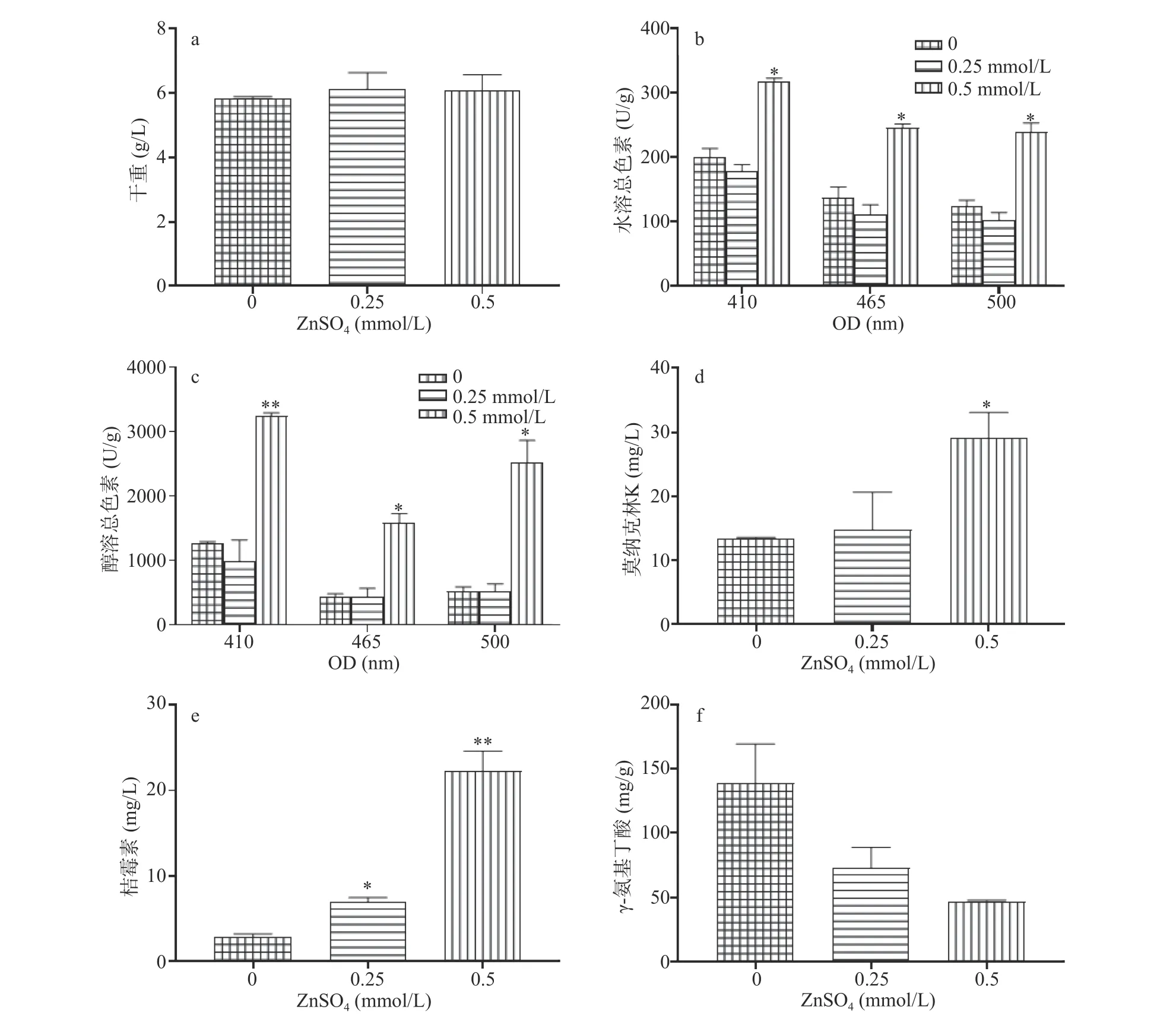
图4 ZnSO4(mmol/L)对态培养时紫色红曲霉液生长和次生代谢物合成的作用Fig.4 Influence of ZnSO4 on growth and secondary metabolite of M.purpureus in SMF
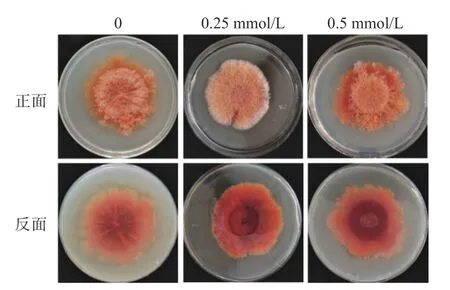
图5 MgSO4对固态培养条件下紫色红曲霉生长和色素合成的作用Fig.5 Influence of MgSO4on growth and pigments of M.purpureus in SSF
2.4 Mn2+对紫色红曲霉生长和次生代谢物合成的调控作用
从图7可以看出,相对于对照菌,MnCl2可以促进红曲霉的气生菌丝生长,高浓度MnCl2(5 mmol/L)对菌丝生长无抑制作用(图5,正面)。同时,MnCl2处理导致红曲色素产量增加(图5,反面)。
图8的数据表明,MnCl2(0.5、1 mmol/L)对紫色红曲霉生长无明显抑制作用(图8a)。对于水溶红曲色素有一定的刺激作用(图8b),但不显著(P>0.05),而MnCl2(0.5 mmol/L)可以显著刺激醇溶色素的合成,相对于对照组,醇溶红、橙、黄色素产量分别提高了131.1%、83.6%和49.2%(图8c)。而MnCl2(0.5、1 mmol/L)处理则显著促进莫纳克林K和桔霉素的合成。其中,0.5 mmol/L的MnCl2导致莫纳克林产量较对照组提高了2.01倍(图8d);MnCl2(0.5、1 mmol/L)使桔霉素的产量则分别增加了39.6%和92.3%(图8e)。高浓度MnCl2处理则导致GABA的产量降低,相对于对照降低了61.1%,而仅在高浓度MnCl2处理时,差异显著(P<0.05)。即MnCl2处理的数据表明,低浓度Mn2+(0.5 mmol/L)显著促进醇溶红曲色素的合成,高浓度Mn2+(1 mmol/L)导致GABA产量显著(P<0.05)降低;而Mn2+(0.5、1 mmol/L)则显著(P<0.05)刺激莫纳克林K和桔霉素的合成。
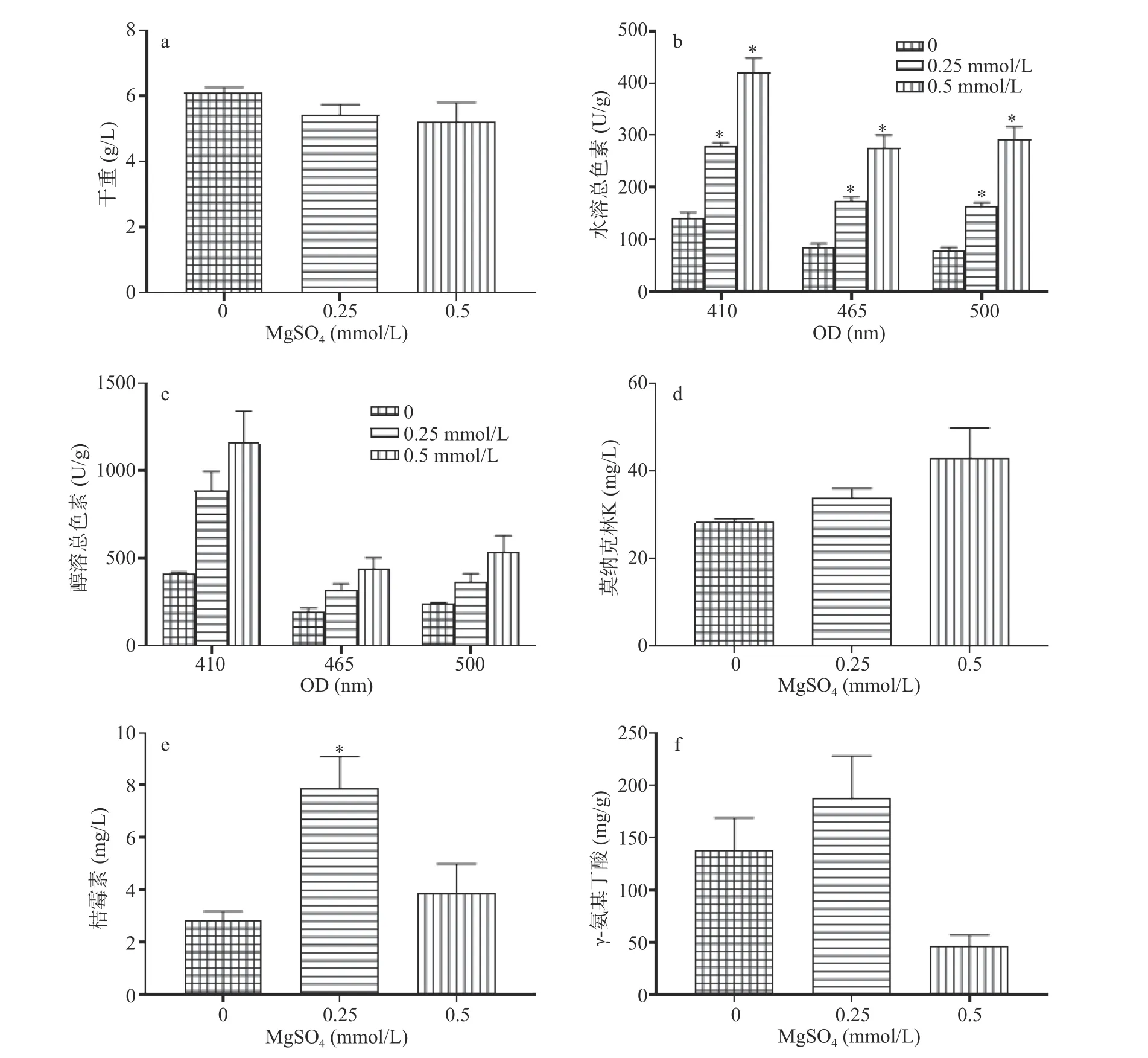
图6 MgSO4(mmol/L)对态培养时紫色红曲霉液生长和次生代谢物合成的作用Fig.6 Influence of MgSO4 on growth and secondary metabolite of M.purpureus in SMF
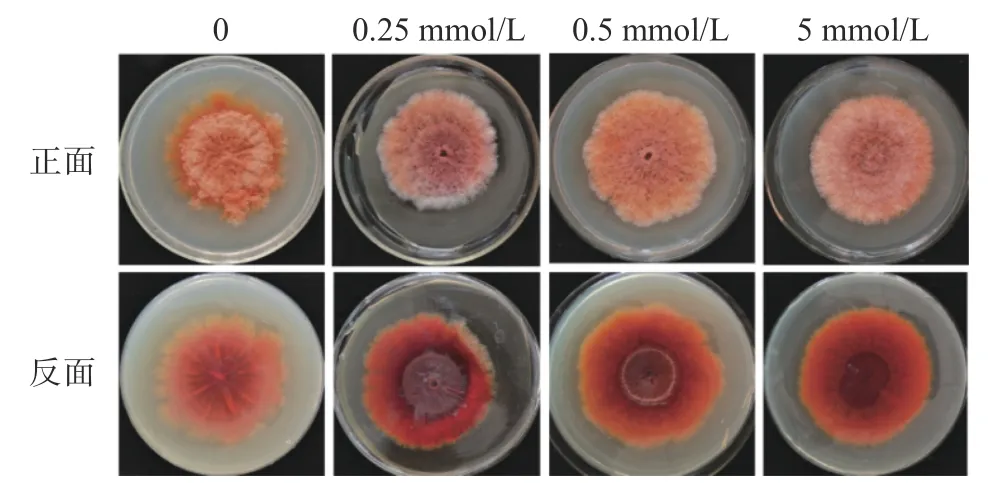
图7 MnCl2对固态培养条件下紫色红曲霉生长和色素合成的作用Fig.7 Influence of MnCl2 on growth and pigments of M.purpureusin SSF
2.5 Co2+对紫色红曲霉生长和次生代谢物合成的影响
与上述金属离子的效应不同的是,CoCl2(0.5、1、5 mmol/L)严重抑制固态培养时的紫色红曲霉的生长,该抑制效应具有明显的剂量效应,5 mmol/L时红曲霉无法生长(图9,正面)。同时,CoCl2也抑制红曲色素的产量(图5,反面)。
同固态培养的结果相似,CoCl2(0.5、1 mmol/L)显著(P<0.05)抑制液态培养时紫色红曲霉生长(图10a),生物量分别降低了47.9%和53.7%。次生代谢产物的测定结果发现,CoCl2(0.5、1 mmol/L)可以显著刺激醇溶色素的合成,相对于对照,醇溶红、橙、黄色素产量分别提高了4.04、5.04、2.63倍和3.08、3.41、2.7倍(图10c),差异显著(P<0.05)。而高浓度CoCl2(1 mmol/L)显著抑制水溶色素和莫纳克林K的合成,相对于对照组,水溶红、橙、黄色素产量分别降低了69.7%、65.7%和64.4%(图8b);而莫纳克林K产量降低不显著。CoCl2(0.5、1 mmol/L)则几乎完全抑制桔霉素合成,从峰面积可以看出,桔霉素合成严重受阻(图10e)。同样,CoCl2(0.5、1 mmol/L)也严重抑制GABA的合成,相对于对照,其产量分别降低了92.7%和74.5%。这些表明,Co2+对紫色红曲霉生长和次生代谢物合成具有强烈的负调控效应。
2.6 金属离子螯合剂对紫色红曲霉生长和次生代谢物的作用
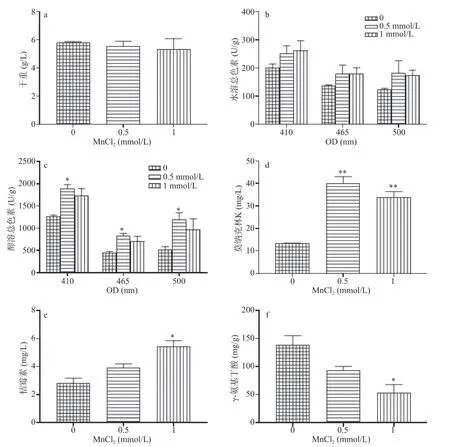
图8 MnCl2对态培养时紫色红曲霉液生长和次生代谢物合成的作用Fig.8 Influence of MnCl2on growth and secondary metabolite of M.purpureus in SMF
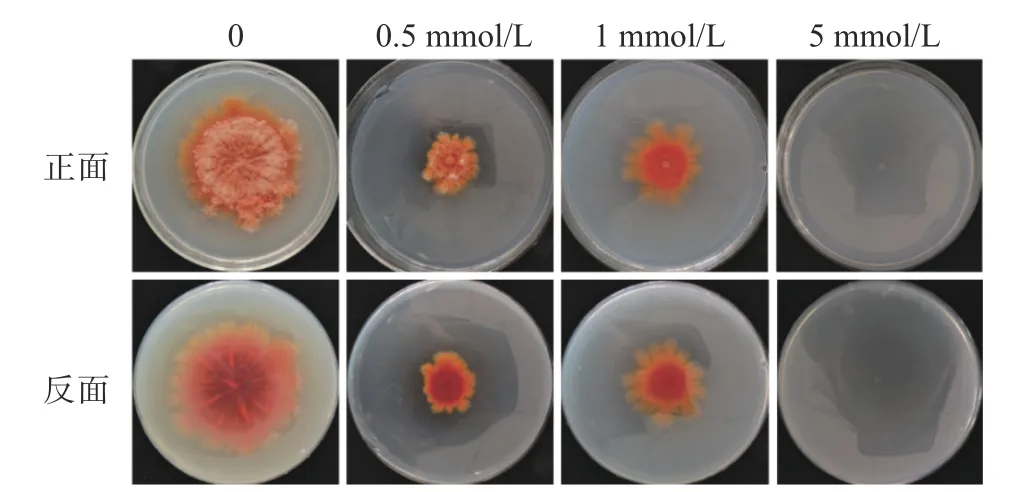
图9 CoCl2显著抑制固态培养条件下紫色红曲霉生长和色素合成Fig.9 Inhibitory effect of MnCl2 on growth and pigments of M.purpureusin SSF
固态培养的结果发现,金属离子螯合剂8-羟基喹啉在高浓度下(60 μmol/L)可以完全抑制紫色红曲霉的生长(图片未显示),而在低浓度(10、20 μmol/L)下,对菌体生长无明显影响,且对色素合成有一定的抑制作用(图11)。
液态培养的结果表明,HQ对紫色红曲霉生长具有抑制效应,相对于对照,20 μmol/L条件下迫使紫色红曲霉生物量下降了26.9%,差异显著(P<0.05)。其次,HQ(10、20 μmol/L)对于次生代谢物的合成具有不同的效应。高浓度HQ(20 μmol/L)显著(P<0.05)抑制水溶色素合成,与对照相比,其水溶红、橙、黄色素分别降低了40.6%、34.3%和26%(图12b)。而醇溶色素合成则被HQ刺激(图12c),HQ(10、20 μmol/L)处理导致醇溶红、橙、黄色素分别提高了1.72、1.19、0.8倍,和1.91、1.59、0.76倍。对于莫纳克林K而言,低浓度HQ具有促进效应,高浓度无影响。低浓度HQ使得莫纳克林K的产量升高了1倍(图12d)。HQ对桔霉素和GABA的合成具有显著的抑制作用,其中高浓度HQ的抑制作用最强(图12e、图12f)。实验结果表明,高浓度HQ对紫色红曲霉生长和次生代谢物合成具有抑制作用。
2.7 金属离子及螯合剂对紫色红曲霉次生代谢物谱的影响
紫外分光光度计波谱扫描(200~600 nm)的结果显示(图13),相对于对照,金属离子显著改变了紫色红曲霉的主要次生代谢物谱,未见其他新代谢物。表明金属离子处理调节紫色红曲霉主要次生代谢物产量的变化,未改变代谢物种类。
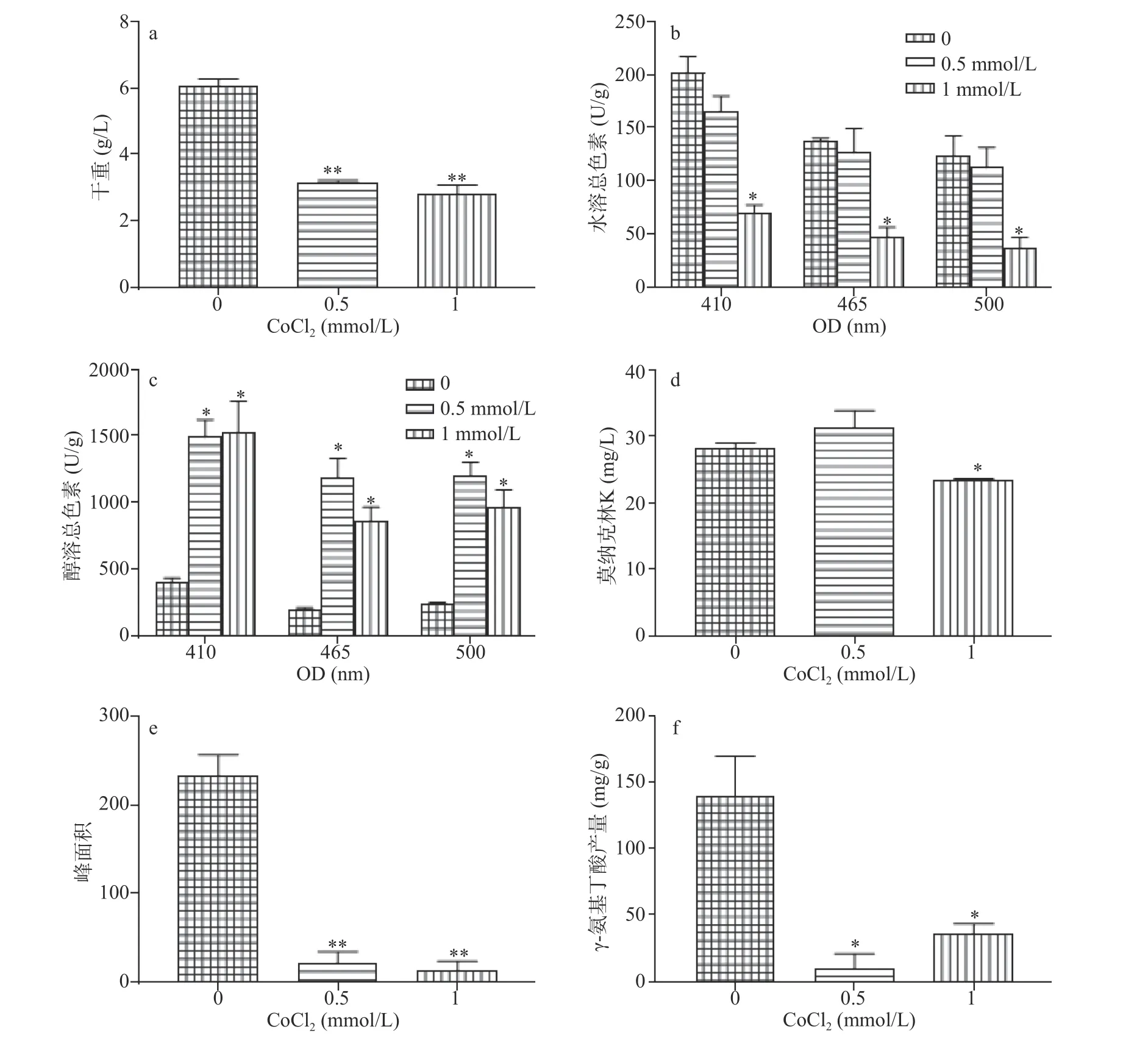
图10 CoCl2抑制液态培养时紫色红曲霉液生长和次生代谢物合成Fig.10 Inhibitory effect of CoCl2 on growth and secondary metabolite of M.purpureus in SMF
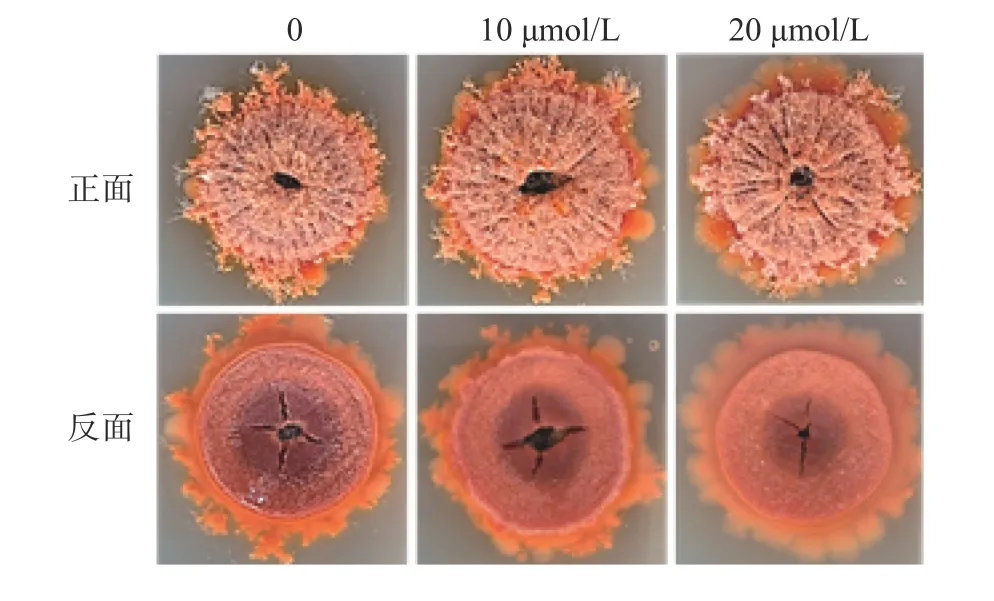
图11 8-羟基喹啉对固态培养条件下紫色红曲霉生长和色素合成的影响Fig.11 Influence of 8-Hydroxyquinoline(HQ) on growth and pigments of M.purpureusin SSF
3 讨论
金属离子作为必要的营养元素,参与微生物的生长和代谢,而金属离子调节微生物次生代谢合成的机制主要包括以下几个方面[9]:作为辅因子或激活剂调控次生代谢物关键酶的活性或合成基因的表达。Cu2+、Zn2+、Mg2+、Mn2+是次生代谢合成关键酶(氧化酶、加氧酶、抗氧化酶等)的辅因子,在细胞水平和分子水平对真菌生长及真菌毒素的合成具有调节效应。Cu2+对于青霉素的合成、白色念珠菌(Canidia albicans)等真菌的形态发育至关重要,同时还能促进内生真菌(Paraphaeosphaeriaquadriseptata)莫纳克林I的合成。Cu2+和Mn2+、Zn2+等离子能刺激串珠镰刀菌(Fusarium moniliforme)萘醌的合成。Mn2+抑制畸形素和白霉素的合成,促进棒曲霉素的合成。真菌毒素的合成高度依赖于可用的Zn2+浓度。镰刀菌酸、黄曲霉毒素、赭曲霉素和桔霉素等真菌毒素的合成受Zn2+井然有序的调控。Zn2+还通过调控关键酶LovD、LoV活性刺激洛伐他汀(莫纳克林K)的合成;刺激活性氧(reactive oxygen species,ROS)产生,诱发氧化胁迫,进而刺激具有抗氧化功能的次生代谢物(色素、类胡萝卜素、真菌毒素及其他聚酮化合物等)合成,维持氧化还原平衡。Co2+和其他金属离子一样,可以导致大量ROS产生,反而会刺激抗氧化功能的次生代谢物比如色素、真菌毒素的合成,以发挥自由基清除能力,这种策略在产色素霉菌中屡见不鲜;作为信号分子,启动或激活次生代谢物合成。Cu2+还可以作为信号分子激活尖孢镰刀菌(Fusarium oxysporumZZF51)的镰刀菌酸的合成。真菌次生代谢物合成的启动和调控依赖于精确的Zn2+浓度,比如杂色曲霉素A、交链孢酚、棒曲霉素等聚酮化合物的合成启动需要精准的微摩尔级Zn2+调控;参与初级代谢进而影响次生代谢合成。
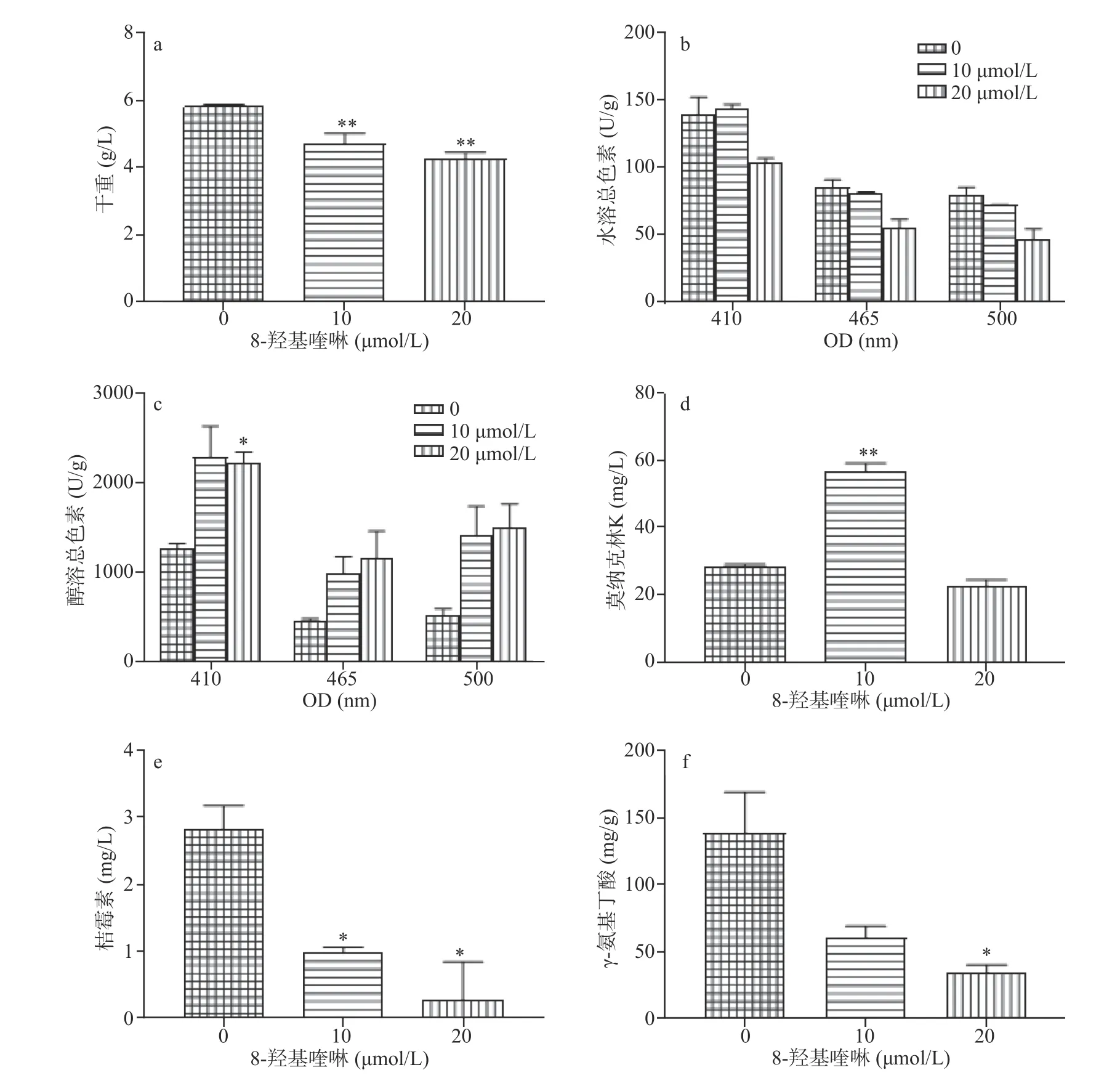
图12 8-羟基喹啉(μmol/L)对固态培养条件下紫色红曲霉生长和次生代谢物合成的影响Fig.12 Influence of 8-hydroxyquinoline(HQ) on growth and secondary metabolite of M.purpureus in SSF
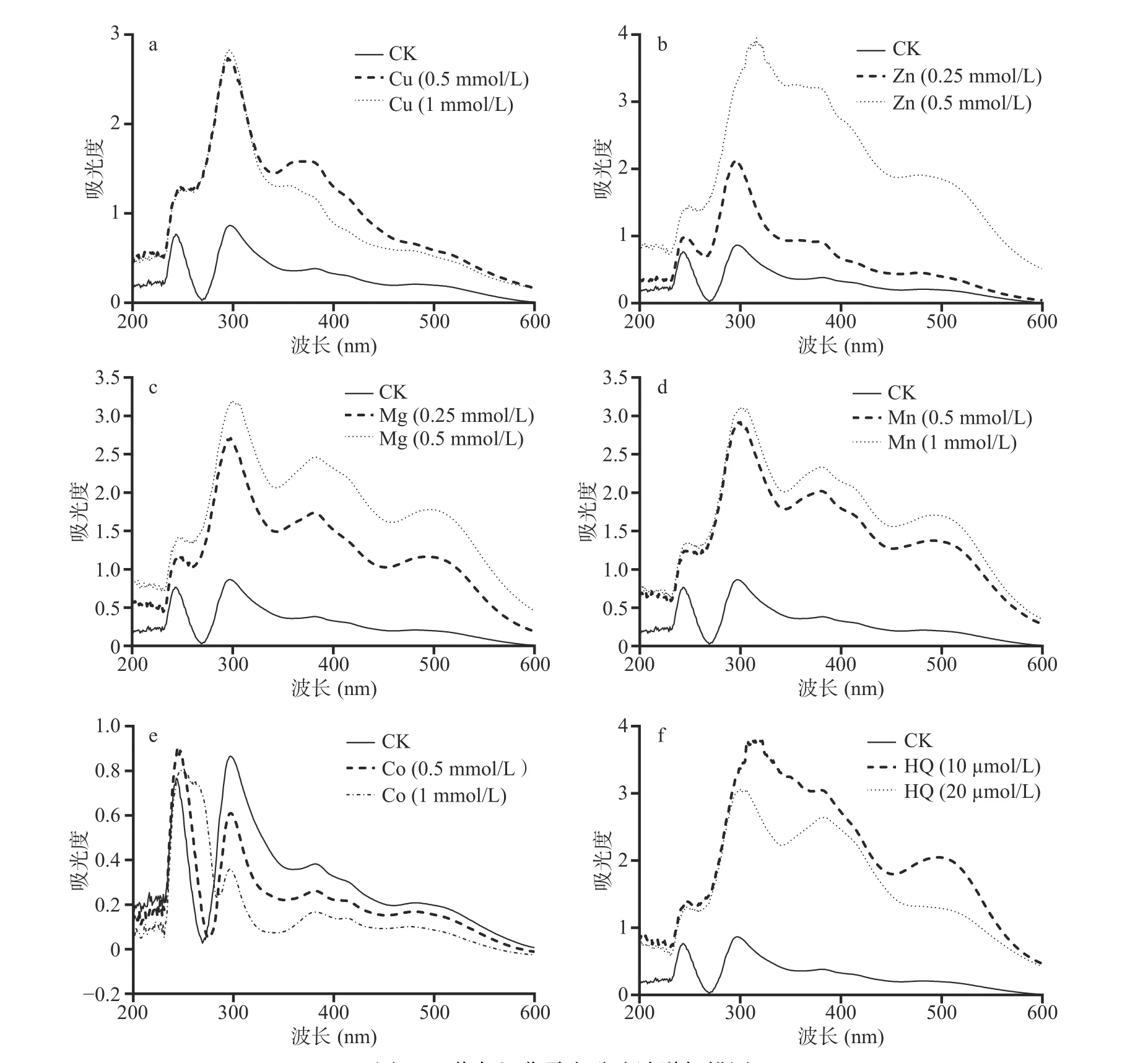
图13 紫色红曲霉发酵液波谱扫描图Fig.13 Spectral scanning of fermented broth of M.purpureus
紫色红曲霉产生的红曲色素、莫纳克林K和桔霉素都是聚酮化合物,三者具有相同的合成前体单元,比如乙酰辅酶A、丙二酰辅酶A等。乙酰辅酶A在羧化酶作用下产生丙二酰辅酶A,而Mg2+正是乙酰辅酶A羧化酶的辅因子,参与调控各种次生代谢物的合成[9,25]。Mg2+可能通过影响此酶活性进而对紫色红曲霉的上述代谢物的合成进行调控。上述中间体在各自代谢物生物合成酶催化下依次合成,其中,上述2种前体和中链脂肪酸在聚酮合酶等酶催化下最终合成各种红曲色素[5]。而Mn2+对脂肪酸的合成具有重要的调控作用[9],这可能是Mn2+促进红曲色素合成的一个原因。上述3种聚酮化合物利用相同的合成前体,利用各自的合成基因簇编码各种酶,有序地催化每一个合成步骤。在每个基因簇内都有一个转录激活因子,比如PigR、MoH和CtnR分别负责调控各自簇内基因的表达,最终控制红曲色素、莫纳克林K和桔霉素的产量。而PigR、MoH和CtnR3个转录激活因子在结构上都存在Zn2Cys6锌指簇DNA结合结构域[26-28]。Zn2+则是这些锌指蛋白发挥转录调控的关键,因此,Zn2+刺激3种聚酮化合物的合成,可能与此有关。此外,金属离子超载,都会导致胞内ROS水平激增,进而诱发氧化胁迫[9],而过多的ROS会刺激包括红曲色素、莫纳克林K及毒素桔霉素在内的具有抗氧化功能的代谢物合成,进而清除ROS,维持胞内氧化还原平衡。本研究所用离子均具有氧化还原平衡功能,其中Mg2+、Zn2+、Mn2+和Mn2+还是超氧化物歧化酶(Superoxide Dismutase,SOD)等抗氧化酶的辅因子。因此,金属离子可能通过影响抗氧化酶活性介入氧化还原平衡,并以此对红曲色素、莫纳克林K和桔霉素的合成进行调控。Co2+通过间接作用负责能量物质的合成,通常对色素合成发挥负调控效应,当然还与其浓度过高有关[9]。对于GABA而言,高浓度的金属离子都具有抑制效应,或许过量的金属离子破坏了其合成酶谷氨酸脱羧酶的活性[29],进而导致其产量下降。关于上述金属离子对紫色红曲霉的主要次生代谢合成的调控机制,有待下一步实验验证。
4 结论
本研究通过金属离子(Cu2+、Zn2+、Mg2+、Mn2+、Co2+)胁迫,结合金属离子螯合实验,考察了不同金属离子对红曲霉生长和主要次生代谢物谱的调控作用。发现高浓度的金属离子对紫色红曲霉生长具有不同程度的抑制作用,而且液体培养的抑制效果远超过固体培养,其中Co2+的抑制效应最显著。金属离子(Cu2+、Zn2+、Mg2+、Mn2+)在适宜浓度下均能刺激MP、MK和CTN的合成,而Co2+则普遍抑制上述次生代谢物的合成。其次,高浓度的金属离子均对GABA的合成具有抑制效应。金属离子螯合实验发现,HQ处理导致水溶MP、MK、CTN、GABA产量发生不同程度的降低,并对菌体生长具有明显的抑制效应,佐证了金属离子对上述代谢物的调控作用。发酵液的波谱扫描表明,金属离子对代谢物种类并无显著影响。研究结果将为进一步揭示金属离子调控红曲霉次生代谢合成的内在机制奠定基础。
