α-淀粉抑制酶纳米脂质体运动食品的制备及稳定性评价
2021-06-18符宇兰
符宇兰
(上海电子信息职业技术学院,上海 201199)
随着生活条件的提高,人们的饮食也越来越丰富,肥胖问题愈发严重,其中过多碳水化合物的摄入,是导致肥胖的主要“元凶”。市场上的减肥产品种类繁多,但质量良莠不齐[1-2],且很多对身体的伤害很大。α-淀粉抑制酶是一种淀粉酶的抑制剂,能与α-淀粉酶分子上的相应部位结合并引起分子构象改变,使其失去活性,阻碍食物中碳水化合物的水解和消化,让其直接排出体外,减少其消化吸收从而达到减肥的功效[3-4]。但α-淀粉抑制酶稳定性较差,经过食品加工或人类消化极易丧失活性。研究开发高载量、高稳定性的α-淀粉抑制酶包埋技术是解决上述问题的关键。
纳米脂质载体是一种新型功能性食品载体,在食品工业中用于包埋具有功能性食品成分的物质,一般是由固态脂和液态脂混合熔融,然后冷却生成大量的非完美晶格而得到[5-6]。与其他包埋技术相比,纳米脂质载体技术具有高载量、高物理稳定性以及很好的生物相容性,特别是对于α-淀粉抑制酶等稳定性较差的功能性成分,是一种极具发展前景的新型脂质包埋技术[7-10]。本研究通过纳米脂质体的方式对α-淀粉抑制酶进行物理改性和包埋,使其具有促进抗消化、易吸收的特性,可以提高α-淀粉抑制酶在肠道中的存在状态,帮助食用者降低对淀粉的利用[11],从而达到降低体重且不会影响身体的各项指标的目的,具有运动功能食品的功效。所以这种纳米脂质运动功能食品的研发具有一定意义,其既符合现代消费者的消费需求,也符合当今运动功能性食品的发展方向,有利于运动健康产业的发展。
本研究以α-淀粉抑制酶为主要原料,以包封率为指标[12],通过卵磷脂和胆固醇以一定质量浓度合成纳米脂质体[13-14],生产出一款具有运动功能性的α-淀粉抑制酶纳米脂质体食品。并对α-淀粉抑制酶添加量、卵磷脂添加量、胆固醇添加量、搅拌温度等4个因素进行单因素实验,在此基础上进行正交试验[15-18],选择较合适的工艺条件。试验还研究了贮藏条件对α-淀粉抑制酶的纳米脂质体稳定性的影响,为这款运动功能性食品的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
α-淀粉抑制酶(纯度98%,白芸豆提取,食用级)
上海蓝基生物科技有限公司;胆固醇(纯度95%)、卵磷脂(纯度98%) 上海太伟药业有限公司;95%无水乙醇、石油醚(分析纯) 国药集团化学试剂有限公司。
Nano-Zs90粒径分析仪 德国新帕泰克有限公司;LD5-10B大容量离心机 湖南湘仪有限公司;DS-1高速组织捣碎机 上海标本模型厂;MC-128电热恒温水浴锅 宁波实验仪器厂;Bilon-09均质机 无锡市科尔仪器设备有限公司;R611超高温瞬时灭菌仪 苏州得科机械设备有限公司;SFSA微滤设备 杭州珀瑞分离技术有限公司。
1.2 实验方法
1.2.1α-淀粉抑制酶纳米脂质体的制备 称取一定量的α-淀粉抑制酶溶解于50 mL、pH6.5、0.05 mol/mL的Na2HPO4-KH2PO4缓冲液(PBS)中。另称取一定质量浓度的卵磷脂和胆固醇溶解于无水乙醇中。用注射器将上述脂质乙醇溶液快速注入溶有α-淀粉抑制酶的PBS缓冲液中,在一定温度下搅拌30 min,得到α-淀粉抑制酶纳米脂质体悬浮液。将悬浮液移入250 mL圆底烧瓶内,温度50 ℃,时间30 min,将悬浮液中的乙醇挥干,即得到α-淀粉抑制酶纳米脂质体。
1.2.2 单因素实验 本试验分别考察α-淀粉抑制酶添加量、胆固醇添加量、卵磷脂添加量以及搅拌温度等4个因素对该纳米脂质体的包封率影响。
α-淀粉抑制酶添加量对纳米脂质体包封率的影响:固定胆固醇添加量为6 mg/mL、卵磷脂添加量为0.15 mg/mL、搅拌温度为50 ℃,分别考察α-淀粉抑制酶添加量为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL时,纳米脂质体的包封率。
胆固醇添加量对纳米脂质体包封率的影响:固定α-淀粉抑制酶的添加量为2.0 mg/mL、卵磷脂添加量0.15 mg/mL、搅拌温度为50 ℃时,考察胆固醇添加量为0、2.0、4.0、6.0、8.0、10.0、12.0、14.0 mg/mL时,纳米脂质体的包封率。
卵磷脂添加量对脂质体包封率的影响:固定α-淀粉抑制酶的添加量为2.0 mg/mL、胆固醇添加量为8.0 mg/mL、搅拌温度为50℃时,考察卵磷脂添加量为0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40 mg/mL时,纳米脂质体的包封率。
搅拌温度对脂质体包封率的影响:固定α-淀粉抑制酶的添加量为2.0 mg/mL、胆固醇添加量为8.0 mg/mL、卵磷脂添加量为0.20 mg/mL时,考察搅拌温度为20、30、40、50、60、70、80、90 ℃时,纳米脂质体的包封率。
1.2.3 正交试验 基于单因素实验基础上,采用L9(34)四因素三水平正交试验方案设计,优化纳米脂质体的生产工艺配方,试验因素与水平见表1。

表1 L9(34)因素与水平Table 1 Factors and levels of L9(34)
1.2.4 包封率的测定 取1 mLα-淀粉抑制酶纳米脂质体,加入5.0 mL石油醚充分混匀,4000 r/min条件下离心5 min,收集上清液挥干溶剂,测上清液中α-淀粉抑制酶的质量浓度C(mg/mL),包封率的计算公式如下[19-21]:
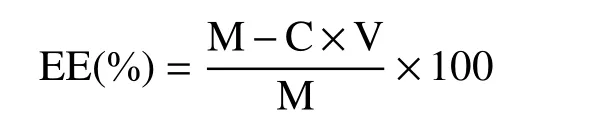
式中:M为α-淀粉抑制酶添加量,mg;V为脂质体悬浮液的总体积,mL。
1.2.5α-淀粉抑制酶纳米脂质体粒径测定 将α-淀粉抑制酶纳米脂质体用去离子水稀释至适当倍数,随后将稀释后的样品装入聚苯乙烯比色皿中,采用粒径分析仪进行测定,散射角为90°,记录α-淀粉抑制酶纳米脂质体的粒径。
1.2.6α-淀粉抑制酶纳米脂质体的贮藏稳定性 温度对纳米脂质体的贮藏稳定性的影响:将α-淀粉抑制酶纳米脂质体注满并密封在棕色瓶中,分别在4、25、37 ℃条件下,避光贮藏40 d,每10 d测定其平均粒径。
pH对纳米脂质体贮藏稳定性的影响:将α-淀粉抑制酶纳米脂质体注满并密封在棕色瓶中,分别调节体系的pH为3.5、4.5、5.5、6.5、7.5,避光贮藏40 d,每10 d测定其平均粒径。
1.3 数据处理
试验中所有数据均采用Excel2003软件处理并绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1α-淀粉抑制酶对产品包封率的影响 结果如图1所示,α-淀粉抑制酶添加量对纳米脂质体的包封率影响呈现先增大后减小的趋势。在α-淀粉抑制酶添加量较低的情况下,由于溶质分子的质量浓度低,增加了脂质体在形成过程中与α-淀粉抑制酶分子的结合难度,从而使得包封率效果较差;在添加量为2.0 mg/mL时,纳米脂质体的包封率的最高,此时纳米脂质体中的α-淀粉抑制酶含量最高;继续增加α-淀粉抑制酶的量,纳米脂质体的包封率迅速下降,所以α-淀粉抑制酶的添加量选择1.5~2.5 mg/mL之间较适宜。
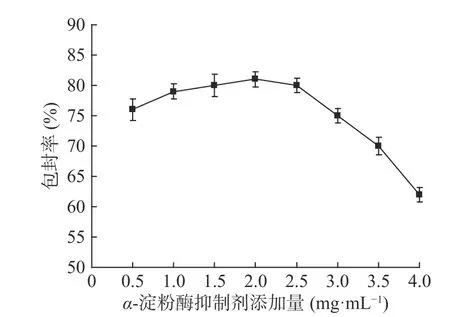
图1 α-淀粉抑制酶对产品包封率的影响(n=3)Fig.1 Effect of α-amylase inhibitor on encapsulation efficiency of products(n=3)
2.1.2 胆固醇添加量对产品包封率的影响 由图2结果可知,当胆固醇添加量较低时,纳米脂质体的包封率较低,这主要是由于过低的固态脂在制备过程中不利于形成可以容纳更多α-淀粉抑制酶的脂质载体;当胆固醇添加量为8.0 mg/mL时,纳米脂质体的包封率最高,此时纳米脂质体中的α-淀粉抑制酶含量最高;再增加胆固醇的量,对纳米脂质体中的α-淀粉抑制酶含量整体改善不大,甚至下降,所以胆固醇添加量选择6.0~10.0 mg/mL之间较适宜。
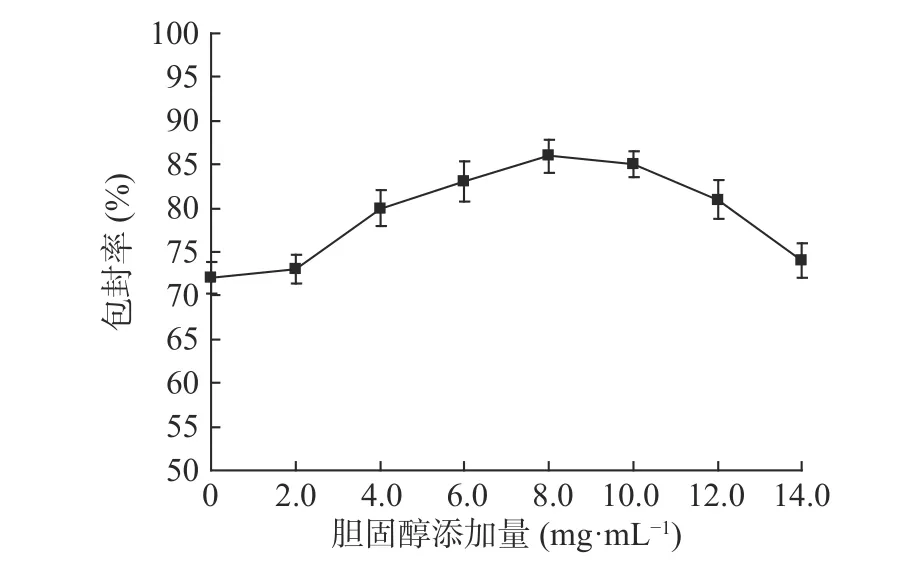
图2 胆固醇添加量对产品包封率的影响(n=3)Fig.2 Effect of cholesterol content on encapsulation efficiency of products(n=3)
2.1.3 卵磷脂添加量对产品包封率的影响 由图3结果可知,当卵磷脂添加量较低时,纳米脂质体的包封率较低,这主要是由于过低的液态脂会增大纳米脂质载体的平均粒径,降低体系的稳定性,从而使得包封率效果较差;当卵磷脂的添加量为0.20 mg/mL时,纳米脂质体的包封率最高,此时纳米脂质体中的α-淀粉抑制酶含量最高;再增加卵磷脂的量,纳米脂质体的包封率会逐渐下降,所以卵磷脂添加量选择0.15~0.25 mg/mL之间较适宜。
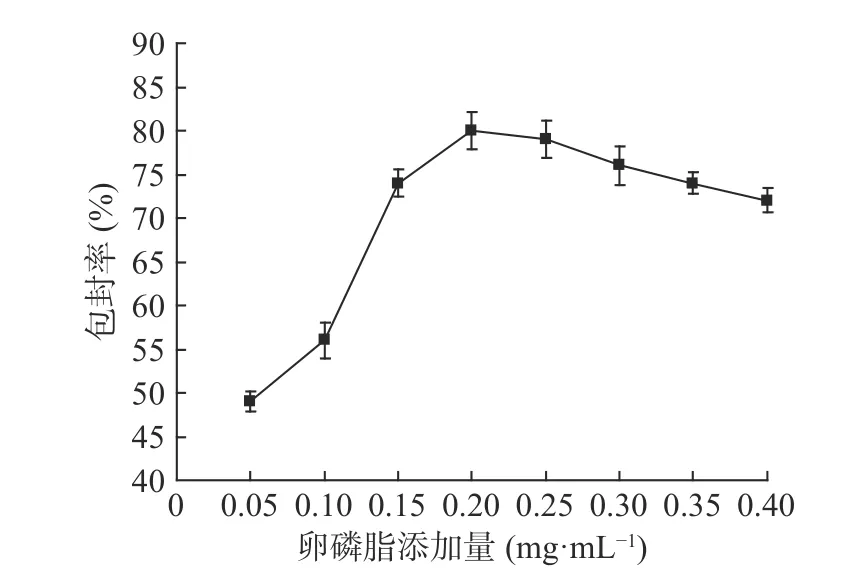
图3 卵磷脂添加量对产品包封率的影响(n=3)Fig.3 Effect of lecithin content on encapsulation efficiency of products(n=3)
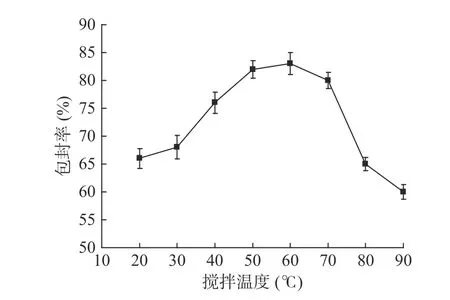
图4 搅拌温度对产品包封率的影响(n=3)Fig.4 Effect of stirring temperature on encapsulation efficiency of products(n=3)
2.1.4 搅拌温度对产品包封率的影响 由图4结果可知,发现反应温度为60 ℃时,纳米脂质体的包封率最高,此时纳米脂质体中的α-淀粉抑制酶含量最高;再增加反应温度,纳米脂质体的包封率会快速下降,因为脂质体的制备必须控制温度高于卵磷脂的相变温度,这样才能使卵磷脂溶液中分散均匀,有利于形成结构良好的脂质体,但温度过高会使卵磷脂发生部分氧化[22],从而影响包封率,综合考虑搅拌温度选择50~70 ℃之间较适宜。
2.2 正交优化实验
从表2可以看出,各因素影响力的主次顺序为α-淀粉抑制酶添加量>搅拌温度>胆固醇添加量>卵磷脂添加量,最优组合为A2B2C3D3,即最佳酿造条件为α-淀粉抑制酶添加量为2.0 mg/mL,胆固醇添加量为8.0 mg/mL,卵磷脂添加量为0.25 mg/mL,搅拌温度为70 ℃。通过进一步的验证试验,在最佳条件下生产出来的产品包封率达到91.6%,比正交试验表中所有实验组别的产品包封率都高,故可确定其最佳工艺条件为A2B2C3D3。
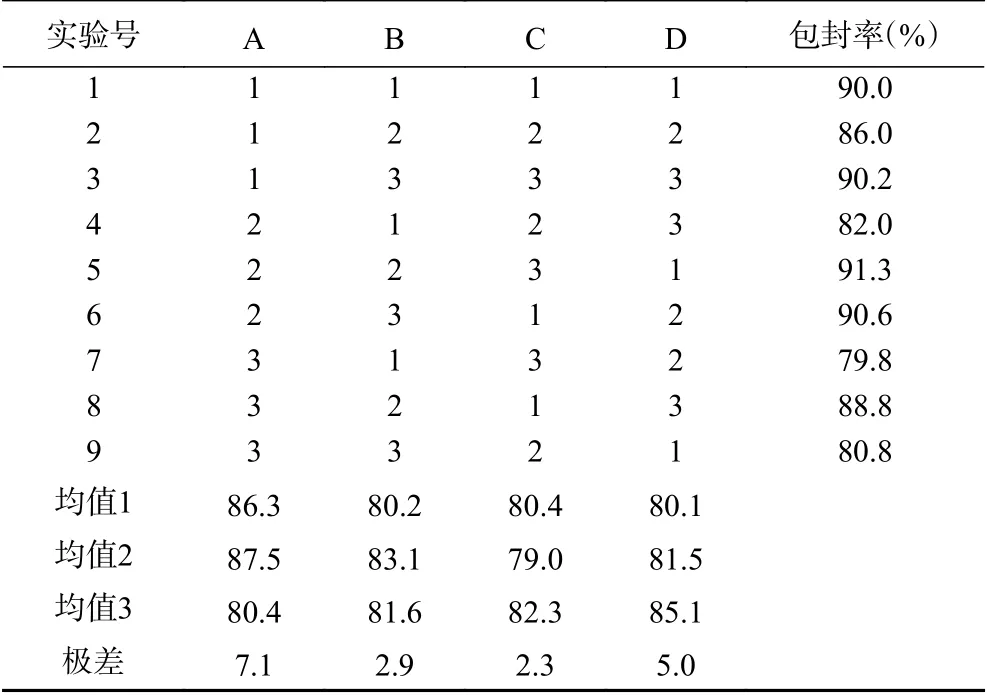
表2 L9(34)正交试验方案及结果分析Table 2 Test scheme and result analysis of L9(34) orthogonal
2.3 α-淀粉抑制酶纳米脂质体粒径分析
采用Nano-Zs90粒径分析仪测得α-淀粉抑制酶纳米脂质体的粒径分布图如图5所示。
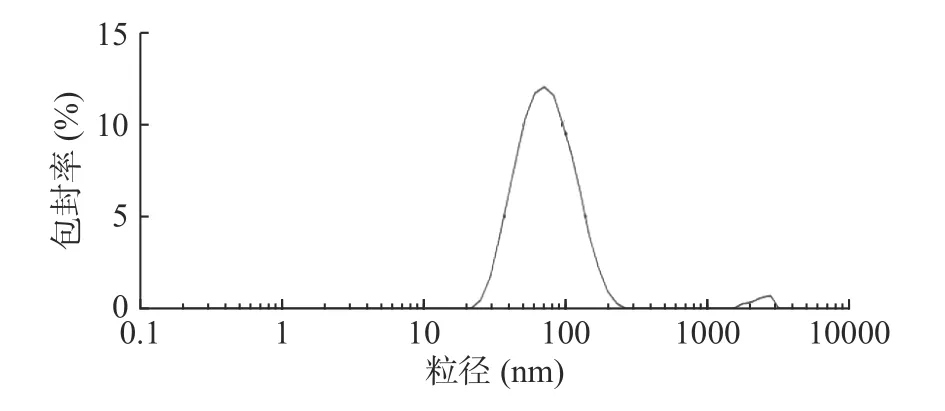
图5 α-淀粉抑制酶纳米脂质体的粒径分布Fig.5 Particle size distribution of α-amylase inhibitor nanoscale carrier
结果如图5所示,α-淀粉抑制酶纳米脂质体粒径的平均粒径为70.2 nm,粒径分布范围较窄、分布区域比较均匀,表明所制备的α-淀粉抑制酶纳米脂质体粒径分布在纳米级范围。
2.4 贮藏稳定性试验
2.4.1 温度对α-淀粉抑制酶纳米脂质体贮藏稳定性的影响 由图6可知,α-淀粉抑制酶纳米脂质体在37℃的条件下贮藏40 d后,载体体系的平均粒径从70.2 nm增加至568.3 nm,体系的稳定性能下降,这可能是由于温度高,载体体系的运动能量较高,加速纳米脂质体之间的碰撞,从而导致纳米脂质体之间团聚的几率增加,使得其粒径增大。α-淀粉抑制酶纳米脂质体在4℃的条件下贮藏40 d后,载体体系的平均粒径也增大了860%,粒度分布范围变宽,可能是由于温度过低,使得α-淀粉抑制酶纳米脂质体的沉淀结晶加剧,体系稳定性被破坏,导致纳米脂质体絮凝[23-24]。在贮藏期内,25 ℃条件下贮藏的α-淀粉抑制酶纳米脂质体的平均粒径小于其他两组,载体体系稳定性最好,且外观基本未发生变化,到第40 d时体系仍澄清透明;但是在4和37 ℃条件下,体系外观变化明显,到40 d时体系较贮藏开始时明显浑浊,因此α-淀粉抑制酶纳米脂质体应尽可能室温条件下贮藏。
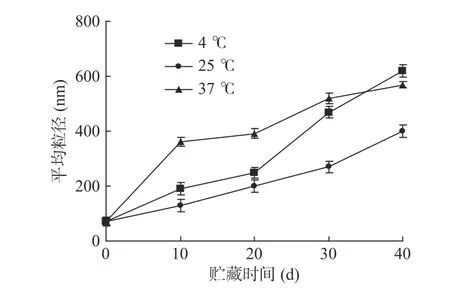
图6 温度对α-淀粉抑制酶纳米脂质体平均粒径的影响(n=3)Fig.6 Effect of temperature on particle size of α-amylase inhibitor nanoscale carrier(n=3)
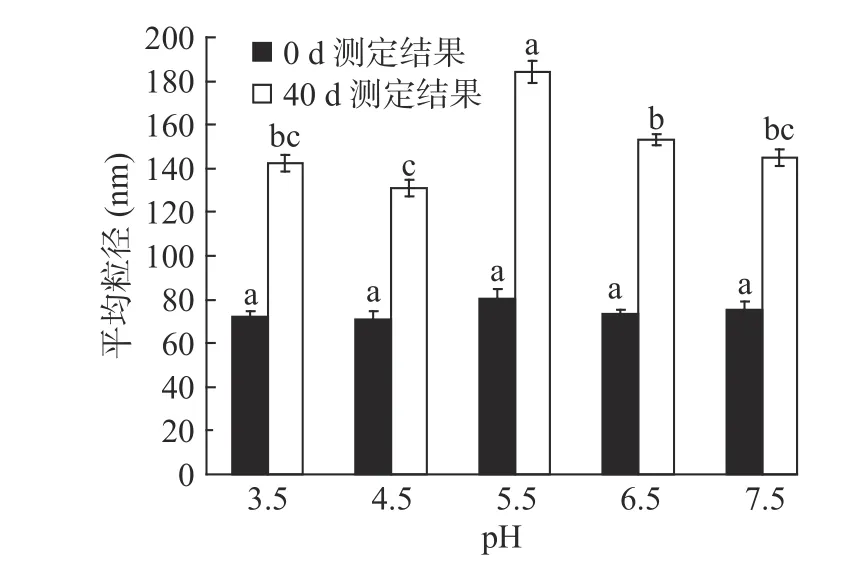
图7 pH对α-淀粉抑制酶纳米脂质体平均粒径的影响(n=3)Fig.7 Effect of pH on particle size of α-amylase inhibitor nanoscale carrier(n=3)
2.4.2 pH对α-淀粉抑制酶纳米脂质体贮藏稳定性的影响 由图7可知,贮藏实验开始时,α-淀粉抑制酶纳米脂质体在不同pH条件下,载体体系的粒径差别不大,分布比较均一,载体体系稳定。当α-淀粉抑制酶纳米脂质体贮藏40 d后,不同pH贮藏条件下载体体系粒径呈现上升的趋势,且不同pH之间的平均粒径差异也显著(P<0.05),特别是pH为5.5时,粒径显著高于其他组,可能是由于在这一条件下,载体体系正电荷的作用使粒子带电量到达等电点附近,因纳米脂质体间的斥力减小而发生了聚集[25]。α-淀粉抑制酶纳米脂质体在贮藏40 d后,载体体系的平均粒径都在200 nm以下,体系外观良好,故α-淀粉抑制酶纳米脂质体可以应用于pH为3.5~7.5的体系当中。
3 结论
本试验研究了生产α-淀粉抑制酶纳米脂质体的工艺条件,优化工艺后生产出的纳米脂质体的包封率能达到91.6%。采用粒径分析仪测得α-淀粉抑制酶纳米脂质体的平均粒径为70.2 nm,粒径分布范围较窄、分布区域比较均匀。在贮藏稳定性试验中发现,α-淀粉抑制酶纳米脂质体在25℃室温条件下以及pH为3.50~7.50的体系中较稳定,有效解决了α-淀粉抑制酶的稳定性差和利用率低的问题,为进一步的商业开发提供可能。
