谷氨酰胺转氨酶及其在食品工业上的应用研究进展
2021-06-18郭丽琼郑倩望林俊芳
杨 聪,郭丽琼, ,万 华,邹 苑,郑倩望,林俊芳,
(1.华南农业大学食品学院,广东广州510640;
2.广东省微生态制剂工程技术研究中心,广东广州510642;
3.华南农业大学数学与信息学院,广东广州510640)
谷氨酰胺转氨酶(全称为蛋白质-谷胺酰胺γ-谷氨酰胺基转移酶)又称转谷氨酰胺酶,广泛存在于动物、植物和微生物中,最早在20世纪50年代从豚鼠肝脏中分离出来, 早期的研究主要集中在动物组织中的TGase, 自从1989年Ando等从轮枝链霉菌中分离到TGase之后, 该酶在工业中的应用才日益广泛。TGase主要催化蛋白质中谷氨酰胺残基的γ-羟胺基团与伯胺化合物(酰基受体)之间发生酰基转移反应,使蛋白质发生共价交联,通过胺的导入、交联及脱胺三种途径改性蛋白质[1]。TGase介导的分子交联能够改善蛋白质的热稳定性、持水力等特性,有助于形成强有力的凝胶,改善蛋白制品的品质[2]。目前该酶已被广泛应用于肉制品、乳制品等传统蛋白制品的质构改良,随着国内外学者对其催化本质的深入研究,该酶在微胶囊、可食性薄膜、乳液凝胶等领域也发挥作用。本文主要阐述TGase的功能特性、作用机理及在食品工业中的应用进展,分析当前应用现状,以期为该酶的工业化应用提供有效参考。
1 TGase的来源
TGase普遍存在于生物中,从来源上划分,主要分为三大类:动物组织中提取的酶(如动物肝脏)、植物组织中提取的酶和由微生物发酵提取的酶。虽然这3种TGase的催化性质及催化机理相似,但它们在氨基酸组成、酶学性质等方面却存在着较大的差异,在结构和功能上的差异,使得它们在食品工业上应用的也不同。
动物来源的TGase广泛分布于各种动物尤其是哺乳动物的组织和器官中,动物TGase含有一个由半胱氨酸残基、组氨酸残基和天冬氨酸残基组成的具有催化作用的三联体,催化作用需要Ca2+激活,通过连接到半胱氨酸的中间体完成,对底物特异性强。分子量为75~80 kDa因肽链上有17个半胱氨酸残基,在50 ℃时酶即有较大损耗,导致其热稳定性差,不适宜较高温度的工业化生产[3]。
植物组织中的TGase普遍存在于植物器官和细胞器中,主要催化多胺与不同蛋白质靶标(如细胞骨架)的缀合,参与叶绿体中光合复合体的稳定、衰老以及植物细胞的衰亡。从动物来源分离的TGase需要在有Ca2+存在的条件下才能发挥作用,植物来源的TGase对Ca2+的依赖性因物种而异,但同样分离纯化工艺复杂,得率低,较难进行商业化生产。所以来源于动植物的TGase的应用发展十分受限,不能大规模应用到食品工业生产中。
微生物来源的谷氨酰胺转氨酶(Microbial Transglutaminase,MTGase)属于胞外酶,可由发酵微生物直接分泌到培养基中,分离纯化较容易,并且微生物发酵原料廉价、产酶周期短,可大规模工业化生产,催化活性不依赖Ca2+,底物特异性低,所以备受青睐。大量的微生物(如放线菌、芽孢杆菌、大肠杆菌和链霉菌等)都可用于MTGase的生物合成。目前微生物发酵产MTGase大多是应用补料分批浸没式和固态发酵生物反应器技术生产的[4]。发酵产MTGase时,用甘油、葡萄糖、果糖和马铃薯淀粉做碳源,酵母膏、蛋白胨、多蛋白胨、尿素和酪蛋白做氮源可以使MTGase产量达到最高值;添加盐离子如钙(例如CaCl2)、磷(例如KH2PO4、K2HPO4)和镁(例如MgSO4.7H2O、MgCl2.7H2O) 会提高MTGase产量[5]。有研究表明,接种量密度为8%~10%、温度为30 °C、通气量为2.0%、培养时间2~5 d是制备微生物MTGase的最佳条件[4]。而采用超滤、离子交换层析和凝胶过滤相结合的策略,可以显著提高MTGase生产的下游分离工序的效率,而且获得的酶具有优良的酶质量特性和较好的酶学特性[6]。
TGase的分离纯化同大多数酶的下游处理相同,先通过乙醇沉淀、超滤、硫酸铵分级盐析等手段进行初提,再用凝胶层析(羧甲基纤维素或葡聚糖凝胶)、离子交换层析、疏水层析等方法进行精提。但微生物的发酵液成分比较复杂,所适用的初提取方法也不同,对于应用于食品工业的MTGase而言,过度纯化会增加成本,延长周期。双水相系统(aqueous two phase system, ATPS)是一种经济快捷且对酶分子的天然结构和生物功能都没有负面影响的有效手段。利用ATPS既可以把目标蛋白萃取到一相中,也可以在该相中实现对目标蛋白的浓缩[7]。虽然MTGase的初提取阶段采用ATPS技术便捷可行,但其系统参数并不是通用的,即对产生MTGase的不同菌株发酵液的纯化需构建适用于该菌株的ATPS。建议根据MTGase的最终用途不同,选择不同的分离纯化方法对发酵液进行处理,建立适度工艺,节约成本,缩短周期。
2 TGase的结构性质与作用机理
TGase的分子量约为38000 Da,单聚链,由331个氨基酸组成,等电点约为8.9,最适pH为6.0~7.0,pH稳定范围在5.0~8.0,最适温度范围45~55 ℃[8]。MTGase三维结构如图1[9]所示,是一个α+β折叠类酶,二级结构是被11个α-螺旋包围的8个β-链组成球状构型,活性中心是带有自由硫巯基的Cys残基,亲水性[10]。大多数金属离子对该酶活性无影响或影响不大,Zn2+对其有较强的抑制作用。

图1 TGase的三维结构 [9]Fig.1 TGase的三维结构 [9]
TGase主要通过胺掺入和交联的方式来修饰蛋白质,TGase催化多肽结合的谷氨酰胺残基“酰基供体”的羧酰胺基团与不同化合物的伯胺“受体”之间的酰基转移反应(如图2a)。在蛋白质系统中,赖氨酸的γ—氨基作为酰基受体反应,形成ε-(γ-谷氨酰基)- Lys异肽的分子内和分子间交联(如图2b)。在没有赖氨酸残基或游离蛋白质反应体系的情况下,水作为酰基的受体反应,谷氨酰胺残基的羧酰胺基团被去酰胺化,形成谷氨酸和氨残基(如图2c),从而改变蛋白质的电荷和蛋白质稳定性[11]。TGase催化的交联可以改善蛋白基食品的物理性质,这种改性不会降低蛋白的营养价值反而会提升食品的质构和口感,任何含有谷氨酰胺和赖氨酸残基的蛋白质,无论是天然的还是人工合成的,都可能构成TGase的底物,这实现了将相对便宜的原材料或副产品转化为有价值商品的可能性。
在三维结构上,谷氨酰胺转氨酶被分为前序列(绿色)和成熟酶(灰色)区域,前序列可以避免胞浆细胞的有害交联,对于细胞内的酶折叠和抑制酶的激活是至关重要的。使用蛋白酶可以去除前序列,从而使成熟酶的活性位点暴露以启动反应[12]。活性位点是位于晶体结构底部裂隙的单个半胱氨酸(C64),与天冬氨酸(D255)和组氨酸(H274)形成催化三联体[7]。如图3所示[12],MTGase的活性位点裂解位置广泛且容纳了α-螺旋前序列,这一属性解释了酰基供体的广泛底物特性,这一特性使得活性位点可具有额外的灵活性,以适应不太特异的底物[13]。Tatsuk等对MTGase空间结构的研究实验表明,MTGase的活性中心C64残基Sγ原子与Phe254残基的O原子之间仅有范德华力,C64残基可充分暴露在溶剂中。从空间结构上看,裂缝右侧的环(Asn239-Asn253)结构灵活,减少了底物与酶之间的空间位阻。活性中心C64残基附近有带负电荷的Glu249、Glu300和Asp304,可以促进带正电荷的酰基受体的靠近[9,14-15]。正是由于MTG在结构上存在这些特点才使得MTG可不依赖Ca2+,底物特异性低,催化速度快等催化特性,使得MTGase能够与酰基供体大家族进行反应,从而可以在不同食品分支领域中的不同应用。
3 TGase的应用
1998年TGase被美国食品和药物管理局批准为“公认安全(GRAS)”的食品酶制剂,被命名为“No.GRN000095”。由于TGase具有非常特殊的结构及强交联能力,目前作为一种新型的食品添加剂,在世界范围的食品工业中广泛应用。TGase可由微生物发酵生产制备,简单易得方便廉价的生物来源为该酶的广泛应用提供了便利条件。
3.1 TGase在肉制品加工上的应用
近年来消费者的健康意识增强,更倾向于富含各种非肉类成分的低盐/低脂肪的肉类产品,食品酶制剂用于肉类加工能显著改善低肉产品的质地,如TGase催化的酰基转移反应产生的共价交联可以增强肉制品的质地、凝胶强度、弹性和保水性,而无不良影响,如高粘度和过度的肉黏性[16]。
肉制品中的肌球蛋白是TGase的良好底物,在肉制品中添加适量的TGase,其催化形成的G-L(Glu-Lys)键相互作用会增强肌源纤维分离蛋白分子间的联结,强化肉制品的蛋白质结构,使形成的凝胶结构更稳定,进而能包容大量水分[16]。
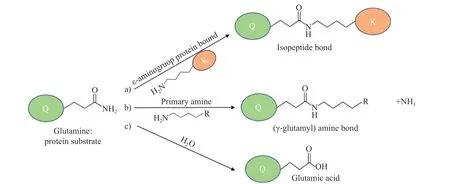
图2 谷氨酰胺转氨酶的作用机理[11]Fig.2 General reaction of TGs[11]
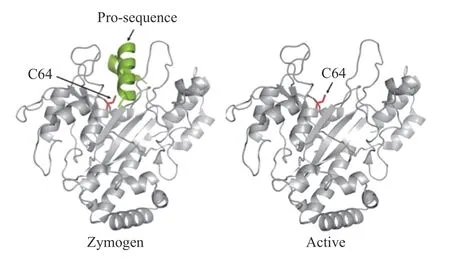
图3 MTGase的3D结构[12]Fig.3 Structureof MTGase with Zymogen[12]
TGase对肉制品品质的优化体现在:(a)可以改善经机械处理的肉制品的质地和结构,通过交联作用增强凝胶性,减轻断裂程度,从而提升产品品质。(b)提高持水力,由于TGase催化形成的凝胶网络有较强的包容水分的能力,可以防止肉制品加工过程中失水皱缩,可提升产品嫩度。Ahhmed等发现在细碎香肠中添加0.2%的TGase可以提高香肠的硬度和弹性,这表明在生面糊粉碎过程中出现了肉类蛋白连接,使烹饪后的蛋白网络结构更细腻[16]。对鸡胸肉饼的实验也表明添加TGase产生的蛋白交联可提高肉凝胶的持水性[17]。(c)可提高原料利用率,添加TGase到重组肉中,发现TGase引入的交联改变了肌球蛋白的结构,使肉制品中β-折叠含量增加,α-螺旋减少,这有助于形成高分子量聚合物,形成强凝胶使产品的刚性、弹性、内聚性、粘附性等得到显著改善,使得重组肉制品加工后结构依然紧密完整不会散开[16]。(d)可降低添加剂使用量,有关研究表明,降低肉制品中盐/磷的含量会改变其感官特性、多汁性、质地和货架期[18]。研究人员在降低盐/磷含量的同时添加TGase的实验中发现,因为添加了TGase所以降低盐和磷的含量并不会影响产品的质构,也不会对产品的感官特性造成不良影响[19]。TGase在肉制品中可起到磷酸盐类添加剂在增加肠馅内聚力、增加保水性等方面的作用,同时TGase可作为良好的乳化剂,用于开发低脂保健型肉制品。
现如今,TGase已被证明可催化蛋白质与肉类产品肽分子之间的交联反应,具有改善肉制品的功能特性和产品品质的能力,且成功应用于肉类系统,更在重组肉制品和增值肉类产品的开发中发挥了重要作用。接下来可继续探索TGase在更多肉类产品中合理使用的可行方法,并且在商业化肉类加工中对TGase的使用进行倾斜,使其可以在工业生产中低成本商业化规模使用。
3.2 TGase在乳制品中的应用
乳品中所含的酪蛋白、乳球蛋白等是TGase的良好底物,这是因为酪蛋白低程度的三级结构、随机的螺旋排列及二硫键缺失,使得TGase易于酪蛋白结合。TGase能在不改变酪蛋白功能特性的情况下改善酪蛋白的情况下改善酪蛋白流变性能,同时催化酪蛋白形成胶束结构。
在乳制品中添加TGase,对乳制品品质的优化主要表现在:(a)增强凝胶强度,提高酸奶质量。Gharibzahedi等用葡萄糖-δ-内酯酸化酪蛋白或预先在50 ℃下用MTGase处理酪蛋白溶液1 h再酸化,发现经MTGase作用后形成了强大的凝胶结构[20],稳定的蛋白质-MTGase复合物基质的形成促进了额外乳清在酸奶网络中的包埋,降低了乳清在酸奶中的扩散率,稳定了酸奶的三维网络[21],从而提升了酸奶品质,使口感更细腻。(b)可改善乳蛋白的乳化特性。Silva利用MTGase处理乳蛋白,发现交联使蛋白的粘弹性增大,蛋白质膜结构也变得更稳定,乳化的稳定性也随之增强,乳化是形成蛋白质膜使水油两相在膜两侧均衡分布的过程,交联使分子间发生聚合,形成的聚合物不发生聚集,从而便提高乳化性[22]。(c)提高乳蛋白热稳定性。TGase催化交联形成的共价键具高耐热性,高网络强度,经TGase作用后的乳蛋白的耐热性也有所增强[20]。(d)保护益生菌,改善酸奶品质。有研究发现在酸奶中添加TGase之后酶与乳蛋白的交联反应稳定了酸奶的三维结构。除了保护发酵液和酸奶中的益生菌细胞外,还可提高发酵中微生物的生长速率,提高益生菌的活力,且一定程度上可以保护益生菌[23]。研究结果证实了用TGase对牛奶进行酶解处理可以充分改善酸奶成品的感官特性。
TGase在酸奶制作过程中与酪蛋白颗粒交联可提供均匀性,减少相分离稳定乳液,催化乳蛋白的交联反应,使不同脂肪含量的酸奶的品质属性显著改善。TGase在乳酪生产中应用时,可以通过回收部分脂肪和蛋白质改善奶酪的质构特性,提高产量,但这也会使得奶酪易熔性和延展性变差。但近期Topcu A 等添加TGase对加工喀什干酪的研究中将乳化盐与TGase复合添加到干酪中,使干酪的水分含量增加了1.68%~2.00%,发现干酪融化曲线与对照奶酪的相似,其延展性和易熔性也不会因MTGase的加入而变差[24]。所以将乳化盐与TGase复合添加到产品中或可以解决TGase交联带来的奶酪易熔性和延展性变差的问题。
MTGase催化乳品中的蛋白交联极大地改善了奶制品的品质,提高了酸奶的蛋白网络强度、持水性、粘度、质地以及发酵剂和益生菌的活力。但交联产生的对乳品化学性质的影响(如蛋白水解有机酸、挥发性化合物等)和酸奶的感官特性变化尚不明确需进一步研究。
此外,有文献表明,TGase还可能会影响蛋白质和基于蛋白质的产品的消化率和免疫反应性,TGase聚合可以降低一些被称为严重牛奶过敏原的蛋白质的免疫反应性。有研究在测定TGase聚合对马奶蛋白和牛奶蛋白免疫反应性的影响时发现,TGase在体外消化后改变了牛奶的IgE和IgG反应性[25]。可能是因胃肠道中发生的酶反应引起食物成分的水解,暴露出影响免疫系统的抗原聚集的物质所致。而TGase的转酰胺作用可以使小麦醇溶蛋白可以完全抑制乳糜泻患者肠道T细胞分泌醇溶蛋白特异性干扰素γ,使腹腔患者的小肠中诱导更平衡的免疫反应,MTGase处理醇溶蛋白表现出的突出的生物学特性可用于诱导高危个体对天然醇溶蛋白的耐受[26]。
3.3 TGase在微胶囊领域的应用
食品微胶囊化是一种保护对外界因素和加工条件敏感的食品和食品成分的技术,可降低外部有害因素对核心材料的影响。在食品行业中,蛋白质和多糖因具有高递送率和高吸收率因而是最常用的微胶囊壁材[27]。但微胶囊化过程的蛋白质凝聚体由于聚合层之间离子相互作用导致其力学性能相对较差。而TGase因其可以修饰强化蛋白质的结构稳定性,并能改善其控释性能,在微胶囊领域良好应用[28]。
采用TGase为交联剂,通过复凝聚法制备黑胡椒精油胶囊,发现使用交联剂对黑胡椒精油胶囊具有良好的核保护作用,可用于运输活性成分萜烯,或用于其他生物活性成分的系统递送[29]。近年来,微胶囊化是功能食品中稳定益生菌细胞的有用工具,在食品和医药领域广泛应用[30]。国际乳业联合会建议益生菌产品中的益生菌需是活的,并且在保质期之前至少要达到106CFU/g的水平,才能产生生理功效[31]。而益生菌须经过胃部时不被胃酸降解,安全到达小肠,才能在宿主体内定居和增殖,发挥预防和调节胃肠道疾病的作用[32]。微胶囊化是提高益生菌在储存和消化过程中存活率的最有效方法,微胶囊不仅可以保护益生菌免受外界不利环境的影响,而且可以实现在目标位置受控释放[33]。其保护效果因壁材和包埋技术的不同而不同。有研究采用TGase诱导乳化技术,将分离的保加利亚乳杆菌和副干酪乳杆菌与乳清分离蛋白共包裹,发现TGase提高了乳清分离蛋白的Tm值,为益生菌在热条件下提供保护,在微胶囊中包埋的益生菌细胞在模拟胃液和高温条件下的存活率也显著提高[34]。
微胶囊用于封装天然活性成分(如精油、维生素)、生物活性成分、益生菌以及可以加入酸奶中的天然抗氧化色素等[35],已在食品、医药及化妆品等行业初步应用,但保护效果尚需提高。未来继续开发生物相容性高,降解性好的天然高分子材料,探究TGase对微胶囊壁材结构的改善作用,使TGase在微胶囊领域发挥更大的作用。
3.4 TGase在乳液凝胶方面的应用
在食品工业中,乳化凝胶能创造新的产品或改善现有产品(如奶酪、果酱和酸奶)的质地和感官,是一种可食用软固体材料。乳液凝胶的制备有热定形或冷定形凝胶方法两种方法。热定型方法的高温会引起热敏感成分(如蛋白质、还原糖)的降解,冷定形可通过添加交联剂的方法交联未折叠的蛋白质形成蛋白凝胶网络[36-37]。最终乳液凝胶强度取决于溶液条件和使用的交联剂类型[38]。
TGase形成的共价键的键强度大约是氢键和疏水相互作用的20倍[39]。TGase催化交联反应,需有足够的谷氨酰胺和赖氨酸残基为底物。酪蛋白虽是TGase的良好底物,但大多为球形蛋白质,如乳清蛋白球状结构紧密,有效催化位点暴露不多,并不是很好的底物[38]。热变性可以使蛋白质变性和折叠,暴露Gln和Lys残基,将热变性与TGase相结合,便可从各种动植物蛋白(如乳清蛋白、大豆蛋白和豌豆蛋白)中制备机械性能得到改善的改性凝胶[40]。目前已有研究证明添加TGase可以显著改善热变性蛋清蛋白凝胶和乳液凝胶的力学和流变性,将预加热和TGase共同作用,得到的大豆分离蛋白凝胶网络更紧密,力学性能和保水性能更好[41]。TGase的交联作用可以促进低浓度甚至不能成胶的蛋白质形成凝胶,其催化的共价键是乳液凝胶网络中的主要作用[42]。
已有研究人员通过交联剂的物理化学键和Ca2+产生的静电盐桥,使蛋白质分子上的阴离子基团之间形成物理键,制造了乳清蛋白水凝胶珠,用于益生菌的封装[43]。而在制备水包油乳状液时,用TGase和Ca2+复合交联的乳胶凝胶的功能特性比单独使用钙的性能更好,可以促进蛋白聚集,改善乳胶的保水性、冻融稳定性和质构等功能特性[38]。研究人员测定了将TG应用于稳定乳液后的体外消化率,发现TG交联后的鹰嘴豆乳液的消化率降低,这有助于创造提供受控能量摄入的新型植物性食品[33]。
以TG为交联剂,可通过形成G-L键在空间结构上提高相同蛋白质浓度下的凝胶硬度,有助于凝胶网络结构的稳定,但维系蛋白质凝胶网络稳定所需的共价键数目具有一定饱和性,过度的GL交联反而不利于凝胶的空间网络[44]。所以在实际应用时需适度添加。
3.5 TGase在食品包装及膜领域的应用
随着人们的环保意识和对食品质量要求的不断提高,可食性薄膜逐渐为人们所需,天然生物高分子材料,如蛋白质、多糖和脂类,由于其可生物降解性被认为是制备生物高分子材料最有前途的原料来源。已有用食品工业废料,如柑橘皮、木薯副产品、苹果渣以及乳清等作为可生物降解来源来生产用于食品包装的替代材料[45]。
TGase被广泛用于改善基于生物聚合物的薄膜的机械和阻隔性能,如明胶、蛋清蛋白、乳清蛋白及其与果胶、壳聚糖的组合。如明胶经TGase交联,使牛皮明胶薄膜具有了更高的交联效率和机械强度[46]。使用TGase交联蛋清蛋白膜可以改善其抗拉强度和水蒸气渗透性,最后得到的蛋清蛋白膜更加均匀、光滑,具有更好的耐水性和热稳定性,而且TGase交联还优化了复合蛋白膜的空间构象和结晶度[47]。胶原蛋白在体内是TGase细胞外基质中的重要底物,在体外,使用组织或微生物TGase治疗I型胶原可以加速胶原的自组装。近期有研究人员对经TGase处理前后用胶原纤维悬浮液制备的薄膜性能进行了分析,发现TGase交联降低了薄膜的厚度,薄膜的力学性能和热稳定性显著的提高了,通过适当的变性温度和TGase交联的平衡,胶原蛋白优良的成膜性能可以为可生物降解和可食用的包装应用提供工程胶原材料的优良方案[48]。
从农业副产品中获得的生物聚合物也可以作为潜在替代品。来自大豆、芝麻和苦豌豆的蛋白质也已被证明是生物可降解/可食用薄膜的潜在来源[49]。经酶处理的大豆分离蛋白成膜液和对成膜的影响的实验证明,TGase酶法处理是控制蛋白基生物聚合物膜物理性能的有效途径[50]。有以榨油副产物黑茴香种子的脱脂饼粕为原料,TGase为加工助剂,制备可食用蛋白膜时发现经酶处理后得到了形态均匀,机械性能良好、具阻隔性及抗菌活性的膜,且该膜良好的性能可在食品包装材料和地膜方面进行应用[45]。以上研究证实了将榨油废料作为蛋白质的可再生资源进行有效利用的可行性,也证明了TGase在制备可食用生物降解膜时的优势。
动物产品加工过程中会产生大量的副产品,这些副产品是蛋白质的良好来源,利用副产品生产生物膜可以使动物产品充分利用。利用鱼肌原纤维蛋白(Fish myofibrillar protein, FMP)成膜,探究MTG对FMP膜物理、力学和阻隔性能的影响,发现MTGase能有效地诱导FMP分子的蛋白质交联,MTGase的加入使蛋白质间的相互作用变得紧密,包括拉伸强度显著增加,水蒸气渗透率、膜溶解性、溶胀度均降低。由于蛋白质交联,FMP膜的阻水性能、紫外吸收和热稳定性都得到了明显的改善[51]。
随着生物降解膜原材料的不断开发,制备工艺的不断优化,可食性薄膜将会更广泛的应用到食品工业中,TGase也将会在食品膜领域发挥更大的作用。
4 展望
本文综述了TGase近年来在食品工业各领域的研究进展,从蛋白质资源的高级利用来看,TGase的交联为开发功能性和感官性更好的食品/饮料及智能包装纳米复合材料提供了有利条件。但目前TGase在实际工业生产中的应用仍较少,原因可能是工业生产过程中的加工条件,会对TGase的完整性造成影响,TGase狭窄的最佳使用条件也会限制其在实际工业生产中的应用。接下来可通过分子手段(基因编辑或蛋白质修饰)对传统TGase进行改造,提高催化性质,延长酶的稳定性,使改造后的酶在工业加工的极端条件下仍能发挥较好的催化活性;从来源角度,加强对TGase高产菌株的筛选,寻找高产且酶性质优良的菌株,降低工业化用酶的成本;从蛋白分子角度,对MTGase的合成方式、酶作用方式进行深入探究,尤其是其活性位点与底物结合的位点及方式,以提高在工业生产中的得率及加工应用中的精准性;从蛋白修饰角度,通过TGase的催化进行糖基化修饰是未来进行蛋白质糖基化研究的主要方向,目前糖基化所选的糖多为氨基葡萄糖类,可进一步研究不同种类的具有伯胺特性的糖类与蛋白质之间的糖基化反应,完善基于转谷氨酰胺酶途径的蛋白质糖基化技术;从人体健康来看,TGase催化产生的交联蛋白质及改性蛋白质在机体内的消化吸收过程及消化率尚不清晰,可进行进一步的研究探讨;从膜应用角度,TGase对蛋白膜阻湿性能、机械性能的改善尚不够理想, 可通过蛋白膜和其他材料(如聚乙烯醇)复合, 优化复合膜的性能, 满足不同需要;随着研究的深入及应用领域的拓展TGase将在食品行业及各行各业发挥更大的作用。
