微生物代谢黄曲霉毒素B1的研究进展
2021-06-18王利娟汪玲玲
宋 川,王利娟,汪玲玲,
(1.广东省农业生物蛋白质功能与调控重点实验室,生命科学学院,华南农业大学,广东广州 510642;2.农业部人畜共患病重点实验室,华南农业大学,广东广州 510642;3.岭南现代农业科学和技术广东省实验室,华南农业大学,广东广州 510642;4.华南农业大学生命科学学院,广东广州 510642)
黄曲霉毒素(Aflatoxin,AFT)是由黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)等真菌产生的次级代谢产物[1-2]。该类分子主要是由一个双呋喃环和一个氧杂萘邻酮组成,包括AFB1、AFB2、AFG1、AFG2、AFM1、AFM2等几十种类型,其中毒性最强、危害最大的是AFB1。农作物从收获、储藏到运输加工的各个过程中均可能受到产毒真菌的污染,其产生的AFB1通过食物链的传递,严重威胁人类和动物的生命健康。因此,目前迫切需要寻找到行之有效的解毒措施挽救因霉变带来的巨额经济损失并解决公众担忧的健康问题。
AFB1的脱毒方法主要包括物理、化学和生物法。物理脱毒法通常采用烹煮、吸附、紫外线照射等方式[3]。其中工业中应用最多的是在饲料中添加吸附剂来达到脱毒的目的,一些常见的吸附剂有水合钠铝硅酸钙、粘土、蒙脱石、活性炭等。化学脱毒法是利用化学反应改变黄曲霉毒素的分子结构,从而降低其细胞毒性的方法。常见的方法包括氨水碱处理法[4]、柠檬酸酸化法[5],还有文献报道了使用乳酸、臭氧、过氧化氢、中性电解氧化水等方法脱毒[6-7]。由于化学试剂的使用会在一直程度上对人和动物的健康造成损害,因此目前在工业中没有被广泛使用。生物法是采用微生物或者植物提取物对AFB1进行吸附或者降解从而实现脱毒目的。利用微生物及其产生的酶进行生物脱毒,有作用时间短、反应条件温和、专一性强等诸多优点,是目前公认最为理想的脱毒方法。但仍然存在着代谢机理不清晰、脱毒功能不稳定等缺点,此外在应用过程中必须综合考虑降解产物的安全性、微生物的脱毒效率以及对食品中营养物质的影响等问题,最终建立一个经济高效的微生物脱毒技术。
本文系统介绍了AFB1的生物合成途径、结构和性质及其发挥细胞毒性的分子基团;着重总结了目前已报道的可降解AFB1的微生物种类、已分离到的关键酶和已经研究清楚的微生物代谢途径;最后简要介绍了微生物在食品脱毒方面的应用基础研究。希望为通过微生物降解AFB1的研究者们提供一些指导,从而提高食品安全。
1 AFB1的形成过程、结构特征及其分子毒性基团
1.1 形成过程
目前,参与黄曲霉毒素生物合成的一系列基因、酶及调控因子已经基本清楚。如图1所示,AFB1的生物合成途径是:乙酰辅酶A→诺素罗瑞尼克酸(NOR)→奥佛兰提素(AVN)→奥佛兰凡素(HAVN)→奥佛尼红素(AVF)→羟基杂色酮(HVN)→杂色半缩醛乙酸(NHA)→杂色曲霉B(VERB)→杂色曲霉A(VERA)→柄曲霉素(DMST)→杂色曲霉素(ST)→黄曲霉毒素B1(AFB1)[8-9]。宫等分离的阿氏肠杆菌(Enterobacter asburiae)Vt-7通过产生挥发物质1-戊醇和苯乙醇,下调黄曲霉中norB基因表达量,从而抑制诺素罗瑞尼克酸转化成奥佛兰提素,继而抑制黄曲霉毒素的合成[10];Chen等发现的一株海洋巨大芽孢杆菌(Bacillus megaterium)产生的三种肽可抑制黄曲霉菌生长、孢子萌发和黄曲霉毒素产生。起关键抑制黄曲霉毒素产生的fadA-pkaA信号通路被激活,其相关基因均上调,而控制合成黄曲霉毒素的基因aflR和aflS明显下调,黄曲霉毒素产生收到抑制[11]。
1.2 结构性质
黄曲霉毒素属于二氢呋喃氧萘邻酮的衍生物。根据化学结构的不同,黄曲霉毒素可以分为两类,一类结构包含二呋喃、香豆素、环戊烯酮,如图2A所示,有 AFB1、AFB2、AFM1、AFM2、AFB2a、AFQ1等。AFB1和AFM1是被食品工业所重点关注的,AFM1是AFB1的羟基化衍生物,在牛奶中常常被检出[12];另一类结构包含二呋喃、香豆素、二氢吡喃,如图2B所示,有AFG1、AFG2、AFG2a等[13]。黄曲霉毒素相对分子量为312~346,难溶于水,易溶于氯仿、甲醇等,不溶于石油醚、己烷。具有耐热性,AFB1在268~269 ℃下才开始分解[14]。在紫外线的照射下会发出荧光,其在中性条件下较稳定,在强酸性溶液中会有极少量的分解,在碱性溶液中较易分解。
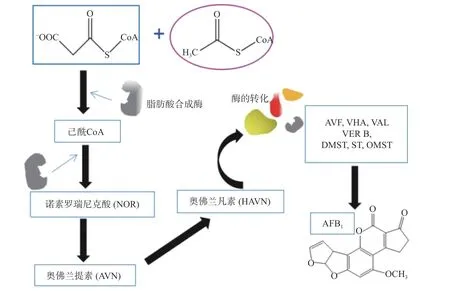
图1 黄曲霉毒素B1的生物合成途径Fig.1 Biosynthetic pathway of AFB1
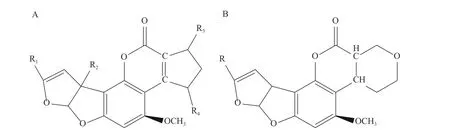
图2 黄曲霉毒素的结构Fig.2 The structure of aflatoxins
1.3 毒性基团
研究表明长期接触黄曲霉毒素会导致中毒性肝炎、肝细胞坏死、免疫抑制和肝癌的发生[15-16]。常见黄曲霉毒素的类型中毒性大小顺序依次是AFB1>AFM1>AFG1>AFB2>AFM2>AFG2,其中AFB1早在2002年被国际癌症研究机构认定为一级致癌物[17]。AFB1在人和动物体内被代谢转化成AFB1-8,9-环氧化物,AFB1-8,9-环氧化物会攻击DNA碱基鸟嘌呤的N7位点,生成AFB1-N7-Gua,导致DNA损伤[18-19]。AFB1化学结构中主要有三个毒性基团,如图3所示。第一个毒性基团是呋喃环上的8、9位双键,蛋白质和核酸会在此位点上与AFB1发生相互作用;第二个毒性基团是香豆素的内酯环部分中的10、11、15号位点;第三个基团是AFB1位于环戊烯酮环上的1、2、3、14号位点,该基团也对AFB1的毒性有一定的影响。

图3 AFB1主要的毒性基团Fig.3 Main toxic group of AFB1
2 代谢AFB1的微生物
2.1 细菌
关于细菌降解黄曲霉毒素的报道可以追溯到上世纪70年代。目前已从土壤、水、动物粪便和肠道等各种环境中成功分离到几十种AFB1代谢菌株。AFB1代谢菌主要来自变形杆菌门、放线杆菌门、厚壁菌门、拟杆菌门。厚壁菌门中主要是芽孢杆菌属[20-25];变形杆菌门中有假单胞菌属[26-27]、粘球菌属[28]、寡氧单胞菌属[29]、肠杆菌属、克雷伯菌属、埃希氏菌属[30]等属的菌株;放线杆菌门中有红球菌属[29,31]、诺卡氏菌属[31]、分支杆菌属[32]、棒状杆菌属[33]、短杆菌属、链霉菌属等属的菌株;拟杆菌门中主要有黄杆菌属等[34-35],其中部分菌株的代谢情况如表1所示。
2.2 真菌
目前报道的可以降解AFB1的真菌,主要来自担子菌门、接合菌门、子囊菌门和半知菌亚门。其中,属于担子菌门的有假蜜环菌属[40-41]、侧耳菌属[42-43]等;子囊菌门中有酵母菌属[44]、曲霉属[45-46]等;接合菌门中有毛霉属[47]、根霉属[48-49]等;半知菌亚门中有木霉菌属[50],其中部分菌株的代谢情况如表2所示。
3 微生物中参与AFB1代谢的关键酶
目前已知真菌的降解酶大部分是属于氧化还原酶类,有漆酶、过氧化物酶等。最初Liu等发现假蜜环菌(Armillariella tabescens)可以参与AFB1的生物转化[40],随后Cao从该假蜜环菌中分离纯化出黄曲霉毒素氧化酶(AFO)[54];Yehia等采用了硫酸铵、DEAE-琼脂糖凝胶柱、G-100琼脂糖凝胶柱从平菇(Pleurotus ostreatus)中提取了锰过氧化物酶(MnP),最终酶的活力达到了81 U/mL,最适温度在25 ℃,最适pH在4~5之间[55];Alberts在不同的液体培养基中研究了白腐真菌通过产生漆酶对黄曲霉毒素的降解[56],Loi从肺形杏鲍菇(Pleurotus pulmonarius)中分离出漆酶2,并证明了乙酰丁香酮(AS)等三种天然化合物可以增强该酶的降解效果[57]。
在细菌中分离得到的降解酶相对较少。多数研究结果表明降解AFB1的活性物质分布在发酵液的上清中。Zhao从橙色粘球菌(Myxococcus fulvus)ANSM068中分离提纯了一种胞外酶,命名为MADE,具有降解AFB1、AFG1、AFM1的能力[28];Xie等从泛菌(Pantoea sp)T6的发酵上清液中,分离纯化出一种可以降解AFB1的酶,命名为PADE[39];Song等从铜绿假单胞菌(Pseudomonas aeruginosa)M19上清液中采用硫酸铵分级沉淀、离子交换层析和凝胶过滤层析分离纯化了一种酶,也命名为PADE。已报道的AFB1代谢酶如表3所示。
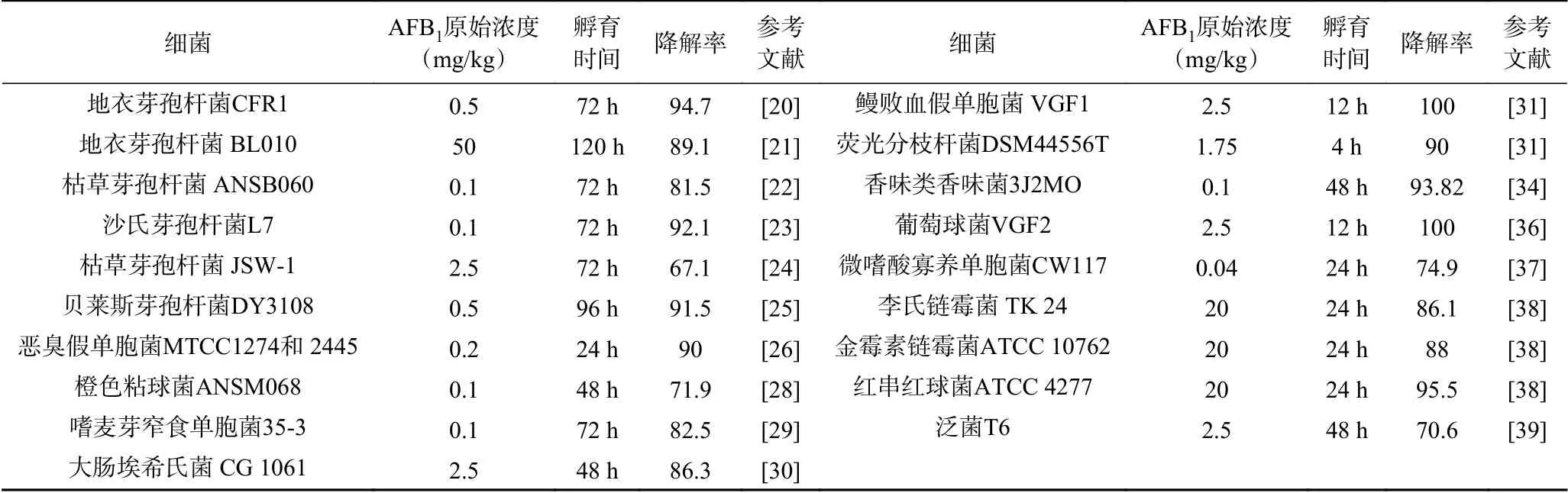
表1 降解黄曲霉毒素B1的细菌Table 1 Bacterium for degrading aflatoxin B1

表2 降解黄曲霉毒素B1的真菌Table 2 Fungi for degrading aflatoxin B1
关于微生物参与代谢AFB1关键基因的报道较少。在芽孢菌中,有的可能携带aiiA基因,它编码N-酰基高丝氨酸内酯酶(AHL),该酶具有裂解内酯环酯键的能力,因此Pereyra假设如果它们可以裂解AFB1,则是负责降解毒素的内酯部分[59]。Afsharmanesh分析了枯草芽孢杆菌(Bacillus subtilis)UTB1的全基因组,通过比对和基因敲除等实验证实其中的bacC基因能够抑制黄曲霉合成黄曲霉毒素,同时也能够降解黄曲霉毒素[60]。
4 微生物中已知的AFB1代谢途径
微生物中最早报道的AFB1代谢途径是作用在8,9-不饱和碳碳双键上的氧化反应,如图4A所示。刘大岭团队从假蜜环菌中分离纯化出的AFO作用在AFB1的8,9-不饱和碳碳双键上,首先形成AFB1-8,9-环氧化物,后又被转化为AFB1-9-羟基二烯丙基二酚[61-62]。AFO的作用是氧依赖性,并且可以产生过氧化氢。后续对该产物进行毒性试验,结果显示代谢物在小鼠的肝脏里没有毒性作用,对于鼠伤寒沙门氏菌没有致突变性,在鸡中也没有遗传毒性[41];Wang从白腐真菌(Phanerochaete sordida)YK-624中提取锰过氧化物酶处理AFB1,质子核磁共振和高分辨率的电离子质谱技术分析表明,AFB1首先被MnP氧化为AFB1-8,9-环氧化物,然后水解为AFB1-8,9-二氢二醇[63]。
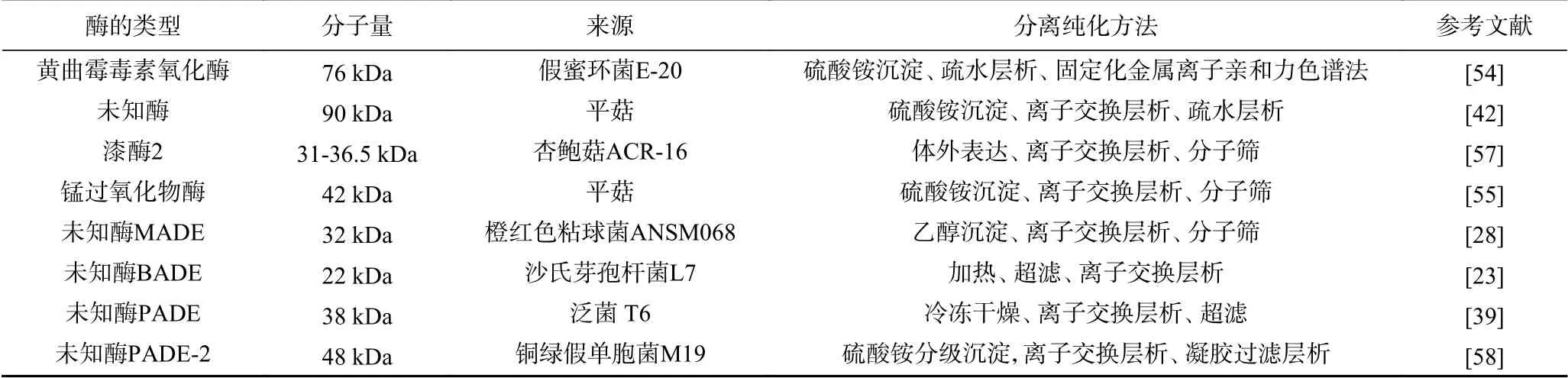
表3 黄曲霉毒素B1降解酶Table 3 Purified enzymes identified as AFB1degraders

图4 AFB1的代谢途径Fig.4 Metabolic pathway of AFB1
Samuel等报道了一株恶臭假单胞菌(Pseudomonasputida)能够高效降解AFB1,代谢产物采取硅胶柱纯化后通过红外光谱和气相质谱确定其结构,结果显示代谢是从内酯环的酯键水解开环开始的,脱羧形成代谢物AFD1,另外还可以形成AFD2[26]。其代谢途径如图4B所示。Eshelli分离得到的红球菌(Rhodococcus erythropolis)ATCC 4277能够降解AFB1,经质谱等分析代谢产物,推测AFD1可能是代谢途径中的一个中间产物[38]。
一些真菌可以可以通过与AFB1的环戊烯酮环作用,将AFB1转化成黄曲霉毒醇(AFL),其代谢途径如图4C所示。例如匍匐梨头霉(Absidia repens)、树状指孢霉(Dactylium dendroides)、灰蓝毛霉(Mucor griseo-cyanus)、根腐长孺孢(Helminthosporium sativum)[2]、木霉(Trichoderma)[49]、黑曲霉(Aspergillus niger)、黄曲霉、蜡叶散囊菌(Eurotium herbariorum)以及根霉(Rhizopus)等,其中黑曲霉又可以将AFL转化成AFB1[2]。
Taylor等报道了一株耻垢分枝杆菌产生的依赖于脱氮黄素辅助因子(F420H2)的还原酶FDR-A和FDR-B,可以还原位于黄曲霉素B1和G1上内酯环与环戊烯酮环之间的α,β-不饱和酯上的双键,得到加氢的产物[64]。它的代谢途径如图4D所示。
5 微生物代谢AFB1的应用基础研究
利用微生物或酶分解代谢AFB1的原理,可在实际生产应用中添加活性菌或者酶制剂,以缓解饲料中AFB1给饲喂动物带来的毒害。赵丽红等发现AFB1降解菌枯草芽孢杆菌ANSB060可以在一定程度上改善黄曲霉毒素对蛋鸡生产性能和蛋品质的不利影响[65];范彧用肉鸡实验证实在受黄曲霉毒素污染的花生粕中添加该菌可以抵消AFB1引起鸡的氧化损伤,抑制其对肝功能的毒害作用[66-67];另外,范彧也证实了在AFB1污染的鲤鱼饲料中添加此菌株,能够有效恢复鲤鱼的体重,改善肝脏、胰腺等功能[68]。
赵杨等发现枯草芽孢杆菌N-1a在玉米青贮试验中能够明显降低青贮过程中的黄曲霉毒素含量,并且判断活性物质是一种分泌蛋白[69];从开心果中筛选的枯草芽孢杆菌UTBSP1可以降低开心果中的AFB1[70];曹红等基于来自假蜜环菌的黄曲霉毒素氧化酶,制成酶制剂,发现其能够有效减缓AFB1对肉仔鸡肝脏的损害,从而提高肉仔鸡的平均日采食量,增加重量[71]。
6 目前研究中遇到的问题和挑战
黄曲霉毒素广泛存在于食品中,对人类的健康构成了巨大的威胁。微生物种类多,繁殖快,是最为理想的脱毒生物类群。从微生物中筛选高效降解菌并研究其分解代谢机制一直是相关领域的研究热点。目前已经分离到了包括放线菌、细菌、真菌在内的超过几十种微生物都可以分解代谢黄曲霉毒素,但研究过程中仍遇到不少问题和挑战。首先,微生物中黄曲霉毒素的代谢途径认识不足。目前仅有少数菌株明确了代谢途径。对于大部分菌株来说,AFB1是通过哪些反应形成产物的并不清楚。其次,微生物中发挥AFB1降解活性的物质不清楚。已有的文献表明一些菌株可以产生对蛋白酶敏感、热力条件下稳定的活性物质,推测是耐热酶,但是无法成功分离该物质[24,26,29-30]。这些活性物质是不是酶,是哪种酶仍然不能确定。此外,由于多数菌株的解毒基因没有成功克隆,其代谢调控机制也无从了解。由此可见,尽管明确了多种微生物能降解黄曲霉毒素的现象,但是对于其内在的代谢机制问题的认识还十分欠缺,阻碍了降解微生物的实际应用。将来还要在化合物结构鉴定、酶的分离与纯化以及功能基因分析等几个方面加强研究,只有在分子机制研究上有所突破,才能真正推进微生物脱毒菌剂走向市场。
